ESMO 2016: Skojarzenie trzech leków skuteczne w przerzutowym CRC z obecnością mutacji w genie BRAF
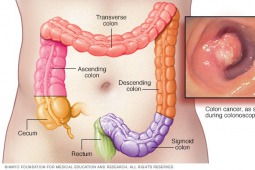
Podczas tegorocznego kongresu European Society for Medical Oncology (ESMO) w Kopenhadze przedstawiono wyniki badania klinicznego, które wykazało, że chorzy na przerzutowego raka jelita grubego (ang. metastatic colorectal cancer, mCRC) z obecnością mutacji V600E w genie BRAF leczeni skojarzeniem trzech leków: dabrafenibem, trametynibem i panitumumabem wykazują dłuższe przeżycie wolne od progresji choroby (ang. progression-free survival, PFS) w porównaniu do chorych leczonych panitumumabem w skojarzeniu z dabrafenibem lub trametynibem.
Artykuł dostępny wyłącznie dla:
lekarz, lekarz dentysta, lekarz w trakcie specjalizacji .Zaloguj się, aby przeczytać pełną treść artykułu.
Zaloguj się
Nie pamiętasz hasła?
Skorzystaj z opcji przypominania hasła, aby odzyskać dostęp do swojego konta Termedia.
Źródło:
R.B. Corcoran, T. André, T. Yoshino i wsp.
R.B. Corcoran, T. André, T. Yoshino i wsp.



