Alergia kontaktowa to zależna od mechanizmów immunologicznych reakcja nadwrażliwości typu IV na hapteny. Są to substancje o małej masie cząsteczkowej zdolne do wiązania się z własnymi białkami organizmu i przekształcania ich w antygeny immunogenne dla narażonego człowieka [1]. Najbardziej znaną chorobą rozwijającą się na podłożu alergii kontaktowej jest alergiczny wyprysk kontaktowy, jednak alergia kontaktowa może także objawiać się jako kontaktowe zapalenie spojówek, zapalenie błon śluzowych górnych i dolnych dróg oddechowych, przewodu pokarmowego oraz pochwy, a także jako reakcje nietolerancji na leki i wyroby medyczne. Eksperci Polskiego Towarzystwa Alergologicznego (PTA) oraz Polskiego Towarzystwa Dermatologicznego (PTD) zgodnie podkreślają, że jedyną metodą wykrywania alergii kontaktowej o potwierdzonej wartości diagnostycznej są testy płatkowe z haptenami [2]. W otoczeniu człowieka doliczono się już ponad 5200 haptenów – substancji o małej masie cząsteczkowej, które mogą prowokować reakcję nadwrażliwości typu IV (alergia kontaktowa) [3]. Oferta producentów materiałów do testów płatkowych obejmuje łącznie nie więcej niż 500 substancji testowych, co stanowi niespełna 10% wszystkich znanych haptenów. Ze względu na powierzchnię obszarów zdatnych do badania (grzbiet, w drugiej kolejności uda lub ramiona), u dorosłego pacjenta można przebadać jednocześnie niewiele ponad 100 substancji testowych, a typowy odstęp między kolejnymi testami płatkowymi wynosi co najmniej miesiąc [4]. Uświadamia to konieczność testowania w pierwszym rzędzie haptenów, które są najczęstszą przyczyną alergii kontaktowej w danej populacji i w danych warunkach narażenia. Serie podstawowe do testów płatkowych są próbą odpowiedzi na zapotrzebowanie lekarzy praktyków w tym zakresie.
Do czego służą serie podstawowe?
Pierwszą linię terapii chorób alergicznych stanowi identyfikacja, a następnie unikanie wszystkich uczulających pacjenta czynników. Dlatego w procesie diagnostyki alergologicznej należy dążyć do uwzględnienia wszystkich haptenów, które mogą prowokować nawroty jego choroby. Jednak mnogość haptenów w otoczeniu człowieka oraz liczne i często trudne do zidentyfikowania źródła narażenia powodują, że ustalenie indywidualnej listy haptenów dla każdego badanego jest dużym wyzwaniem. Aby wspomóc lekarzy w tym zakresie, wprowadzono serie podstawowe (standardowe) obejmujące hapteny najczęściej uczulające daną populację, na przykład mieszkańców określonego kraju lub grupę zawodową. Należy przy tym zaznaczyć, że serie podstawowe, jak sama nazwa wskazuje, stanowią zaledwie podstawę indywidualnego programu diagnostycznego. U każdego pacjenta powinno się rozważyć testy z dodatkowymi haptenami stosownie do jego specyficznych narażeń [5]. Pomocne w tym mogą być uzupełniające serie diagnostyczne tworzone z myślą o szczególnych grupach epidemiologicznych, takich jak dzieci, chorzy na wyprysk podudzi, fryzjerzy, frezerzy i tokarze.
Skąd się biorą serie podstawowe?
Pierwszą serią podstawową do testów płatkowych w naszym kraju był „Polski zestaw alergenów kontaktowych”, opracowany przez Rudzkiego oraz Kleniewską i zaaprobowany na wniosek Sekcji Alergologicznej przez Zarząd Główny Polskiego Towarzystwa Dermatologicznego [6]. Warto podkreślić, że była to jedna z pierwszych serii podstawowych w Europie i na świecie. Jej twórcy inspirowali się wprawdzie seriami niewiele wcześniej wprowadzonymi w Skandynawii i Szwajcarii [7, 8], jednak lista substancji testowych odzwierciedlała wyniki testów płatkowych wykonanych u 1800 polskich pacjentów [6].
Próbę unifikacji testów w skali europejskiej – zarówno w zakresie wykonywania, jak i zestawu haptenów diagnostycznych – podjęła Międzynarodowa Grupa Badająca Wyprysk Kontaktowy (International Contact Dermatitis Research Group – ICDRG) powołana do życia w 1966 roku [9]. Historycznym osiągnięciem tej grupy było zaproponowanie skali do oceny nasilenia reakcji skórnej i zapisu wyników w testach płatkowych, która do dziś pozostaje standardem powszechnie stosowanym na świecie [10]. Po kilku latach wspólnych badań ICDRG zaproponowała w 1974 roku pierwszą serię standardową, którą przedstawiono pod trzema nazwami „Standard European Series”, „ICDRG Standard Series” i „Standard European Battery” [11]. Co znamienne, w artykule przedstawiającym tę serię znalazła się deklaracja, że badania wieloośrodkowe będą kontynuowane, a ich wyniki będą podstawą aktualizacji serii, tak aby odzwierciedlała ona bieżącą sytuację epidemiologiczną i narażenia na hapteny w środowisku domowym i zawodowym. Zamieszczona w pierwszej publikacji zapowiedź, że aktualizacje będą raz w roku ogłaszane w British Journal of Dermatology nie została spełniona, za to grupa ICDRG w kolejnych latach opublikowała w różnych czasopismach szereg ważnych prac na temat alergicznego wyprysku kontaktowego (najnowsze w 2021 roku) [9]. Jako ciekawostkę można potraktować fakt, że ICDRG nadal aktualizuje swoją serię podstawową, choć nie wydaje się, żeby była ona stosowana w jakimkolwiek kraju. W 1985 roku powstała Europejska Grupa Badająca Środowiskowy Wyprysk Kontaktowy (European Environmental Contact Dermatitis Research Group – EECDRG). Grupa początkowo była skupiona na aktualizacjach Europejskiej Serii Standardowej, w późniejszych latach przeniosła swoje zainteresowanie na inne aspekty alergii kontaktowej [12].
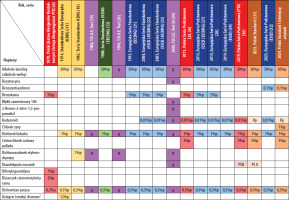
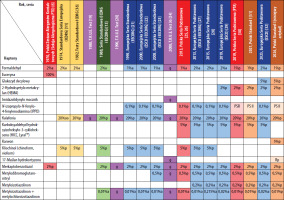
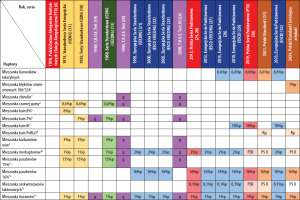
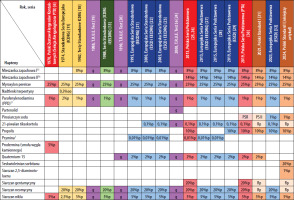
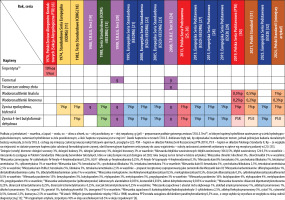
W 1988 roku ukazała się wspólna publikacja ICDRG i EECDRG zawierająca sugestie zmian w składzie serii europejskiej [13]. W tym samym 1988 roku zostało powołane do życia Europejskie Towarzystwo Wyprysku Kontaktowego (European Society of Contact Dermatitis – ESCD), przy znaczącym udziale członków ICDRG oraz EECDRG. Od 1996 roku w strukturach ESCD działa Europejski System Obserwacji Alergii Kontaktowej (European Surveillance System of Contact Allergies – ESSCA) – grupa robocza, w której uczestniczą ośrodki z różnych krajów europejskich, w tym także z Polski (Łódź, Kraków, Poznań). Regularnie publikowane są analizy wyników zebranych w ramach grupy, zarówno w zakresie kolejnych wersji serii podstawowej, jak i w odniesieniu do specyficznych grup i narażeń (dzieci, alergia kontaktowa na leki zewnętrzne, wyprysk z podrażnienia, wyprysk zawodowy itd.) [14–17]. W tabeli 1 przedstawiono historię zmian w Polskiej Serii Podstawowej (PSP) oraz Europejskiej Serii Podstawowej (ESP) [18–33].
Jak powstają serie podstawowe?
Założeniem tworzenia serii podstawowej jest, że powinna ona obejmować wszystkie częste uczulacze dla danej grupy docelowej (mieszkańcy danego obszaru, grupa ryzyka), przy czym za „częsty uczulacz” uznaje się hapten, który powoduje reakcje dodatnie u co najmniej 0,5–1% badanych w danej grupie. Dodatkowe kryteria brane pod uwagę w procesie decyzyjnym to częstość występowania reakcji istotnych klinicznie, czyli wskazujących na przyczyny bieżących objawów u chorych. Analizuje się także rozpowszechnienie haptenu w środowisku, co pomaga odróżnić hapteny faktycznie uczulające daną populację od haptenów reagujących krzyżowo [34]. Spełnienie tych postulatów wymaga stałego gromadzenia i zbiorczej analizy wyników testów płatkowych, a także włączania nowych podejrzanych haptenów do serii podstawowej w celu oceny, czy częstość występowania reakcji dodatnich uzasadnia ich pozostawienie w serii na stałe. Ponawiane analizy pozwalają także zidentyfikować hapteny, na które częstość uczuleń się zmniejsza i które w związku z tym można usunąć z serii podstawowej.
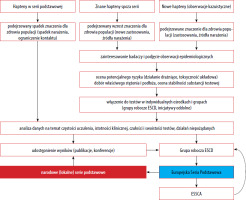
Jak przedstawiono powyżej, Europejską Serię Podstawową (ESP) na przestrzeni ostatniego półwiecza tworzyli i rozwijali badacze skupieni początkowo w ICDRG, później w EECDRG i wreszcie w ESCD we współpracy z siecią ESSCA. Ostatecznie w 2017 roku w strukturach ESCD powołano odrębną grupę roboczą dedykowaną wyłącznie Europejskiej Serii Podstawowej (European Baseline Series Group – EBSG). Dwa razy w roku odbywają się spotkania grupy, na których dyskutowane są bieżące dane oraz ewentualna potrzeba zmian w serii podstawowej. W przypadku wątpliwości lub rozbieżności zdań członkowie grupy inicjują badania w celu zgromadzenia większej liczby danych (tzw. audit studies). Na rycinie 1 zilustrowano procesy przepływu informacji w ramach monitorowania składu ESP. Od utworzenia w 2017 roku grupa opublikowała dwie rekomendacje dotyczące modyfikacji składu tej serii [29, 32]. Europejska Seria Podstawowa stanowi punkt odniesienia dla poszczególnych krajów, które mogą stosować ją w formie niezmienionej lub modyfikować w zależności do lokalnej sytuacji epidemiologicznej. W niektórych krajach działają ponadto lokalne grupy obserwujące lokalne trendy i modyfikujące skład krajowych serii podstawowych, na przykład IVDK (Informationsverbund Dermatologischer Kliniken zur Erfassung und wissenschaftlichen Auswertung der Kontaktallergien), DKG (Deutsche Kontaktallergie-Gruppe), GIRDCA (Gruppo Italiano Ricerca Dermatiti da Contatto e Ambientali), SIDAPA (Società Italiana di Dermatologia Allergologica Professionale e Ambientale), GEIDAC (Grupo Español de Investigación en Dermatitis de Contacto y Alergia Cutánea), GERDA (Groupe d’Etudes et de Recherches en Dermato-Allergie), BSCA (British Society for Cutaneous Allergy). Grupy narodowe ściśle współpracują z ESSCA jako organizacje stowarzyszone, a także przez licznych członków udzielających się w obu grupach i udostępniających swoje dane sieci europejskiej.
Dlaczego składy serii podstawowych są zmieniane?
Czynniki determinujące skład serii podstawowych można podzielić na:
Postęp wiedzy medycznej
Wraz ze zmianami stylu życia, konsumpcji i technologii niektóre hapteny znikają z naszego otoczenia, co pociąga za sobą redukcję częstości uczuleń. W tym samym czasie inne hapteny stają się bardziej rozpowszechnione, przez co częstość uczuleń na nie narasta. Zmieniające się narażenia i trendy epidemiologiczne powodują konieczność okresowego rewidowania składu serii podstawowych w celu zapewnienia ich maksymalnej skuteczności diagnostycznej, czy to przez usuwanie haptenów coraz rzadziej powodujących uczulenia, czy to przez dodanie haptenów zyskujących na znaczeniu. Ostatnia decyzja o eliminacji haptenów z ESP dotyczyła pryminy 0,01% waz. oraz kliochinolu 5% waz. w 2019 roku [29]. Powodem usunięcia tych haptenów były dane epidemiologiczne z grupy ESSCA pokazujące, że w całej Europie reakcje dodatnie na te hapteny zdarzają się bardzo rzadko (odpowiednio 0,2% i 0,3%) i z reguły nie mają istotności klinicznej [35]. W miejsce tych haptenów dodano propolis 10% oraz 2-hydroksyetylometakrylan (HEMA) 2% waz., których znaczenie w alergicznym wyprysku kontaktowym narasta w wielu krajach Europy [29]. Najnowsza aktualizacja polegała na dodaniu benzoizotiazolinonu, glukozydu decylowego oraz pirosiarczynu sodu do ESP [32].
Benzoizotiazolinon (BIT, INCI: benzisothiazolinone) jest powszechnym konserwantem farb do malowania wnętrz, w tym farb reklamowanych jako „hipoalergiczne” [36, 37]. Może uczulać z obuwia, rękawic winylowych i innych. Aktualnie benzoizotiazolinon rzadko występuje w kosmetykach, choć jego zastosowanie jest dopuszczone prawem. Opisano przypadek alergii na BIT, którego źródłem było mydło w płynie [38]. Jako substancja lotna BIT może powodować wyprysk powietrznopochodny; opisano również przypadek systemowej reaktywacji alergicznego wyprysku kontaktowego na skutek wdychania par benzoizotiazolinonu [39]. W Wielkiej Brytanii stwierdzono spektakularny wzrost częstości odczynów dodatnich na BIT z 0,26% w 2014 roku do 3,42% w 2019 roku [40]. W najnowszych badaniach ogólnoeuropejskich odsetek uczulonych wśród pacjentów zakwalifikowanych do testów wyniósł 4,7% [41], natomiast w północnoamerykańskich – nawet 10,4% [42]. W ślad za ESP, benzoizotiazolinon został w 2024 roku włączony do Polskiego Standardu I.
Glukozyd decylowy (INCI: decyl glucoside) to przedstawiciel grupy glikozydów alkilowych – niejonowych substancji powierzchniowo czynnych (surfaktantów) otrzymywanych przez połączenie glukozy z ziemniaków lub kukurydzy z tłuszczami roślinnymi, m.in. z kokosa. Ze względu na naturalne pochodzenie, biodegradowalność oraz niewielkie działanie drażniące glikozydy alkilowe są coraz chętniej stosowane w kosmetykach. Mimo ich niewielkiego potencjału uczulającego, powszechność stosowania tych związków powoduje wzrost częstości uczuleń, zwłaszcza u osób z obciążeniem atopowym. Amerykańskie Towarzystwo Wyprysku Kontaktowego (ACDS) uznało glikozydy alkilowe za grupowy „alergen roku 2017” [43]. Spośród stosowanych w testach glikozydów alkilowych – poliglukozydu kokosowego, glukozydu laurylowego i glukozydu decylowego, najczęściej uczula ten ostatni. Odsetek pacjentów z dodatnimi testami płatkowymi na glukozyd decylowy wynosi aktualnie 1,4% w Europie i 2,1% w USA [41, 42], co stało się podstawą włączenia glukozydu decylowego do ESP w 2023 roku [32]. W ślad za tym glukozyd decylowy 5% waz. został włączony do Polskiego Standardu I w 2024 roku. Oprócz ESP i PS I, hapten ten został uwzględniony również w Brytyjskiej Serii Standardowej, a także Chińskiej i Północnoamerykańskiej Serii Podstawowej.
Pirosiarczyn sodu (INCI: sodium metabisulfite; E223) prowokuje dodatnie odczyny u 1,9% pacjentów zakwalifikowanych do rutynowych testów płatkowych w Kanadzie, 3,3% w USA i aż 4,0% w Europie [44–46]. Odsetek odczynów istotnych klinicznie, czyli takich, które wyjaśniały aktualne problemy pacjentów, wahał się w różnych badaniach od 3,9% do 65,5% z wyraźną tendencją wzrostową wraz z upowszechnianiem się wśród lekarzy wiedzy na temat występowania pirosiarczynu w naszym otoczeniu [47]. W badaniach własnych uczulenie na pirosiarczyn sodu wykryliśmy u 5 wśród 104 kolejnych polskich pacjentów (4,8%), z czego u 2 (40,0%) udało się ustalić źródło haptenu i potwierdzić związek z bieżącym wypryskiem [48]. Jak z tego wynika, wskaźniki epidemiologiczne w pełni uzasadniają włączenie pirosiarczynu sodu do serii podstawowej. Spełniony jest także postulat powszechnego narażenia – pirosiarczyn sodu stanowi składnik licznych produktów konsumpcyjnych, w tym kosmetyków, leków i produktów spożywczych, w których odgrywa rolę konserwantu, antyutleniacza i substancji redukującej. Zawiera go 29% farb do włosów sprzedawanych w Polsce, a także 9% toników do twarzy, 1% żeli pod prysznic. Ponadto sporadycznie występuje w podkładach do twarzy, żelach oczyszczających, kremach promieniochronnych, kremach na noc, „dermokosmetykach” i produktach stosowanych w salonach kosmetycznych [48, 49]. Pirosiarczyn sodu jest dodawany do produktów leczniczych i wyrobów medycznych (kremy, maści, czopki, preparaty do wstrzyknięć), a także do żywności jako środek przeciwdziałający rozwojowi bakterii i pleśni (dodatek spożywczy E223). W wymienionych produktach pirosiarczyn sodu jest stosunkowo łatwy do wytropienia dzięki obowiązkowi informowania o składnikach, jednak są także źródła mniej oczywiste, np. nowe wyroby tekstylne i materiały stosowane w budownictwie oraz przemyśle metalowym.
Pirosiarczyn sodu jest reprezentantem grupy siarczynów (sulfitów), do której także należą:
pirosiarczyn potasu (disiarczyn potasu, INCI: potassium metabisulfite), składnik kosmetyków; konserwant spożywczy E224 dodawany do owoców i wyrobów owocowych, piwa, wina, miodów, mrożonych frytek, stosowany także jako środek bielący,
siarczyn amonu (INCI: ammonium sulfite) – składnik kosmetyków,
siarczyn potasu (INCI: potassium sulfite) – składnik kosmetyków,
siarczyn sodu (INCI: sodium sulfite) – składnik kosmetyków; konserwant i antyutleniacz spożywczy E221 stosowany m.in. jako polepszacz chleba, konserwant mięs i wędlin, sałatek, piwa, karmelu, produktów na bazie żółtek jaj,
wodorosiarczan amonu (INCI: ammonium bisulfite) – składnik kosmetyków,
wodorosiarczyn sodu (INCI: sodium bisulfite) – składnik kosmetyków; spożywczy dodatek konserwujący i wybielający E222.
Podobnie jak pirosiarczyn sodu, inne siarczyny mogą występować w kosmetykach, lekach, żywności, a także odzieży, obuwiu, rękawicach z gumy naturalnej i syntetycznej oraz innych produktach (przegląd w [47]). Reakcje krzyżowe między siarczynami (sulfitami) są częste, dlatego osoby ze stwierdzoną alergią na pirosiarczyn sodu powinny unikać innych sulfitów, a w razie konieczności należy u nich wykonać testy płatkowe z innymi związkami z tej grupy [50]. Amerykańskie Towarzystwo Wyprysku Kontaktowego (ACDS) ogłosiło sulfity zbiorczo „alergenem roku 2024”, wskazując na potrzebę włączenia pirosiarczynu sodowego jako reprezentanta tej grupy do serii podstawowej [47]. W ślad za Europejską Serią Podstawową pirosiarczyn sodu został w 2024 roku włączony do Polskiego Standardu I.
Hapteny specyficzne dla populacji polskiej
Zmiany w rodzimych seriach do testów płatkowych mogą niekiedy wyprzedzać podobne decyzje w odniesieniu do ESP. Przykładem może być tutaj propolis, który od 2013 roku był uwzględniony w PSP. Wynikało to z polskich badań epidemiologicznych, w których dodatnie testy płatkowe z propolisem stwierdzono u 16,5% dzieci i młodzieży oraz u 4,6% dorosłych pacjentów zakwalifikowanych do testów płatkowych [25, 51]. W ESP propolis pojawił się dopiero w 2019 roku, gdy polskie obserwacje epidemiologiczne potwierdziły się w innych krajach europejskich [29].
Pallad pojawił się w PSP jednocześnie z propolisem, a podstawą tej decyzji były wyniki polskich badań wieloośrodkowych [25]. Cztery dekady temu pallad rzadko występował w środowisku, a dodatnie testy płatkowe z palladem były z reguły uznawane za reakcje krzyżowe z niklem [52]. Jednak rozwój technologii oraz zmiany w regulacjach prawnych spowodowały, że pallad upowszechnił się w naszym otoczeniu. W związku z wprowadzonymi w Europie ograniczeniami zawartości niklu w biżuterii (tzw. dyrektywa niklowa), pallad zastąpił nikiel w złocie jubilerskim. Metal ten jest nieodzownym elementem w komputerach osobistych, telefonach komórkowych oraz innej elektronice; stosowany jest do galwanizacji przedmiotów użytkowych, takich jak zegarki. Pallad stanowi powszechny składnik w stopach stosowanych w stomatologii (aparaty ortodontyczne, korony, implanty) i ortopedii (endoprotezy, stabilizacje kostne); może też występować w innych wszczepianych wyrobach medycznych (stenty, rozruszniki, stymulatory itd.). Obowiązkowe stosowanie w samochodach katalizatorów spalin skutkuje uwalnianiem palladu do środowiska. To zwiększone narażenie spowodowało wzrost częstości uczuleń. W ogólnopolskich badaniach wieloośrodkowych alergię na pallad wykryto u 11,4% badanych rutynowo pacjentów, z czego u 4,2% uznano ją za istotną klinicznie. Co ważne, 1,6% pacjentów miało dodatnie reakcje na pallad i jednocześnie ujemne na nikiel, co sugeruje, że dodatnie odczyny na pallad nie są już tylko wyrazem reakcji krzyżowej na nikiel [25]. Kolejne polskie badania wieloośrodkowe z udziałem 1026 pacjentów wykazały, że czterochlorek sodowy palladu 3% waz. cechuje się wyższą czułością diagnostyczną (19,9% reakcji dodatnich) w porównaniu z dichlorkiem palladu 2% waz. (9,7%) [53]. Przytoczone dane z nawiązką spełniają kryteria włączenia czterochlorku palladu 3% waz. do serii podstawowej.
Linalol (INCI: linalool) jest jedną z najczęściej stosowanych w przemyśle substancji zapachowych. Może występować w perfumach, kosmetykach oraz produktach chemii gospodarczej. Linalol zawierają liczne olejki eteryczne, między innymi olejek lawendy (do 42% linalolu), olejek cytrynowy (do 18%) oraz olejek bergamotowy (do 9%). W warunkach otoczenia linalol ulega samoistnej degradacji do wodoronadtlenków linalolu, które są główną przyczyną uczuleń u ludzi. W grupie roboczej ds. ESP włączenie wodoronadtlenków linalolu oraz omówionego poniżej limonenu jest przedmiotem dyskusji od początku istnienia grupy. Na razie oba te hapteny pozostawiono w Europejskiej Serii Rozszerzonej z powodu podnoszonego przez niektórych badaczy działania drażniącego obu tych haptenów (ryzyko wystąpienia reakcji fałszywie dodatnich) [29]. Jednak badania wieloośrodkowe obejmujące 1608 polskich pacjentów wykazały dodatnie reakcje na wodoronadtlenki linalolu 1% waz. u 9,8% z nich, w tym u 4,7% reakcje te zostały uznane za istotne klinicznie [54]. Ponadto metaanaliza danych z wielu badań epidemiologicznych wykazała, że potencjał drażniący wodoronadtlenków linalolu i limonenu jest niższy niż w przypadku rutynowo stosowanych w testach płatkowych balsamu peruwiańskiego (Myroxylon pereirae) oraz Mieszanek zapachowych I i II [55]. Wskaźniki te przemawiały za włączeniem wodoronadtlenków linalolu 1% waz. do PSP. Wodoronadtlenki linalolu są także uwzględnione w składzie Australijskiej Serii Podstawowej, Belgijskiej Serii Standardowej, Brytyjskiej Serii Standardowej, Chińskiej Serii Podstawowej oraz Nowozelandzkiej Serii Podstawowej.
Limonen (INCI: limonene) jest powszechnym składnikiem kosmetyków, domowych detergentów, proszków, płynów do mycia i prania oraz odświeżaczy powietrza. Limonen może występować w produktach spożywczych jako składnik naturalny, zanieczyszczenie lub dodatek smakowy. Limonen jest naturalnym składnikiem olejków eterycznych, zawierają go między innymi olejek grejpfrutowy biały (do 94% limonenu), olejek mandarynki (do 82%), olejek nasion selera (do 75%), olejek cytrynowy (do 66%). Limonen jest stosowany w przemyśle jako środek odtłuszczający powierzchnie metalowe przed obróbką (stężenie 30–100%), jako środek czyszczący w przemyśle elektronicznym i drukarskim (stężenie 50–100%), a także w produktach do pielęgnacji drewna oraz instrumentów muzycznych. Limonen ulega samoistnej degradacji do wodoronadtlenków limonenu, które są główną przyczyną uczuleń u ludzi. Badania wieloośrodkowe obejmujące 1608 polskich pacjentów wykazały dodatnie reakcje na wodoronadtlenki limonenu 0,3% waz. u 7,7% z nich, w tym u 3,2% reakcje te zostały uznane za istotne klinicznie [54]. Wskaźniki te zdecydowały o włączeniu wodoronadtlenków limonenu 0,3% waz. do Polskiej Serii Podstawowej. Wodoronadtlenki limonenu są także uwzględnione w składzie Brytyjskiej, Australijskiej, Belgijskiej, Chińskiej oraz Nowozelandzkiej Serii Podstawowej.
Siarczan 2,5-diaminotoluenu (siarczan 2,5-toluenodiaminy, INCI: toluene-2,5-diamine sulfate; CI 76042) to podstawowy składnik farb do włosów. W 2018 roku siarczan 2,5-toluenodiaminy był obecny w składzie 55% farb do włosów oferowanych na polskim rynku [49]. Można go znaleźć w składzie „hipoalergicznych” farb do włosów, ponieważ ma wykazywać mniejszy potencjał uczulający od parafenylenodiaminy. Mimo to nadal istnieje realne ryzyko uczulenia się na ten składnik farb do włosów. Alergię na siarczan 2,5-diaminotoluenu wykryto u 1,4% holenderskich pacjentów testowanych z serią podstawową [56], a także u 9,8% polskich fryzjerów z podejrzeniem choroby zawodowej [57]. Oprócz Polskiego Standardu I, siarczan 2,5-diaminotoluenu jest uwzględniony w Północnoamerykańskiej oraz Australijskiej Serii Podstawowej, a także w Międzynarodowej Serii Rozszerzonej.
Karwon (INCI: carvone), a także jego pochodne – tlenek karwonu i dihydrokarwon – są stosowane w kosmetykach jako substancje zapachowe oraz maskujące. Mogą występować w kosmetykach, takich jak pasty do zębów, płukanki do ust, mydła, szampony i odżywki do włosów, żele pod prysznic. Karwon jest stosowany w materiałach dentystycznych (nici, wyciski dentystyczne). Jako substancja smakowa (aromat) karwon jest dodawany do produktów spożywczych, takich jak gumy do żucia, landrynki, czekolady nadziewane, likiery. Olejek mięty zielonej (Mentha spicata, spearmint) może w ponad 50% składać się z karwonu, natomiast olejek mięty pieprzowej (Mentha piperita, peppermint) zawiera karwon w śladowych ilościach [58]. Częstość dodatnich odczynów na karwon wśród rutynowo testowanych pacjentów ocenia się na 0,8–2,8%, co stało się podstawą postulatu włączenia karwonu do Szwedzkiej Serii Podstawowej [59, 60].
Cyna jest miękkim metalem nieszlachetnym o wielu zastosowaniach, a jej związki stosowane są m.in. jako składniki kosmetyków i dodatki spożywcze. Metaliczna cyna jest wykorzystywana w lutowaniu oraz cynowaniu powierzchni przedmiotów metalowych, w tym puszek na konserwy. Może być także składnikiem stopów dentystycznych i amalgamatów (tzw. srebrne plomby). Chlorek cyny jest dodatkiem do żywności (numer E512) stosowanym jako stabilizator koloru i przeciwutleniacz, m.in. w przetworach owocowych i warzywnych, a także w tkaninach jako utrwalacz koloru. Tlenek cyny dodawany jest do kosmetyków w celu uzyskania pożądanej lepkości, gęstości lub zmętnienia. W cieniach do powiek, kredkach do oczu, eyelinerach i innych kosmetykach kolorowych związki cyny występują w postaci pigmentów o numerach CI 77861 (tlenek cyny) oraz CI 77864 (chlorek cyny). We fluorowanych pastach do zębów jako źródło fluoru stosowany jest difluorek cyny (INCI: stannous fluoride). Analiza własna wykazała, że wśród 2210 kosmetyków innych niż pasty do zębów oferowanych w krakowskich sklepach w latach 2014–2022 ponad 6% zawierało związki cyny – najczęściej były to kremy, żele, podkłady i balsamy do twarzy oraz ciała, farby do włosów, szminki, pomadki, błyszczyki i balsamy do ust (własne nieopublikowane dane). Źródłem cyny w większości dotychczas opisanych przypadków alergii były pasty do zębów oraz amalgamaty [61–66]. Opisano również przypadki zawodowego wyprysku na cynę, w tym wyprysku powietrznopochodnego na opary lutu cynowego [67–69]. Częstość dodatnich reakcji na cynę obserwowana w różnych populacjach waha się w szerokim zakresie od 0,3% do 8,2% [61, 70, 71]. Wśród 324 polskich pacjentów istotne klinicznie dodatnie odczyny na chlorek cyny odnotowano u 7,4% badanych [72].
Seskwioleinian sorbitanu (SOS) zwraca coraz baczniejszą uwagę badaczy i w 2023 roku grupa robocza ESCD zarekomendowała jego dodanie do Europejskiej Serii Podstawowej [32]. Za rutynowym wykonywaniem testów płatkowych z SOS przemawia częstość występowania reakcji dodatnich wynosząca w różnych populacjach od 0,2% do 10,7% [73, 74]. W rutynowych testach płatkowych reakcje dodatnie stwierdzono u 4,9% polskich pacjentów [75]. Może to wynikać z narażenia konsumentów na ten emulgator. W kosmetykach oferowanych w krakowskich sklepach i drogeriach SOS był składnikiem 5,9% balsamów do ciała, 5,5% podkładów do twarzy, 5,3% dezodorantów, a także 2,5% szminek i produktów do pielęgnacji ust [75]. Dodatkowym argumentem przemawiającym za włączeniem seskwioleinianu sorbitanu do serii podstawowej jest jego obecność jako emulgatora w rutynowo stosowanych haptenach diagnostycznych. Pięć substancji testowych w PSP i sześć w PS I zawiera SOS: mieszanka zapachowa I, żywica Myroxylon pereirae (balsam peruwiański), glukozyd decylowy, formaldehyd, 2-hydroksyetyometakrylan (HEMA), metyloizotiazolinon (MI) oraz mieszanka metyloizotiazolinonu z chlorometyloizotiazolinonem (MI/MCI). Seskwioleinian sorbitanu jest ponadto obecny jako emulgator podłoża w absolucie mchu dębowego, aldehydzie glutarowym, izoeugenolu, DMDM hydantoinie oraz żywicy melaminowo-formaldehydowej. Stężenia SOS jako emulgatora wynoszą od 1% do 5% i są niższe od stężenia optymalnego do wykrywania alergii kontaktowej na ten hapten (20%), jednak w przypadku współwystępowania dodatniej reakcji na SOS oraz na którąś z wyżej wymienionych substancji testowych należy rozważyć możliwość reakcji na emulgator. Obecność SOS w rutynowej serii pozwala wychwycić przypadki potencjalnie fałszywie dodatnich reakcji na wymienione hapteny [76]. Oprócz Polskiego Standardu I, seskwioleinian sorbitanu jest także uwzględniony w składzie Włoskiej oraz Północnoamerykańskiej Serii Podstawowej.
Postęp technologiczny
Oprócz dodawania lub usuwania haptenów, wyrazem postępu są ulepszone podłoża, które mogą nie tylko poprawiać czułość i swoistość oraz powtarzalność wyników testów płatkowych, lecz także zwiększać komfort stosowania. Ulepszenia mogą polegać na bardziej równomiernej dyspersji haptenu w podłożu, jego lepszej penetracji do skóry oraz zmniejszeniu ryzyka ulotnienia się haptenu z komory testowej. Postęp technologiczny umożliwił między innymi zamianę kłopotliwych w odmierzaniu i podatnych na wysychanie roztworów wodnych na maści wazelinowe. W przypadku haptenów polarnych rozwiązanie to wymagało wprowadzenia seskwioleinianu sorbitanu do niektórych podłoży, co zostało omówione powyżej. W PSR i PS I ulepszenia te dotyczą substancji do testowania w kierunku alergii na formaldehyd, metyloizotiazolinon oraz metylochloroizotiazolinon.
Formaldehyd znajduje się na liście serii podstawowych od samego początku. Ze względu na postać – roztwór wodny, hapten ten sprawiał sporo problemów, częściowo wynikających z jego odparowywania z komór testowych (reakcje fałszywie ujemne). Próbą odpowiedzi na ten problem było zwiększenie od 2019 roku stężenia roztworu wodnego formaldehydu z 1% do 2% w ESP, które poprawiło czułość metody [29, 77]. Jednak polskie badania wieloośrodkowe wskazują, że lepszym rozwiązaniem jest zastosowanie 1% roztworu formaldehydu w wazelinie z emulgatorem. Wśród 624 pacjentów zakwalifikowanych do testów płatkowych na wodny roztwór formaldehydu 1%, odnotowano 13 reakcji dodatnich, w tym 2 uznane za istotne klinicznie, natomaist na formaldehyd 1% w wazelinie z emulgatorem – 57 reakcji dodatnich, w tym 24 istotne klinicznie [78]. Preparat formaldehydu w wazelinie cechuje się nie tylko większą czułością, lecz także większą wygodą stosowania, dlatego właśnie takie rozwiązanie zostało zastosowane najpierw w PSP, a później w PS I.
Metyloizotiazolinon i metylochloroizotiazolinon (MI/MCI) to mieszanka dwóch konserwantów w stosunku 1 : 3 znana między innymi pod handlową nazwą Kathon CG. Szeroko stosowana jest między innymi jako konserwant kosmetyków, płynów, chłodziw przemysłowych, materiałów budowlanych, w tym farb „hipoalergicznych” [79]. Ta kompozycja znajduje się w składzie ESP od 1988 roku, jednak nadal trwa dyskusja nad optymalnym stężeniem. Ze względu na niską czułość diagnostyczną początkowe stężenie mieszanki 0,01% zostało zwiększone do 0,0215% w 2014 roku, jednak w 2019 roku nastąpiła kolejna korekta do 0,02% w związku z obawami o ryzyko aktywnego uczulenia [27, 29]. Problem z niską czułością mógł jednak wynikać nie tyle ze zbyt małego stężenia, ile z wodnego podłoża. Roztwory wodne parują, a ponadto MI oraz MCI są same w sobie substancjami lotnymi. W przypadku opóźnionego nawet o kilka minut naklejenia przygotowanych testów na grzbiet pacjenta komora z MI/MCI może już być sucha, przez co nie dojdzie do penetracji haptenów do skóry, a to z kolei może skutkować reakcją fałszywie ujemną. W badaniach polskich spośród 624 pacjentów na wodny roztwór MI/MCI 0,01% odnotowano 26 reakcji, w tym 19 istotnych klinicznie, natomiast na MI/MCI 0,01% w wazelinie – 60 reakcji dodatnich, w tym 39 istotnych klinicznie [78]. Wyniki te stanowiły argument za włączeniem preparatu wazelinowego MI/MCI 0,01% do PSP i PS I. Analogicznie roztwór wodny 0,2% metyloizotiazolinonu zamieniono na preparat wazelinowy o tym samym stężeniu. Aby zapewnić równomierne rozproszenie cząsteczek polarnych w niepolarnej wazelinie, zarówno w przypadku formaldehydu, jak i metyloizotiazolinonu oraz metylochloroizotiazolinonu, konieczne jest dodanie do podłoża omówionego wcześniej seskwioleinianu sorbitanu.
Ograniczenia techniczne
Ograniczenia techniczne mogą mieć wpływ na dostępność haptenów do diagnostyki. Przykładem technicznych czynników o negatywnym wpływie na skład serii do testów płatkowych mogą być trudności z pozyskaniem surowców o odpowiedniej czystości. Hapteny produkowane na drodze syntezy mogą zawierać domieszki sub- stratów przejściowych, które są faktycznymi uczulaczami. Taka sytuacja zachodzi w przypadku betainy kokamidopropylowej (kokamidopropylobetaina, betaina kokosowa), która nie ma potencjału uczulającego. Faktycznym haptenem jest w tym przypadku 3-dimetyloaminopropylamina wykorzystywana jako substrat w syntezie betainy kokamidopropylowej, która pozostaje w ostatecznym produkcie jako zanieczyszczenie [80]. Zapewnienie czystości i stałości składu wykorzystywanych surowców stanowi duże wyzwanie dla producentów. Substancje pochodzenia naturalnego mogą się różnić składem i potencjałem uczulającym w zależności od kraju pochodzenia [81]. Mogą także być zanieczyszczone m.in. środkami ochrony roślin lub konserwantami [82]. Do czynników wpływających na dostępność haptenów, a przez to na skład serii podstawowych, należą także inne wyzwania technologiczne, takie jak niestabilność haptenów oraz trudności z zapewnieniem odpowiednich właściwości substancji testowych, m.in. równomiernego rozproszenia haptenu w podłożu oraz dobrej penetracji do skóry. Spośród 546 substancji testowych oferowanych w ostatniej dekadzie przez firmę Chemotechnique Diagnostics w chwili pisania niniejszego artykułu były dostępne 483 substancje. Od 22 kwietnia 2022 do 22 kwietnia 2024 roku producent Chemotechnique Diagnostics ogłosił wstrzymanie produkcji 13 substancji testowych z powodu niedostępności surowców o wymaganej jakości, z czego 5 zostało przywróconych w późniejszym terminie. Ponadto między 1 lutego 2021 a 22 kwietnia 2024 roku producent wycofał z katalogu na stałe 30 innych substancji bez podania przyczyny.
Mieszanka czarnej gumy oraz N-fenylo-N-izopropylo-4-fenylenodiamina stanowią pouczającą ilustrację, jak problemy surowcowe mogą wpływać na skład serii podstawowych. Mieszanka czarnej gumy (MCG) zawiera trzy zawieszone w wazelinie składniki: N-cykloheksylo-N-fenylo-4-fenylenodiaminę (CPPD; 0,25%), N,N´-difenylo--p-fenylenodiaminę (DPPD; 0,25%) oraz N-fenylo-N-izopropylo-4-fenylenodiaminę (IPPD; 0,1%). Związki te dodawane są do czarnej gumy w celu spowolnienia jej degradacji i wydłużenia żywotności. MCG była w składzie pierwszej serii ICDRG, jednak od 1994 roku została zastąpiona przez IPPD zarówno w serii ICDRG, jak i wyodrębnionej już wówczas Europejskiej Serii Standardowej [21]. Zmiana ta nie wynikała jednak z przesłanek epidemiologicznych, lecz z niedostępności dwóch składników tej mieszanki w wymaganej czystości chemicznej. Dostępna bez ograniczeń była jedynie IPPD – składowa mieszanki, na którą stwierdzono najwięcej reakcji dodatnich, w tym reakcji krzyżowych z CPPD i DPPD. Na tej podstawie niedostępną mieszankę czarnej gumy wymieniono w serii podstawowej na IPPD. Zmiana ta jednak wiązała się z utratą czułości diagnostycznej, ponieważ 10% pacjentów uczulonych na MCG w testach z poszczególnymi składnikami nie reagowało na IPPD [83]. Obecnie obie brakujące substancje – CPPD i DPPD – są już dostępne w wymaganej czystości, jednak ESP oraz większość serii narodowych w Europie (w tym PSP), a także Chińska Seria Podstawowa nadal zawierają IPPD. MCG jest natomiast składnikiem międzynarodowej (ICDRG), australijskiej, północnoamerykańskiej, indyjskiej, fińskiej i szwedzkiej serii podstawowych oraz testu T.R.U.E. Aktualnie w EBSG toczy się dyskusja nad przywróceniem MCG do ESP po 30 latach nieobecności.
Mieszanka barwników tekstylnych 6,6% (MBT) ilustruje nakładanie się różnorodnych ograniczeń oraz ich wpływ na serie podstawowe. Na podstawie obserwacji kazuistycznych i badań epidemiologicznych wyłoniono najczęściej uczulające barwniki tekstylne [84]. Następnie eksperci ESCD uzgodnili skład MBT do diagnostyki przesiewowej wyprysku tekstylnego [28]. W zgodzie z międzynarodowymi trendami MBT 6,6% znalazła się także w składzie PSP z 2019 roku [30]. Po kilku latach stosowania okazało się jednak, że mieszanka ta zbyt często powoduje reakcje fałszywie dodatnie u osób z alergią na barwniki do włosów. Wynika to z obecności oranżu zawiesinowego 3, który reaguje krzyżowo z farbami do włosów. W badaniach własnych 50% pacjentów uczulonych na siarczan tolueno-2,5-diaminy i 33% uczulonych na parafenylenodiaminę jednocześnie reagowało na MBT oraz oranż zawiesinowy 3 [85]. Eksperci ESCD rekomendują ulepszenie mieszanki przez usunięcie oranżu zawiesinowego 3 z jej składu, czyli stworzenie Mieszanki barwników tekstylnych II (MBT II 5,6%). Ponadto częste reakcje ujemne na MBT zawierającą 0,3% błękitu zawiesinowego 104 i błękitu zawiesinowego 126 u pacjentów z dodatnimi odczynami na indywidualnie testowane błękity zawiesinowe 104 i 126 (stężenia po 1%) wskazują, że kolejnym ulepszeniem MBT powinno być zwiększenie stężeń błękitów w mieszance do 1% (MBT 7%, po 1% dla każdego z 7 składników) [85]. Niestety w chwili pisania tego artykułu od ponad roku nie była dostępna żadna mieszanka barwników tekstylnych – ani w pierwotnym składzie uwzględnionym w ESP i PSP, ani w wersji ulepszonej MBT II, ani tym bardziej w „wersji idealnej” MBT 7%. Oznacza to, że MBT od ponad roku występuje w składzie Europejskiej Serii Podstawowej oraz w seriach narodowych wyłącznie teoretycznie. Brak MBT jest przykładem omawianych powyżej ograniczeń technicznych wpływających na skład serii podstawowych, ponieważ wynika on z braku składnika wszystkich rozważanych wersji – oranżu zawiesinowego 1 w wymaganej czystości. Należy mieć nadzieję, że producent ostatecznie pozyska surowiec o odpowiednich parametrach, jednak wtedy pojawi się pytanie, czy mieszanki 5,6% lub 7% będą mogły zostać wprowadzone do obrotu, ponieważ aktualnie forsowane są regulacje o działaniu mrożącym na innowacje w zakresie haptenów diagnostycznych [2, 86]. Z powodu niedostępności wszystkich mieszanek barwników tekstylnych polski dystrybutor zdecydował się zamiast MBT tymczasowo wprowadzić do PSP mieszankę błękitów zawiesinowych 106/124 – barwników będących najczęstszą przyczyną wyprysku tekstylnego. Również w Brytyjskiej Serii Standardowej mieszanka błękitów zawiesinowych 106/124 jest aktualnie stosowana jako marker alergii na barwniki tekstylne.
Ograniczenia administracyjne
Po 2021 roku dostępność haptenów lekowych do testów płatkowych uległa ograniczeniu ze względu na toczący się w Unii Europejskiej, dotąd nierozstrzygnięty, spór na temat kwalifikacji prawnej i sposobu rejestracji haptenów diagnostycznych [86]. Do problemu tego w kontekście polskich realiów odnieśli się niedawno eksperci Polskiego Towarzystwa Alergologicznego i Polskiego Towarzystwa Dermatologicznego [2]. W związku z nierozstrzygniętą sytuacją prawną polski dystrybutor substancji do testów płatkowych firmy Chemotechnique Diagnostics zdecydował o wstrzymaniu dystrybucji haptenów o aktywności farmakologicznej do czasu wyjaśnienia sprawy. Pozostałe 25 substancji testowych z PSP przemianowano na PS I. Zmianie tej towarzyszyła informacja o konieczności uzupełnienia PS I o wykonywane w aptece zamienniki niedostępnych substancji. Receptura zamienników wraz z oceną ich stabilności została przedstawiona w odrębnym artykule [33]. Zgodnie z aktualną Farmakopeą Polską XIII preparaty identyczne z oryginalnymi haptenami diagnostycznymi można w aptece wykonać dla siarczanu neomycyny, siarczanu gentamycyny oraz budezonidu.
Obecność siarczanu gentamycyny w PSP wynika z częstości uczuleń – dodatnie odczyny na ten antybiotyk stwierdzono u 4,5% spośród 1608 polskich pacjentów poddanych rutynowym testom płatkowym w ramach ogólnopolskich badań wieloośrodkowych [87]. Bardzo zbliżoną częstość uczuleń (4,6%) obserwowano w Finlandii [88]. Pod względem częstości reakcji gentamycyna przewyższa neomycynę (1,1–3,8%), co może wynikać z rozpowszechnienia tego antybiotyku w lekach [87]. W Polsce, obok postaci iniekcyjnej i infuzyjnej, gentamycyna występuje w popularnych lekach dermatologicznych (Bedicort G™, Belogent™, Diprogenta™, Triderm™), okulistycznych (Gentamicin WZF™, Dexamytrex™), a także w gąbce Garamycin™ do leczenia zakażeń kości i tkanek miękkich.
Opracowanie zamiennika dla Mieszanki kain III (MK III) wprowadzonej do ESP i PSP w 2019 roku stanowi przykład sytuacji, w której przeszkody prawne i techniczne mogą przynieść postęp. Oryginalna MK III zawiera benzokainę 5%, chlorowodorek dibukainy 2,5% oraz chlorowodorek tetrakainy 2,5% w wazelinie. Mieszanka ta zastąpiła stosowaną wcześniej benzokainę 5% waz., ponieważ skuteczniej wykrywa alergię na leki znieczulające miejscowo [29]. Ze składu MK III w Polsce jako surowce farmaceutyczne do receptury aptecznej dostępne są benzokaina (anestezyna) i chlorowodorek tetrakainy. Trzeci składnik – dibukaina (cynchokaina) aktualnie występuje w Polsce wyłącznie w dwóch gotowych lekach złożonych (Proktosedon™ czopki i maść), które nie nadają się jako ewentualny materiał do wytworzenia substancji testowej z powodu obecności dodatkowych składników [33]. Ze względu na niewielkie narażenie na dibukainę w Polsce pominięcie tego środka znieczulającego w testach nie wydaje się szczególnie dokuczliwe. Zwraca za to uwagę popularność w naszym kraju lidokainy – innego amidowego środka znieczulającego miejscowo, który nie jest uwzględniony w MK III. Obecnie w Polsce dopuszczono do obrotu 76 preparatów z zawartością lidokainy i jest to liczba preparatów znacznie przewyższająca inne kainy razem wzięte. Dla porównania, drugie miejsce pod względem liczby dopuszczonych preparatów zajmuje benzokaina (26 preparatów), a tetrakaina występuje w 5 preparatach. W wyniku tych rozważań, zamiast niedostępnej aktualnie w Polsce MK III, zaproponowano mieszankę trzech „polskich” kain (PolKa3), której wykonanie można zlecić w każdej aptece leków robionych [33].
Zdecydowanie największy problem stanowi niedostępność 21-piwalanu tiksokortolu – haptenu uważanego za najlepszy marker alergii na glikokortykosteroidy grupy A [22]. Obecnie 21-piwalan tiksokortolu nie jest dostępny w Polsce ani jako surowiec farmaceutyczny, ani jako lek gotowy. Potencjalnym zamiennikiem tiksokortolu dostępnym w naszym kraju mógłby być 21-octan hydrokortyzonu, również zaliczany do grupy strukturalnej A, jednak wykrywa on alergię znacznie rzadziej niż 21-piwalan tiksokortolu. Badania epidemiologiczne wykazują, że w roli markera alergii na glikokortykosteroidy lepiej sprawdza się roztwór 17-maślanu hydrokortyzonu 1% w alkoholu. Związek ten zaliczany jest wprawdzie do grupy strukturalnej D2, ale przedstawiciele tej grupy wykazują reaktywność krzyżową z grupą A glikokortykosteroidów [89]. W badaniach z udziałem 189 pacjentów uczulonych na glikokortykosteroidy wykazano, że 17-maślan hydrokortyzonu rzadziej niż 21-piwalan tiksokortolu wykrywa alergię na glikokortykosteroidy. Różnica ta nie jest duża jednak, szczególnie gdy bierze się pod uwagę odczyny istotne klinicznie, które w tej grupie na 17-maślan hydrokortyzonu odnotowano u 19,0%, natomiast na 21-piwalan tiksokortolu u 22,2% badanych [90]. Sposób wykonania zamienników dla niedostępnych haptenów testowych z zawartością substancji farmakologicznie czynnych został szczegółowo przedstawiony gdzie indziej [33], podobnie jak przyczyny obecnych ograniczeń [2].
Pozostaje mieć nadzieję, że pod wpływem głosów polskich oraz europejskich ekspertów obecne problemy z dostępnością haptenów diagnostycznych i wynikające stąd szkody dla zdrowia publicznego zostaną dostrzeżone przez decydentów, którzy usuną bariery ograniczające dostęp pacjentów do diagnostyki alergologicznej zgodnej z aktualnym stanem wiedzy. Przy braku systemowych rozwiązań problem będzie się nasilał wraz z odkrywaniem nowych haptenów w naszym otoczeniu. Z niedawnej przeszłości pamiętamy „epidemie” alergii na dimetylofumaran i metyloizotiazolinon [91–93]. Niedawne badania z zastosowaniem narzędzi sztucznej inteligencji wytypowały kilka nowych haptenów, które mogą spowodować podobne problemy w przyszłości. Na liście potencjalnych „haptenów przyszłości” znalazły się: akrylan izobornylu (IBOA, CAS 5888-33-5), N,N-dimetyloakrylamid (CAS 2680-03-7), siarczek dimetylotiokarbamylobenzotiazolu (CAS 3432-25-5), wodoronadtlenek geraniolu (nr CAS nienadany), aldehyd cyklamenowy (CAS 103-95-7), salicylan heksylu (CAS 6259-76-3) i kafeinian prenylu (CAS 118971-61-2) [94]. Przytoczone predykcje na temat IBOA już znajdują potwierdzenie w obserwacjach klinicznych [95–97]. W Polsce akrylan izobornylu przed dwoma dekadami wywołał epidemię alergii przemysłowej, a obecnie jest przyczyną coraz częstszych reakcji alergicznych na pompy insulinowe u diabetyków [98–100]. Pozostaje mieć nadzieję, że skutkiem obecnie forsowanych barier biurokratycznych nie będzie zablokowanie możliwości diagnostyki uczulenia na wymienione wyżej, ale także inne hapteny przyszłości, o których istnieniu być może nawet jeszcze nie słyszeliśmy.