Wprowadzenie
Podstawą rozpoznawania alergicznego wyprysku kontaktowego, reakcji polekowych oraz innych chorób na podłożu alergii kontaktowej są testy płatkowe z haptenami. Te egzogenne substancje o niskiej masie cząsteczkowej (poniżej 1000 daltonów) mogą inicjować reakcję nadwrażliwości typu IV (alergia kontaktowa) u osób o indywidualnych predyspozycjach [1]. Zgodnie z aktualnym stanem wiedzy testy płatkowe są jedyną metodą o potwierdzonej skuteczności klinicznej, a zarazem złotym standardem wykrywania alergii kontaktowej [2]. Konieczność włączenia leków, takich jak gentamycyna, neomycyna, glikokortykosteroidy i środki znieczulające miejscowo, do rutynowych testów płatkowych wynika z obserwowanej częstości uczuleń wśród pacjentów oraz obecności uczulających haptenów w składzie wielu popularnych leków, w tym preparatów dostępnych bez recepty [3]. Z powszechnie przyjętej reguły wynika, że hapten należy włączyć do serii podstawowej, jeśli częstość uczulenia wśród rutynowo testowanych pacjentów jest większa niż 0,5–1% [4]. Analizy wyników u pacjentów zakwalifikowanych do rutynowych testów płatkowych pokazują, że warunek ten spełnia siarczan gentamycyny (4,5–4,6% odczynów dodatnich), mieszanka kain III (1,3–4,1%), siarczan neomycyny (1,1–3,8%), budezonid (0,6–0,7%) oraz 21-piwalan tiksokortolu (0,1–1,7%). Obserwowana częstość uczuleń oraz narażenie na wymienione substancje (a w przypadku glikokortykosteroidów także na substancje z tych samych grup strukturalnych) były podstawą włączenia tych leków do Polskiej Serii Podstawowej zgodnej ze „Standardami w alergologii”, wydanie III z 2019 roku [5]. Po 2021 roku dostępność haptenów lekowych uległa ograniczeniu ze względu na toczący się w całej Europie i nierozstrzygnięty dotąd spór na temat kwalifikacji prawnej i sposobu rejestracji haptenów diagnostycznych [6]. W związku z niepewną sytuacją prawną polski dystrybutor substancji do testów płatkowych firmy Chemotechnique Diagnostics zdecydował o wstrzymaniu dystrybucji haptenów o aktywności farmakologicznej do czasu wyjaśnienia sprawy. W celu uniknięcia nieporozumień pozostałe 25 substancji testowych z Polskiej Serii Podstawowej przemianowano na Polski Standard I. Zmianie tej towarzyszyła informacja o konieczności zastąpienia wycofanych haptenów lekami gotowymi dostępnymi w aptece. To rozwiązanie nie było jednak optymalne z powodu istotnych różnic w stężeniach oraz sposobie aplikacji tych samych substancji jako haptenów diagnostycznych w porównaniu z ich zastosowaniami leczniczymi. Poniżej przedstawiamy receptury preparatów, które mogą zastąpić niedostępne obecnie leki z Polskiej Serii Podstawowej jako identyczne zamienniki (siarczan neomycyny, siarczan gentamycyny, budezonid) lub jako zamienniki zbliżone (mieszanki środków znieczulających miejscowo, czyli kain).
Dostępność antybiotyków niezbędnych do testów płatkowych
Oba antybiotyki wchodzące w skład Polskiej Serii Podstawowej – gentamycyna oraz neomycyna – są dostępne jako surowce farmaceutyczne do receptury aptecznej [7]. W tym zakresie wykonanie substancji testowych zgodnych z serią podstawową nie stanowi problemu. Stosowne recepty zostały przedstawione w tabeli 1.
Tabela 1
Wzory recept na substancje testowe w pełni zgodne ze składem Polskiej Serii Podstawowej
Dostępność glikokortykosteroidów niezbędnych do testów płatkowych
Budezonid jest dostępny jako składnik leków gotowych, przy czym najbardziej przydatny do wykorzystania wydaje się produkt leczniczy Budezonid LEK-AM. W tym preparacie kapsułki do inhalatora, oprócz budezonidu, zawierają jedynie laktozę jednowodną – substancję pomocniczą, która zgodnie z obecnym stanem wiedzy nie ma potencjału uczulającego [8]. Recepturę zgodnej z serią podstawową substancji testowej z wykorzystaniem leku Budezonid LEK-AM przestawiono w tabeli 1.
Zdecydowanie największy problem dotyczy 21-piwalanu tiksokortolu – haptenu diagnostycznego uważanego za najlepszy marker alergii na glikokortykosteroidy [9]. Aktualnie nie jest on dostępny w Polsce ani jako surowiec farmaceutyczny, ani jako lek gotowy. Potencjalnym zamiennikiem tiksokortolu dostępnym w Polsce jest alkoholowy roztwór 17-maślanu hydrokortyzonu 0,1%. Maślan hydrokortyzonu jest trzecim po 21-piwalanie tiksokortolu oraz budezonidzie preferowanym markerem alergii na glikokortykosteroidy. Wyniki europejskich badań wieloośrodkowych wykazały, że 17-maślan hydrokortyzonu rzadziej niż 21-piwalan tiksokortolu wykrywa alergię na glikokortykosteroidy. Spośród 189 pacjentów uczulonych na glikokortykosteroidy dodatnie odczyny na 17-maślan hydrokortyzonu odnotowano u 74, natomiast na 21-piwalan tiksokortolu u 101 badanych, jednak różnica zmniejszała się, gdy brano pod uwagę wyłącznie odczyny istotne klinicznie (odpowiednio 36 i 42 pacjentów) [10]. Preparatem 17-maślanu hydrokortyzonu o największej czułości diagnostycznej jest 1% roztwór alkoholowy, natomiast testy z 17-maślanem hydrokortyzonu 1% w wazelinie mogą wykrywać zaledwie 20% uczulonych [11]. Dlatego maści i kremy z maślanem hydrokortyzonu należy uznać za mało przydatne do testów. Przy braku 17-maślanu hydrokortyzonu jako surowca farmaceutycznego, 1% roztwór alkoholowy 17-maślanu hydrokortyzonu można uzyskać przez zatężenie preparatu Locoid płyn 0,1% 30 ml przez odparowanie, a następnie rozpuszczenie uzyskanych składników suchych w 3 ml etanolu. Prawdopodobnie niewielu alergologów i farmaceutów zdecyduje się na takie kroki. Zadowolą się raczej dostępnym komercyjnie preparatem Locoid płyn 0,1%, który jednak cechuje się mniejszą czułością diagnostyczną od roztworu 1%. Można to ograniczenie kompensować dodaniem do serii testowej maści z 21-octanem hydrokortyzonu 0,5% dostępnej komercyjnie jako Hydrocort 5 mg/g maść. W aspekcie reakcji krzyżowych oraz reprezentowanych grup strukturalnych glikokortykosteroidów, 21-piwalan tiksokortolu oraz 21-octan hydrokortyzonu należą do grupy strukturalnej A, natomiast 17-maślan hydrokortyzonu zaliczany jest do grupy strukturalnej D2, której przedstawiciele wykazują reaktywność krzyżową z grupą A. W świetle tych danych 21-octan hydrokortyzonu mógłby uchodzić za lepszy zamiennik dla niedostępnego 21-piwalanu tiksokortolu. Jednak częstość alergii kontaktowej na 21-octan hydrokortyzonu jest relatywnie niska – w badaniach z udziałem 12 682 włoskich pacjentów wyniosła ona zaledwie 0,08% [12]. Dla porównania: odsetek dodatnich odczynów na 21-piwalan tiksokortolu wyniósł w badaniach ogólnoeuropejskich 0,56%, a na 17-maślan hydrokortyzonu – 0,31% [13].
Wadą stosowania leków gotowych w testach płatkowych jest obecność substancji pomocniczych, z których niektóre same mogą być uczulaczami. Rekomendowany przez nas Locoid™ roztwór na skórę zawiera jako substancje pomocnicze: alkohol izopropylowy, glicerol, powidon, kwas cytrynowy, cytrynian sodu i wodę oczyszczoną [14]. Spośród nich pojedyncze przypadki reakcji alergicznych opisano w piśmiennictwie tylko w odniesieniu do glicerolu i powidonu. Dla porównania, pozornie bardzo zbliżony produkt tego samego producenta – emulsja Locoid™ Crelo – zawiera już znacznie więcej składników pomocniczych o znanym działaniu uczulającym, między innymi alkohol cetostearylowy, eter cetostearylowy makrogolu 25 (PEG 25), glikol propylenowy, parahydroksybenzoesan propylu i parahydroksybenzoesan butylu [15]. Stosując wymienione leki gotowe, należy przestrzegać zaleceń producenta odnośnie do terminu ważności produktu.
Dostępność środków znieczulających miejscowo (kain) niezbędnych do testów płatkowych
Od 2019 roku w składzie Polskiej Serii Podstawowej występuje Mieszanka kain III (benzokaina 5%, dibukaina 2,5% oraz tetrakaina 2,5%), która zastąpiła benzokainę 5% [5]. Zmiana ta była wzorowana na aktualizacji Europejskiej Serii Podstawowej rekomendowanej przez ekspertów European Society of Contact Dermatitis (ESCD). Wykazali oni, że Mieszanka kain III skuteczniej od wcześniej stosowanej benzokainy wykrywa alergię na leki znieczulające miejscowo [16, 17]. Spośród haptenów wchodzących w skład Mieszanki Kain III jako surowce farmaceutyczne do receptury aptecznej w Polsce dostępne są benzokaina (anestezyna) i tetrakainy chlorowodorek (ametokaina, pantokaina) [7]. Trzeci składnik Mieszanki kain III – dibukaina (cynchokaina) – aktualnie występuje w Polsce wyłącznie w gotowych lekach złożonych (Proktosedon czopki i maść). Obecność w tych preparatach innych składników, w szczególności octanu hydrokortyzonu i siarczanu neomycyny, praktycznie wyklucza Proktosedon jako potencjalne źródło dibukainy do testów płatkowych [18, 19]. Octan hydrokortyzonu obecny w tych preparatach z jednej strony hamowałby reakcje alergiczne (ryzyko odczynów fałszywie ujemnych), z drugiej – sam jest haptenem zaliczanym do grupy strukturalnej A glikokortykosteroidów, choć – jak już wspomniano – częstość alergii kontaktowej na 21-octan hydrokortyzonu jest niska. Natomiast reakcje na neomycynę są znacznie częstsze niż na dibukainę. W badaniu z udziałem 43 722 północnoamerykańskich pacjentów reakcje dodatnie na siarczan neomycyny stwierdzono u 2583 (5,91%), natomiast na dibukainę u 105 (0,24%) badanych [20]. W badaniach niemieckich częstość dodatnich odczynów na dibukainę była wyższa od przytoczonych danych północnoamerykańskich i wyniosła 0,59% wśród 3563 kolejnych pacjentów. Nadal jednak jest to wartość o rząd wielkości niższa od częstości odczynów na siarczan neomycyny [21]. Można się spodziewać, że w przypadku zastosowania Proktosedonu jako materiału do testów płatkowych nieliczne przypadki alergii na dibukainę prawdopodobnie zagubiłyby się w „szumie tła” spowodowanym przez neomycynę.
Częstość dodatnich reakcji na dany lek może odzwierciedlać różną ekspozycję w poszczególnych krajach [3]. Nie mamy danych na temat rozpowszechnienia alergii na dibukainę wśród polskich pacjentów, jednak obecność zaledwie 2 preparatów na polskim rynku wydaje się wskazywać na jej raczej niewielkie znaczenie w naszym kraju. Zwraca natomiast uwagę rozpowszechnienie i popularność preparatów z zawartością lidokainy (lignokainy) w Polsce. W badaniach z udziałem 1819 kanadyjskich pacjentów częstość reakcji dodatnich na lidokainę (0,77%) była wyższa niż na dibukainę (0,55%) [22]. Zarówno dibukaina, jak lidokaina należą do tej samej grupy strukturalnej amidowych środków znieczulających miejscowo. Zastąpienie w składzie mieszanki kain niedostępnej w Polsce jako surowiec farmaceutyczny i rzadko występującej w lekach gotowych dibukainy lidokainą, na którą narażenie polskich pacjentów jest znacznie większe, może poprawić skuteczność diagnostyczną mieszanki. Potwierdzenie tego przypuszczenia wymagałoby jednak przeprowadzenia badań porównawczych w odpowiednio licznej grupie pacjentów zakwalifikowanych do testów płatkowych.
W związku z niedostępnością wszystkich składników Mieszanki kain III najprostszą alternatywą może wydawać się powrót do benzokainy 5% waz. stosowanej w seriach podstawowych do testów płatkowych w Europie do 2019 roku. Jednak wiązałoby się to z ryzykiem niewykrycia alergii na środki znieczulające miejscowo u znaczącej grupy pacjentów. Wśród 53 portugalskich pacjentów z dodatnią reakcją na co najmniej jeden z anestetyków (benzokaina, tetrakaina, prokaina, amylokaina, lidokaina, cynchokaina, prylokaina), 36 (69,8%) miało ujemny wynik testu z benzokainą [23]. W sytuacji niedostępności oraz ograniczonego narażenia na dibukainę (cynchokainę) w Polsce optymalnym rozwiązaniem jest stosowanie mieszanki benzokainy z tetrakainą i lidokainą, a w razie braku dostępności tetrakainy – benzokainy z lidokainą. Dla ułatwienia mieszanki te nazwaliśmy odpowiednio PolKa3 i PolKa2 (skrótowiec słów „polskie kainy” z liczbą składników). Historyczny rozwój mieszanek kain, obecność środków znieczulających miejscowo w produktach leczniczych dostępnych w Polsce oraz proponowane zamienniki dla aktualnie niedostępnej Mieszanki kain III zostały przedstawione w tabeli 2. Ze względu na występowanie lidokainy oraz tetrakainy w licznych i popularnych lekach dostępnych w Polsce, mieszanka PolKa3 wydaje się w naszych warunkach optymalna, być może nawet lepsza od Mieszanki Kain III z Europejskiej Serii Podstawowej. W tabeli 3 zestawiono składy preparatów sporządzonych i wypróbowanych jako alternatywy dla niedostępnej Mieszanki kain III w ramach niniejszego artykułu.
Tabela 2
Narażenie pacjentów w Polsce na środki znieczulające miejscowo a skład mieszanek kain do testów płatkowych
[i] MK – mieszanka kain, MK III – mieszanka kain III (w składzie Europejskiej Serii Podstawowej oraz Polskiej Serii Podstawowej, aktualnie niedostępna w Polsce), PolKa3 („polskie kainy 3”) – sugerowany przez autorów zamiennik recepturowy dla MK III. *Nie mylić z “POLOCAINE – mepivacaine hydrochloride injection” (Fresenius Kabi USA).
Tabela 3
Wzory recept na zamienniki Mieszanki kain III (MK III) z Polskiej Serii Podstawowej (PTA 2019)
Wykonanie preparatów haptenów diagnostycznych
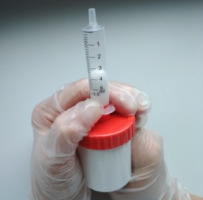
Wszystkie receptury przedstawione w niniejszym artykule zostały przetestowane pod względem zgodności recepturowej oraz stabilności w Katedrze Technologii Postaci Leku i Biofarmacji Wydziału Farmaceutycznego Uniwersytetu Jagiellońskiego Collegium Medicum w Krakowie [24]. Preparaty sporządzono w warunkach aseptycznych w jednorazowych pojemnikach z tworzywa sztucznego, przy użyciu miksera recepturowego Eprus® U500. Odważone podłoże oraz bardzo miałko rozdrobnione substancje lecznicze mieszano z zachowaniem odpowiednich parametrów mieszania, tj. z szybkością 1400 obr./min przez 2 min [25]. Po zakończeniu procesu odłączono pojemnik i przełożono maść do strzykawki o pojemności 5 ml (Braun Inject). W tym celu wyjęto tłok ze strzykawki, nałożono jej korpus na króciec pojemnika i wywierając nacisk na ruchome dno, przesunięto maść do strzykawki ( ryc. 1). Następnie za pomocą tłoka strzykawki usunięto powietrze i nadmiar maści, zapewniając jednolite wypełnienie bez przestrzeni powietrznych. Wylot strzykawki uszczelniono korkiem Combi Stopper Braun. Zgodnie z zaleceniami Farmakopei Polskiej XIII, w przypadku maści typu zawiesin sporządzonych z użyciem substancji do celów farmaceutycznych, okres przydatności do użycia nie powinien być dłuższy niż 30 dni (dotyczy to wszystkich powyższych maści z wyjątkiem maści z budezonidem 0,01%). W przypadku preparatów zawierających lek gotowy (recepta z budezonidem) okres przydatności do użycia jest nie dłuższy niż 25% czasu pozostałego do terminu ważności produktu leczniczego lub wynosi 3 miesiące, w zależności od tego, który okres jest krótszy [26, 27].
Ocena stabilności sporządzonych preparatów
Preparaty bezpośrednio po sporządzeniu oraz po 18-miesięcznym okresie przechowywania w komorze klimatycznej (Memmert typ HPP, Niemcy) w temperaturze 25°C i wilgotności względnej 60% poddano ocenie wizualnej pod kątem homogenności rozproszenia cząstek stałych i zabarwienia. Zgodnie z zaleceniem Farmakopei Polskiej XIII (Leki sporządzane w aptece) preparaty obserwowano w cienkiej warstwie na płytce szklanej [26]. Badanie wizualne nie wykazało widocznych zmian w tych preparatach (tab. 4). Na rycinie 2 zestawiono obrazy wykonanych preparatów bezpośrednio po sporządzeniu oraz po 18 miesiącach przechowywania. Cechy wizualne maści: barwa i homogenność rozproszenia składników w punkcie końcowym obserwacji, nie wykazują różnic w stosunku do stanu początkowego.
Rycina 2
Preparaty z haptenami lekowymi bezpośrednio po sporządzeniu (A) oraz po 18 miesiącach przechowywania (B)
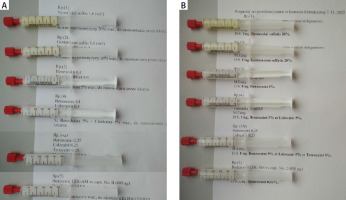
Tabela 4
Ocena wizualna preparatów proponowanych jako zamienniki dla haptenów diagnostycznych z Polskiej Serii Podstawowej (PTA 2019)
Podsumowanie
Zmiany w składzie serii podstawowych do testów płatkowych wynikające z postępu nauk medycznych wpływają korzystnie na praktykę kliniczną w zakresie alergii kontaktowej, natomiast nadmierna regulacja materiałów do testów płatkowych oraz ograniczona dostępność odpowiedniej jakości surowców do produkcji haptenów diagnostycznych odbijają się niekorzystnie na praktyce klinicznej, a także zdrowiu chorych na alergiczny wyprysk kontaktowy oraz inne choroby na podłożu alergii typu IV. Niezależnie od barier prawnych dotyczących haptenów diagnostycznych, sytuacja epidemiologiczna wskazuje jednoznacznie na konieczność testowania pacjentów w kierunku alergii kontaktowej na leki w ramach rutynowych testów płatkowych. Jednym ze sposobów złagodzenia aktualnych problemów z dostępnością komercyjnych haptenów lekowych jest stosowanie w testach zamienników w postaci przedstawionych w niniejszym artykule, wykonywanych w aptece preparatów recepturowych.