INFORMACJE O FINANSOWANIU
Urticaria and Angioedema Centers of Reference and Excellence (UCAREs i ACAREs); Global Allergy and Asthma European Network (GA2LEN); European Academy of Allergology and Clinical Immunology (EAACI); Asia Pacific Association of Allergy, Asthma and Clinical Immunology (APAAACI); European Dermatology Forum (EDF)
Skróty: AAS – kwestionariusz oceny aktywności obrzęku naczynioruchowego, ACARE – Angioedema Center of Reference and Excellence, ACE – enzym konwertujący angiotensynę, AECT – test kontroli obrzęku naczynioruchowego, AE-QoL – kwestionariusz oceny jakości życia w obrzęku naczynioruchowym, AGREE – Appraisal of Guidelines Research and Evaluation, AH – lek przeciwhistaminowy, AOSD - choroba Stilla o początku w wieku dorosłym, APAAACI – Asia Pacific Association of Allergy, Asthma and Clinical Immunology, ARIA – alergiczny nieżyt nosa i jego wpływ na astmę, ASST – test z surowicą autologiczną, BAT – test aktywacji bazofilów, BHRA – test uwalniania histaminy z bazofilów, CAPS – okresowe zespoły zależne od kriopiryny, CindU – przewlekła pokrzywka indukowalna, CNS – ośrodkowy układ nerwowy, CSU – przewlekła pokrzywka spontaniczna, CU – pokrzywka przewlekła, CU-Q2oL – kwestionariusz oceny jakości życia w pokrzywce przewlekłej, CYP – cytochrom P, EAACI – European Academy of Allergology and Clinical Immunology, EDF – European Dermatology Forum, EtD – dowód do decyzji, FCAS – rodzinny autozapalny zespół reakcji na zimno, GA2LEN – Global Asthma and Allergy European Network, GDT – narzędzie do opracowywania wytycznych, GRADE – Grading of Recommendations Assessment, Development and Evaluation, HAE – wrodzony obrzęk naczynioruchowy, HIDS – zespół hiper-IgD, IVIG (również IGIV) – immunoglobuliny dożylne, MWS – zespół Muckle’a-Wellsa, NOMID – zespół wielonarządowej reakcji zapalnej o początku w okresie noworodkowym, NLPZ – niesteroidowe leki przeciwzapalne, PAF – czynnik aktywujący płytki krwi, PET – pozytronowa tomografia emisyjna, PICO – technika stosowana w medycynie opartej na dowodach, akronim oznacza „pacjent/problem/populacja, interwencja, porównanie/kontrola/komparator, wynik”, PROM – miara wyników zgłaszanych przez pacjenta, REM – faza szybkich ruchów gałek ocznych, sJIA – młodzieńcze idiopatyczne zapalenie stawów o początku uogólnionym, TRAPS – okresowy zespół związany z receptorem czynnika martwicy nowotworów, UAS – kwestionariusz oceny aktywności pokrzywki, UCARE – Urticaria Center of Reference and Excellence, UCT – test kontroli pokrzywki, UEMS – European Union of Medical Specialists, UV – ultrafiolet, WHO – Światowa Organizacja Zdrowia.
Jest to artykuł o otwartym dostępie zgodnie z warunkami licencji „ http://creativecommons.org/licenses/by-nc/4.0/ ”Creative Commons Attribution-NonCommercial, która zezwala na używanie, dystrybucję i powielanie na dowolnym nośniku, pod warunkiem że oryginalna praca jest prawidłowo cytowana i nie jest wykorzystywana do celów komercyjnych.
© 2021 GA2LEN. Allergy publikowane przez European Academy of Allergy and Clinical Immunology oraz John Wiley & Sons Ltd.
Allergy 2022; 77: 734-766 wileyonlinelibrary.com/journal/al
1. WSTĘP
Niniejsza aktualizacja i wersja międzynarodowych wytycznych dotyczących pokrzywki jest oparta na dowodach oraz konsensusie ekspertów i została opracowana zgodnie z metodami zalecanymi przez Cochrane i grupę roboczą Grading of Recommendations Assessment, Development and Evaluation (GRADE). Do omówienia i uzgodnienia zaleceń wykorzystano ustrukturyzowany proces konsensusu. Konferencja odbyła się w formacie hybrydowym 3 grudnia 2020 r. w Berlinie, Niemcy, i online.
Wytyczne są wspólną inicjatywą Dermatology Section of the European Academy of Allergology and Clinical Immunology (EAACI), Global Allergy and Asthma European Network (GA2LEN) i jej Urticaria and Angioedema Centers of Reference and Excellence (UCAREs i ACAREs), European Dermatology Forum (EDF) oraz Asia Pacific Association of Allergy, Asthma and Clinical Immunology (APAAACI). Wszystkie te organizacje zapewniły fundusze na opracowanie wytycznych, które są aktualizacją i modyfikacją wytycznych EAACI/GA2LEN/EDF/WAO dotyczących pokrzywki opublikowanych w 2018 r. [1–4]. Nie uzyskano finansowania z innych źródeł.
Niniejsza aktualizacja i modyfikacja wytycznych została opracowana przez panel 64 ekspertów zajmujących się pokrzywką z 31 krajów, nominowanych na delegatów przez 50 uczestniczących krajowych i/lub międzynarodowych towarzystw medycznych lub naukowych (tab. 1). Wszystkie zaangażowane towarzystwa akceptują wytyczne. Prace panelu ekspertów były wspierane przez zespół metodologów EuroGuiDerm kierowany przez prof. Alexandra Nasta (tab. 2) i obejmowały wkład uczestników konferencji konsensusowej.
TABELA 1
Członkowie panelu ekspertów
TABLE 2
Członkowie grupy metodologicznej w przypadku wytycznych EuroGuiDerm
Celem wytycznych jest przedstawienie definicji i klasyfikacji pokrzywki, co ułatwi interpretację danych z różnych ośrodków i obszarów świata dotyczących przyczyn tego problemu, czynników wywołujących, chorób współistniejących, obciążenia pacjentów i społeczeństwa oraz odpowiedzi na leczenie podtypów pokrzywki. Ponadto wytyczne zawierają zalecenia dotyczące metod diagnostyki i leczenia w często występujących podtypach pokrzywki. Są to wytyczne międzynarodowe, które uwzględniają globalną różnorodność pacjentów, lekarzy, systemów ochrony zdrowia oraz dostępu do diagnostyki i leczenia.
2. METODY
Szczegółowe metody wykorzystane do opracowania niniejszych wytycznych zostały opublikowane jako odrębny raport na temat metod, który jest dostępny na stronie internetowej EDF wraz z oddzielnym raportem dowodowym zawierającym wszystkie ramy od dowodów do decyzji (https://www.edf.one/de/home/Guidelines/EDF-EuroGuiDerm.html).
Wytyczne uwzględniają narzędzie Appraisal of Guidelines Research and Evaluation (AGREE II) Instrument [5] oraz metody sugerowane przez grupę roboczą GRADE. Przegląd piśmiennictwa przeprowadzono z wykorzystaniem metod podanych w Cochrane Handbook for Systematic Reviews of Interventions [6].
Podsumowując, eksperci z 50 towarzystw byli nominowani do udziału w opracowywaniu niniejszej aktualizacji i modyfikacji wytycznych. Wszyscy członkowie panelu ekspertów otrzymali zaproszenie do złożenia deklaracji konfliktu interesów (COI) online oraz do samodzielnego zadeklarowania swoich osobistych interesów finansowych (P-F), nieosobistych interesów finansowych (NP-F) i osobistych interesów niefinansowych (P-NF). Przegląd deklaracji dotyczących konfliktu interesów P-F znajduje się w raporcie dotyczącym metod. Ogółem 40 członków panelu ekspertów (62,5%) zadeklarowało brak P-F COI.
W aktualizacji wytycznych z 2021 r. zastosowano te same kluczowe pytania, które opracowano dla wersji wytycznych opublikowanej w 2018 r. Szczegółowe informacje dotyczące procesów zastosowanych do opracowania tych pytań są dostępne w raporcie dotyczącym metod [7]. Kluczowe pytania zostały przekonwertowane do formatu PICO, który określa interwencję, porównanie i wynik zastosowany do oceny skuteczności i bezpieczeństwa. Systematyczne wyszukiwanie randomizowanych badań kontrolowanych i kontrolowanych badań klinicznych przeprowadzono w trzech bazach danych 15 maja 2020 r.
W wyniku wyszukiwania zidentyfikowano łącznie 2053 rekordy. Dwóch niezależnych recenzentów oceniło piśmiennictwo i wyekstrahowało dane kwalifikujące się do badania. Usunięcie duplikatów i przegląd tytułów lub streszczeń doprowadziły do pozostawienia 144 rekordów do oceny jako pełnych tekstów pod kątem kwalifikacji, z których 123 zostały wykluczone.
Łącznie zatwierdzono 21 rekordów jako spełniających kryteria włączenia. Graficzny podział tego procesu oraz wykaz wykluczonych publikacji pełnotekstowych wraz z przyczynami wykluczenia można znaleźć w oddzielnym raporcie dotyczącym metod.
Jeśli było to możliwe, obliczyliśmy miary efektu z przedziałami ufności i wykonaliśmy metaanalizy za pomocą oprogramowania Review Manager [8]. Oceniliśmy jakość danych naukowych zgodnie z podejściem GRADE przy użyciu narzędzia GRADEpro Guideline Development Tool (GDT) [9, 10]. Pięć kryteriów (ryzyko błędu systematycznego, brak spójności, brak bezpośredniości, brak precyzji i błąd systematyczny publikacji) zostało ocenionych dla każdego wyniku, co dało ogólną ocenę jakości dowodów (tab. 3). Miary efektu, takie jak współczynniki ryzyka, wyrażają rozmiar efektu, a ocena jakości wyraża, jak duże zaufanie można mieć do wyniku.
TABLE 3
Podsumowanie podejścia GRADE do oceny jakości dowodów według wyników w randomizowanych badaniach kontrolowanych [159]
Następnie stworzono ramy od dowodu do decyzji, aby pomóc panelowi ekspertów w dokonywaniu ocen dla konkretnych porównań dotyczących wielkości pożądanych i niepożądanych efektów, jak również równowagi między nimi, oraz aby zapewnić przegląd jakości dowodów. W ocenie dowodów uzyskano 14 nowych lub zaktualizowanych profili dowodów GRADE oraz 14 nowych lub zaktualizowanych ram od dowodów do decyzji. Podsumowanie dowodów znajduje się w osobnym raporcie dotyczącym dowodów. Następnie opracowano zalecenia dla każdego z kluczowych pytań opartych na dowodach, stosując ustandaryzowany tekst (tab. 4).
TABELA 4
Ustandaryzowane sformułowania i symbole zaleceń w wytycznych
Przed konferencją konsensusową odbyły się dwie rundy głosowania wstępnego za pośrednictwem ankiety internetowej, aby zapoznać panel ekspertów ze wszystkimi wersjami roboczymi zaleceń i ramami od dowodów do decyzji, zebrać opinie na ich temat, a następnie wykorzystać te informacje do modyfikacji zalecenia lub sporządzić ich alternatywną wersję roboczą, która zostanie przedstawiona i poddana pod głosowanie podczas konferencji konsensusowej. Wszyscy członkowie zespołu ekspertów kwalifikowali się do wstępnego głosowania (niezależnie od tego, czy mieli konflikt interesów P-F). Spośród 61 członków zespołu ekspertów pierwszą ankietę wypełniło 50 (wskaźnik odpowiedzi 81,9%), którzy skupili się na części wytycznych dotyczącej rozpoznawania i klasyfikacji, a drugą ankietę wypełniło 60 (wskaźnik odpowiedzi 98,4%), którzy koncentrowali się na części wytycznych dotyczącej leczenia. Wyniki zostały przekazane z powrotem do panelu ekspertów. Wszystkie ramy od decyzji do dowodów i robocze wersje zaleceń zostały wcześniej udostępnione uczestnikom konferencji konsensusowej.
Konferencja konsensusowa odbyła się 3 grudnia 2020 r. w formacie hybrydowym. Uczestnikami byli członkowie panelu eksperckiego oraz szersza grupa do 100 profesjonalistów, w skład której wchodzili lekarze regularnie zajmujący się leczeniem pacjentów z pokrzywką, badacze nauk podstawowych lub klinicznych w tej dziedzinie oraz przedstawiciele organizacji pacjentów i grup wsparcia. Głosowanie odbywało się online za pomocą platformy ankietowej Slido©. Aby móc głosować, uczestnicy musieli złożyć oświadczenie o konflikcie interesów. Wszyscy, oprócz osób zatrudnionych w firmie farmaceutycznej, mieli prawo do głosowania i otrzymali kod dostępu do ankiet na żywo. Podczas konferencji zastosowano technikę grup nominalnych w celu omówienia, modyfikacji i osiągnięcia porozumienia w sprawie różnych zaleceń [11]. Każda wersja robocza zalecenia została przedstawiona wraz z odpowiednimi dowodami lub uzasadnieniem; po tym następowały otwarta dyskusja, wstępne głosowanie lub zebranie propozycji alternatywnych sformułowań, a następnie głosowanie końcowe. Mocny konsensus zdefiniowano jako co najmniej 90% zgodności, a konsensus – na poziomie 70–89% zgodności. Wszystkie zalecenia zostały przegłosowane przez co najmniej 89 uczestników i przyjęte z co najmniej 75% zgodności.
Po konferencji tekst poprzedniej wersji wytycznych opublikowanych w 2018 r. został poprawiony przez koordynatorów wytycznych i zespół metodologów zgodnie z wynikami głosowania oraz punktami omawianymi podczas konferencji i rund głosowania online przed konferencją. Wersja robocza została następnie zweryfikowana wewnętrznie przez panel ekspertów i zewnętrznie przez uczestniczące stowarzyszenia krajowe i międzynarodowe.
W samych wytycznych przedstawiono moc konsensusu dla każdego zalecenia, jak pokazano w tabeli 5.
TABELA 5
Definicje siły konsensusu
| Silny konsensus | Zgodność ≥ 90% uczestników |
| Konsensus | Zgodność 70–89% uczestników |
| Zgodność większości | Zgodność 51–69% uczestników |
Każde zalecenie w wytycznych jest sformatowane, jak pokazano w Polach 1–3. W górnej części każdego pola znajduje się pytanie będące przedmiotem zainteresowania (np. „Czy powinniśmy… w przewlekłej pokrzywce?”). W wierszu poniżej pytania będącego przedmiotem zainteresowania zalecenia zostały przedstawione w całości, z zastosowaniem ustandaryzowanego sformułowania i symboli zestawionych w tabeli 4. Na przykład w Polu 1 widać, że wydawane jest silne zalecenie (tj. „Polecamy…” i „↑↑” w kolorze ciemnozielonym). Ponadto można zauważyć, na podstawie informacji podanych po prawej stronie tego samego wiersza, że kwalifikujący się uczestnicy konferencji konsensusowej zgodzili się z tym zaleceniem i jego sformułowaniem z silnym konsensusem (zgodność ≥ 90%) oraz że zalecenie opiera się na konsensusie ekspertów. Jeśli zalecenie opiera się dodatkowo na dowodach z systematycznego przeglądu literatury, użyte tutaj wyrażenie będzie brzmieć „Oparte na dowodach i konsensusie (patrz raport dotyczący dowodów)” zamiast „Konsensus ekspertów”.
Jeżeli istnieje wiele zaleceń, które dotyczą tego samego pytania będącego przedmiotem zainteresowania, a każde z tych zaleceń zostało poddane osobnemu głosowaniu, można je pogrupować razem, jak pokazano w Polu 2. W takim przypadku siła konsensusu i podstawa dowodowa są określone dla każdego zalecenia oddzielnie.
W Polu 3 widać również dwa zalecenia zamiast jednego, jednak w tym przypadku, ponieważ były one głosowane wspólnie na konferencji konsensusowej, informacje o sile konsensusu i bazie dowodowej są pokazywane tylko raz i dotyczą obu zaleceń.
3. DEFINICJA
3.1. DEFINICJA
Pokrzywka jest chorobą charakteryzującą się powstawaniem bąbli pokrzywkowych, obrzęku naczynioruchowego lub obu tych objawów. Pokrzywkę należy odróżnić od innych schorzeń, w których występują bąble, obrzęk naczynioruchowy lub oba te objawy jako cechy szeregu stanów klinicznych, na przykład anafilaksji, zespołów autozapalnych, pokrzywkowego zapalenia naczyń lub zależnego od bradykininy obrzęku naczynioruchowego, w tym dziedzicznego obrzęku naczynioruchowego (hereditary angioedema – HAE).
| Definicja Pokrzywka jest chorobą charakteryzującą się powstawaniem bąbli pokrzywkowych, obrzęku naczynioruchowego lub obu tych objawów. |
Pole 1
Format indywidualnych zaleceń w wytycznych, w tym siła konsensusu i baza dowodowa
| Czy w przypadku przewlekłej pokrzywki należy...? | |||
| Zalecamy, aby... | ↑↑ | Silny konsensus1 Konsensus ekspertów | |
| 1≥ 90% zgodności | |||
Pole 2
Format wielu zaleceń w wytycznych, nad którymi głosowano oddzielnie, w tym siła konsensusu i baza dowodowa dla każdego z nich
| Czy w przypadku przewlekłej pokrzywki należy...? | |||
| Zalecamy, aby... | ↑↑ | Silny konsensus1 Konsensus ekspertów | |
| 1≥ 90% zgodności | |||
| Sugerujemy, aby... | ↑ | Silny konsensus1 Konsensus ekspertów | |
| 1≥ 90% zgodności | |||
Pole 3
Format wielu zaleceń w wytycznych, nad którymi głosowano wspólnie, w tym siła konsensusu i baza dowodowa
| Czy w przypadku przewlekłej pokrzywki należy...? | |||
| Zalecamy, aby... Zalecamy stosowanie... | ↑↑ | Silny konsensus1 Konsensus ekspertów | |
| 1≥ 90% zgodności | |||
A. Bąbel ma trzy typowe cechy:
ostro ograniczony powierzchowny obrzęk centralny o zmiennej wielkości i kształcie, prawie zawsze otoczony odruchowym rumieniem,
uczucie świądu, a czasem pieczenia,
przelotny charakter, z powrotem skóry do normalnego wyglądu zwykle w ciągu 30 min do 24 godz.
B. Obrzęk naczynioruchowy charakteryzuje się:
3.2. KLASYFIKACJA POKRZYWKI NA PODSTAWIE CZASU JEJ TRWANIA I ZNACZENIA CZYNNIKÓW WYWOŁUJĄCYCH
Spektrum objawów klinicznych różnych typów i podtypów pokrzywki jest bardzo szerokie. Ponadto u każdego pacjenta mogą współistnieć dwa podtypy lub więcej podtypów pokrzywki.
Pokrzywkę klasyfikuje się na podstawie czasu jej trwania jako ostrą lub przewlekłą, a także roli określonych czynników wyzwalających jako indukowalną lub spontaniczną. Ostra pokrzywka jest definiowana jako występowanie bąbli pokrzywkowych, obrzęku naczynioruchowego lub obu tych objawów przez 6 tygodni lub krócej. Przewlekłą pokrzywkę definiuje się jako występowanie bąbli pokrzywkowych, obrzęku naczynioruchowego lub obu tych objawów przez okres dłuższy niż 6 tygodni. Przewlekła pokrzywka może się przejawiać codziennymi lub prawie codziennymi objawami przedmiotowymi i podmiotowymi bądź okresowym lub nawrotowym przebiegiem choroby. CSU może nawrócić po miesiącach lub latach pełnej remisji.
Pokrzywka indukowalna charakteryzuje się określonymi i specyficznymi dla podtypu czynnikami wywołującymi bąble, obrzęk naczynioruchowy lub oba te objawy. Te czynniki wyzwalające są określone, ponieważ bąble, obrzęk naczynioruchowy lub oba te objawy występują zawsze, gdy jest obecny czynnik wyzwalający, i nie występują nigdy, kiedy takiego czynnika nie ma. Czynniki te są specyficzne, ponieważ każdy podtyp pokrzywki indukowalnej ma swój odpowiedni czynnik wyzwalający, np. niska temperatura w przypadku pokrzywki z zimna, i ten czynnik nie jest istotny w innych postaciach pokrzywki indukowalnej. Istnieją rzadkie podtypy pokrzywki indukowalnej, w których do wywołania bąbli, obrzęku naczynioruchowego lub obu tych objawów wymagana jest jednoczesna obecność dwóch lub więcej określonych i specyficznych czynników wyzwalających, np. pokrzywka cholinergiczna indukowana zimnem [12].
U niektórych pacjentów z pokrzywką spontaniczną występują bąble, obrzęk naczynioruchowy lub oba te objawy wywołane przez czynnik wyzwalający. Te czynniki wyzwalające nie są określone, ponieważ ich obecność nie zawsze wywołuje objawy przedmiotowe i podmiotowe, a bąble, obrzęk naczynioruchowy lub oba te objawy występują również bez nich, czyli spontanicznie. U niektórych pacjentów może występować więcej niż jeden podtyp pokrzywki, przy czym podtypy te mogą również niezależnie reagować na leczenie.
W tabeli 6 przedstawiono klasyfikację podtypów pokrzywki przewlekłej (CU) do stosowania klinicznego. Ta klasyfikacja została utrzymana w stosunku do poprzedniej wersji wytycznych na podstawie silnego konsensusu (≥ 90%).
TABELA 6
Zalecana klasyfikacja przewlekłej pokrzywki
Uwaga: przewlekła pokrzywka (chronic urticaria – CU) jest klasyfikowana jako spontaniczna (CSU) i indukowalna (CIndU). CSU występuje jako CSU o znanej przyczynie i CSU o nieznanej przyczynie. CIndU jest dalej klasyfikowana jako objawowy dermografizm, pokrzywka z zimna, pokrzywka opóźniona z ucisku, pokrzywka słoneczna, pokrzywka cieplna i obrzęk naczynioruchowy wibracyjny (łącznie określane jako przewlekła pokrzywka fizykalna), a także pokrzywka cholinergiczna, pokrzywka kontaktowa i pokrzywka wodna. Pacjenci z CU mogą mieć więcej niż jedną formę CU, w tym więcej niż jedną formę CIndU, i często tak się zdarza.
Tabela jest oparta na konsensusie ekspertów - osiągnięto ≥ 90-procentową zgodność na konferencji konsensusowej.
Pokrzywkowe zapalenie naczyń, skórna mastocytoza plamisto-grudkowa (dawniej nazywana pokrzywką barwnikową) oraz indolentna mastocytoza układowa z zajęciem skóry, zespół aktywacji komórek tucznych (MCAS), zespoły autozapalne (np. zespoły okresowe związane z kriopiryną lub zespół Schnitzler), obrzęk naczynioruchowy mediowany przez mediatory inne niż komórki tuczne (np. obrzęk naczynioruchowy mediowany bradykininą) oraz inne choroby i zespoły, które mogą objawiać się bąblami i/lub obrzękiem naczynioruchowym, nie są uznawane za rodzaje pokrzywki ze względu na ich wyraźnie odmienne mechanizmy patofizjologiczne i/lub obraz kliniczny (tab. 7).
TABELA 7
Diagnostyka różnicowa pokrzywki
3.3. ASPEKTY PATOFIZJOLOGICZNE
Pokrzywka jest chorobą wywoływaną głównie przez komórki tuczne [13]. Histamina i inne mediatory, takie jak czynnik aktywujący płytki (PAF) i cytokiny uwalniane z aktywowanych komórek tucznych skóry, powodują aktywację nerwów czuciowych, rozszerzenie naczyń i przesiękanie osocza, a także rekrutację komórek do zmian pokrzywkowych. Sygnały aktywujące komórki tuczne w pokrzywce są niejednorodne, zróżnicowane i obejmują cytokiny warunkowane przez limfocyty T oraz autoprzeciwciała. W badaniu histologicznym bąble charakteryzują się obrzękiem górnej i środkowej warstwy skóry właściwej, z poszerzeniem i zwiększeniem przepuszczalności żyłek postkapilarnych oraz naczyń limfatycznych skóry właściwej. W obrzęku naczynioruchowym podobne zmiany występują głównie w dolnej warstwie skóry właściwej i w warstwie podskórnej. Skóra w obrębie bąbli wykazuje mieszany naciek zapalny okołonaczyniowy o różnym nasileniu, składający się z limfocytów T, eozynofilów, bazofilów i innych komórek. Martwica ścian naczyń, cecha charakterystyczna pokrzywkowego zapalenia naczyń, nie występuje w pokrzywce [14–18]. Niepokryta zmianami skóra pacjentów z przewlekłą pokrzywką spontaniczną (CSU) wykazuje zwiększoną ekspresję cząsteczek adhezyjnych, naciekające eozynofile, zmienioną ekspresję cytokin [19], a czasami umiarkowany wzrost liczby komórek tucznych [13]. Wyniki te podkreślają złożony charakter patogenezy pokrzywki, na którą, oprócz uwalniania histaminy z komórek tucznych skóry, składa się wiele aspektów [20–22]. Niektóre z tych aspektów pokrzywki są również obserwowane w szerokim zakresie stanów zapalnych, a zatem nie są swoiste ani nie mają wartości diagnostycznej. Pożądane jest poszukiwanie bardziej swoistych biomarkerów histologicznych dla różnych podtypów pokrzywki i odróżnienia pokrzywki od innych schorzeń [23].
3.4. OBCIĄŻENIE CHOROBĄ
Obciążenie związane z CU dla pacjentów, ich rodzin i znajomych, systemu ochrony zdrowia oraz społeczeństwa jest znaczne [24]. Stosowanie narzędzi oceny objawów zgłaszanych przez pacjenta, takich jak kwestionariusz aktywności pokrzywki (UAS), kwestionariusz aktywności obrzęku naczynioruchowego (AAS), kwestionariusz oceny jakości życia w przebiegu CU (CU-Q2oL), kwestionariusz oceny jakości życia w przebiegu obrzęku naczynioruchowego (AE-QoL), test kontroli pokrzywki (UCT) oraz test kontroli obrzęku naczynioruchowego (AECT), w badaniach i praktyce klinicznej pomogło lepiej zdefiniować efekty i wpływ CU na pacjentów [25]. Dostępne dane wskazują, że pokrzywka znacząco wpływa zarówno na funkcjonowanie obiektywne, jak i subiektywne samopoczucie [26–28]. Wcześniej O’Donnell i wsp. wykazali, że wyniki oceny stanu zdrowia pacjentów z CSU są porównywalne z wynikami zgłaszanymi przez pacjentów z chorobą wieńcową [29]. Ponadto zarówno stan zdrowia, jak i subiektywne zadowolenie u pacjentów z CSU są niższe niż u osób zdrowych i pacjentów z alergią wziewną [30]. CU wiąże się również ze znacznymi kosztami dla pacjentów i społeczeństwa [31–33].
4. DIAGNOSTYKA POKRZYWKI
Szczegółowy wywiad ma kluczowe znaczenie w pokrzywce; jest to pierwszy krok w diagnostyce wszystkich pacjentów z pokrzywką. Drugim krokiem jest badanie fizykalne pacjenta. Ponieważ bąble i obrzęk naczynioruchowy są przemijające i mogą nie występować w czasie badania fizykalnego, ważne jest zapoznanie się z dokumentacją dotyczącą objawów przedmiotowych i podmiotowych (w tym zdjęciami bąbli i/lub obrzęku naczynioruchowego). Trzeci etap w przewlekłej pokrzywce to podstawowa diagnostyka z ograniczonym zakresem badań (patrz tab. 8; zalecane rutynowe badania diagnostyczne). Dalsze, dobrane indywidualnie badania diagnostyczne mogą być przydatne na podstawie wyników z pierwszych trzech etapów i w zależności od typu oraz podtypu pokrzywki (tab. 8; rozszerzony program diagnostyczny). Cele wszystkich wykonywanych badań diagnostycznych powinny być jasne dla lekarza i pacjenta.
TABELA 8
Zalecane badania diagnostyczne w częstych podtypach pokrzywki
4.1. DIAGNOSTYKA OSTREJ POKRZYWKI
Ostra pokrzywka, ponieważ ma charakter samoograniczający się, zwykle nie wymaga badań diagnostycznych poza wywiadem pod kątem możliwych czynników wyzwalających. Jedynym wyjątkiem jest podejrzenie pokrzywki ostrej z powodu alergii pokarmowej w mechanizmie typu I u pacjentów uczulonych lub nadwrażliwości na lek, szczególnie w przypadku niesteroidowych leków przeciwzapalnych (NLPZ). W takiej sytuacji pomocne mogą być testy alergiczne i edukacja pacjentów, aby umożliwić im uniknięcie ponownego narażenia na istotne czynniki sprawcze.
4.2. BADANIA DIAGNOSTYCZNE W CSU
W CSU badania diagnostyczne mają siedem głównych celów. Mają one potwierdzić rozpoznanie i wykluczyć rozpoznania różnicowe; szukać zasadniczych przyczyn; zidentyfikować odpowiednie uwarunkowania, które modyfikują aktywność choroby; sprawdzić choroby współistniejące; określić konsekwencje CSU; ocenić predyktory przebiegu choroby i odpowiedzi na leczenie oraz monitorować aktywność choroby, wpływ i kontrolę (tab. 9) [34].
TABELA 9
Cele postępowania diagnostycznego u pacjentów z CSU [34]
U wszystkich pacjentów z CSU badania diagnostyczne obejmują dokładny wywiad, badanie fizykalne (w tym przegląd zdjęć bąbli i/lub obrzęku naczynioruchowego), podstawowe badania oraz ocenę aktywności choroby, wpływu i kontroli. Podstawowymi badaniami są morfologia krwi z rozmazem i CRP i/lub OB u wszystkich pacjentów oraz stężenie IgE całkowitej oraz IgG anty- -TPO u pacjentów w opiece specjalistycznej. Na podstawie uzyskanych wyników tych badań można przeprowadzić dalsze badania diagnostyczne w zależności od wskazań.
4.2.1. Potwierdzenie CSU i wykluczenie rozpoznania różnicowego
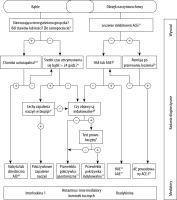
Bąble lub obrzęk naczynioruchowy występują również u pacjentów z chorobami innymi niż CSU (ryc. 1). U pacjentów, u których rozwijają się wyłącznie bąble (ale nie obrzęk naczynioruchowy), należy wykluczyć pokrzywkowe zapalenie naczyń i choroby autozapalne, takie jak zespół Schnitzler lub zespoły okresowe związane z kriopiryną (CAPS). Jednak u pacjentów, którzy cierpią wyłącznie z powodu nawracającego obrzęku naczynioruchowego (ale nie bąbli), obrzęk naczynioruchowy mediowany przez bradykininę spowodowany inhibitorami enzymu konwertującego angiotensynę (ACE-I) oraz HAE należy rozważyć w rozpoznaniu różnicowym (ryc. 1). Ocena pacjentów pod kątem rozpoznań różnicowych CSU prowadzona jest zgodnie z wywiadem (ryc. 1) i opiera się na podstawowych badaniach, np. CRP i/lub OB, morfologii krwi z rozmazem. Dalsze badania należy przeprowadzać wyłącznie zgodnie z wynikami wywiadu, badania fizykalnego i podstawowych testów.
RYCINA 1
Algorytm diagnostyczny dla pacjentów z bąblami i/lub obrzękiem naczynioruchowym nawracającymi dłużej niż 6 tygodni. AAE –nabyty obrzęk naczynioruchowy z powodu niedoboru inhibitora C1, ACE-I – inhibitor konwertazy angiotensyny, AE – obrzęk naczynioruchowy, AID – choroba autozapalna, HAE – wrodzony obrzęk naczynioruchowy.
1Opisano, że oprócz inhibitorów ACE, blokery receptora angiotensyny II typu 1 (sartany), inhibitory dipeptydylopeptydazy IV (gliptyny) i inhibitory neprylizyny wywołują obrzęk naczynioruchowy, ale znacznie rzadziej.
2Pacjentów należy zapytać o szczegółowy wywiad rodzinny i wiek w momencie zachorowania.
3Badanie w kierunku podwyższonych markerów stanu zapalnego (białko C-reaktywne, OB), badanie w kierunku paraproteinemii u osób dorosłych, poszukiwanie cech nacieków bogatych w neutrofile w biopsji skóry; w przypadku istotnego podejrzenia należy przeprowadzić analizę mutacji genowych pod kątem wrodzonych zespołów okresowej gorączki (np. zespołu okresowego związanego z kriopiryną).
4Należy pytać pacjentów: „Jak długo utrzymuje się każdy z bąbli?”
5Test w kierunku oceny stężenia składowej dopełniacza C4, stężenia i aktywności C1-INH; dodatkowo test w kierunku C1q i przeciwciał dla C1-INH, jeśli podejrzewa się AAE; wykonanie analizy mutacji genów, jeżeli poprzednie testy nie są nieprawidłowe, ale historia pacjenta sugeruje dziedziczny obrzęk naczynioruchowy.
6Remisja powinna nastąpić w ciągu kilku dni, w rzadkich przypadkach do 6 miesięcy po odstawieniu inhibitora ACE.
7Czy biopsja zmienionej skóry wykazuje uszkodzenie drobnych naczyń w brodawkowatej i siateczkowatej warstwie skóry właściwej i/lub złogi włóknikowate w lokalizacjach okołonaczyniowych i śródmiąższowych sugerujące pokrzywkowe zapalenie naczyń?
8Należy zapytać pacjentów: „Czy może Pani (Pan) wywołać bąble? Czy może Pani (Pan) spowodować pojawienie się bąbli?”
9U pacjentów z wywiadem sugerującym pokrzywkę indukowalną należy przeprowadzić standaryzowane testy prowokacyjne zgodnie z międzynarodowymi zaleceniami konsensusowymi [45].
10Do nabytych zespołów autozapalnych należą: zespół Schnitzler, a także młodzieńcze idiopatyczne zapalenie stawów o początku uogólnionym (sJIA) i choroba Stilla o początku w wieku dorosłym (AOSD); wrodzone zespoły autozapalne obejmują okresowe zespoły związane z kriopiryną (CAPS), takie jak rodzinny autozapalny zespół reakcji na zimno (FCAS), zespół Muckle’a-Wellsa (MWS) i zespół wielonarządowej reakcji zapalnej o początku w okresie noworodkowym (NOMID), rzadziej zespół hiper-IgD (HIDS) oraz okresowy zespół związany z receptorem czynnika martwicy nowotworów a (TRAPS).
11W niektórych rzadkich przypadkach nawracający obrzęk naczynioruchowy nie jest związany z mediatorami komórek tucznych ani bradykininą, a leżący u jego podstaw patomechanizm jest nieznany. Przypadki te są określane przez niektórych autorów jako „idiopatyczny obrzęk naczynioruchowy”.
12Znanych jest kilka podtypów HAE: HAE-1 – wrodzony obrzęk naczynioruchowy spowodowany niedoborem inhibitora C1, HAE-2 – wrodzony obrzęk naczynioruchowy spowodowany dysfunkcją inhibitora C1, HAE nC1-INH – wrodzony obrzęk naczynioruchowy z prawidłowymi poziomami inhibitora C1, spowodowany mutacją w FXII (czynnik 12), ANGPT1 (angiopoetyna-1), PLG (plazminogen), KNG1 (kininogen), MYOF (mioferlina) i HS3ST6 (siarczan heparanu-glukozamina 3-osulfotransferaza 6) lub nieznany.
4.2.2. Identyfikacja przyczyn
Chociaż patogeneza CSU nie jest jeszcze w pełni poznana, dobrze wiadomo, że przedmiotowe i podmiotowe objawy są spowodowane aktywacją komórek tucznych skóry, a następnie uwalnianiem i działaniem ich mediatorów [13]. Na podstawie niedawno uzyskanych dowodów wiadomo, że przyczyny CSU obejmują autoimmunizację typu I (CSUaiTI lub „autoalergiczną CSU”; z autoprzeciwciałami IgE przeciwko autoantygenom) i autoimmunizację typu IIb (CSUaiTIIb; z autoprzeciwciałami aktywującymi ukierunkowanymi na komórki tuczne). W CSU z powodu nieznanej przyczyny (CSUuc) jak dotąd nieznane mechanizmy są istotne dla degranulacji komórek tucznych skóry. Wywiad i badanie fizykalne mogą dostarczyć wskazówek dotyczących przyczyn. Wyniki podstawowych badań przeprowadzonych w przypadku CSU mogą wskazywać na CSUaiTI w porównaniu z CSUaiTIIb, z częstszym wzrostem CRP, a także częstszym obniżeniem poziomów eozynofilów i bazofilów w CSUaiTIIb. Badania w kierunku przeciwciał IgG anty-TPO oraz IgE całkowitej, podstawowe testy, które należy wykonać u pacjentów z CSU w opiece specjalistycznej, mogą pomóc w uzyskaniu większej jasności. Pacjenci z CSUaiTIIb częściej mają niskie lub bardzo niskie całkowite stężenie IgE oraz podwyższone stężenie IgG anty-TPO, a wysoki stosunek IgG anty- -TPO do IgE całkowitej jest obecnie najlepszym markerem zastępczym w przypadku CSUaiTIIb. Bardziej zaawansowane testy, takie jak test aktywacji bazofilów w kierunku CSUaiTIIb, mogą zapewniać większą jasność i powinny być prowadzone zgodnie z wywiadem, badaniem fizykalnym i podstawowymi badaniami. Innymi podstawowymi przyczynami są: aktywna choroba tarczycy, zakażenia, procesy zapalne, pokarmy i leki, ale te ostatnie mogą być zarówno przyczyną, jak i tylko czynnikiem zaostrzającym i są uwzględnione poniżej. Odradza się prowadzenie intensywnych i kosztownych ogólnych programów badań przesiewowych w kierunku przyczyn pokrzywki.
Co ważne, mogą występować znaczne różnice w częstości występowania przyczyn choroby w różnych częściach świata, a różnice regionalne nie zostały dobrze zbadane i poznane.
4.2.3. Identyfikacja istotnych uwarunkowań, które modyfikują aktywność choroby
Identyfikacja istotnych uwarunkowań, które modyfikują aktywność choroby, i czynników, które nasilają CSU, takich jak leki, pokarmy, stres i zakażenia, może pomóc lekarzom i pacjentom zrozumieć, a czasem zmienić przebieg CSU.
Leki mogą powodować zaostrzenia CSU. NLPZ są najczęstszą przyczyną takiego działania nawet u jednego na czterech pacjentów, z wyjątkiem paracetamolu i/lub inhibitorów COX-2 jako bezpieczniejszych opcji u pacjentów z CSU. Dlatego lekarze powinni pytać pacjentów o przyjmowanie NLPZ, w tym doraźne, i zwracać im uwagę, że unikanie niektórych NLPZ może zapobiec zaostrzeniu. Testy prowokacyjne zazwyczaj nie są przydatne.
Pokarm może wywołać zaostrzenie CSU i lekarze powinni o to zapytać pacjentów. Na podstawie ich odpowiedzi diety ubogie w pseudoalergeny i histaminę mogą być traktowane jako dodatkowy, indywidualny parametr diagnostyczny. Diety diagnostyczne należy utrzymywać tylko przez ograniczony czas, aby uniknąć działań niepożądanych i zagrożeń dla bezpieczeństwa; zazwyczaj zaleca się 3–4 tygodnie. Co ważne, diety diagnostyczne nie powinny opóźniać skutecznego leczenia [35].
Stres może zaostrzyć CSU, a nawet 1/3 pacjentów z CSU uważa, że stres jest czynnikiem nasilającym chorobę. Lekarze powinni zapytać pacjentów o wpływ stresu na chorobę i uświadomić im, że redukcja stresu może być pomocna.
4.2.4. Identyfikacja chorób współistniejących i następstw CSU
W przypadku CSU najczęstsze choroby współistniejące to CIndU, choroby autoimmunologiczne i alergie.
Częstymi następstwami są zaburzenia psychiczne, takie jak depresja i lęk, zaburzenia czynności seksualnych i zaburzenia snu.
Wyniki wywiadu lekarskiego, badania fizykalnego lub podstawowych badań, które wskazują na chorobę współistniejącą lub następstwo CSU, powinny prowadzić do dalszych badań, np. badań przesiewowych w kierunku określonych chorób za pomocą kwestionariuszy, testów prowokacyjnych, dalszych badań laboratoryjnych lub skierowania do specjalisty.
4.2.5. Identyfikacja czynników predykcyjnych przebiegu choroby i odpowiedzi na leczenie
W przypadku CSU czas trwania choroby, jej aktywność oraz odpowiedź na leczenie są powiązane z charakterystyką kliniczną i markerami laboratoryjnymi. Chociaż żaden z tych czynników nie stanowi jednoznacznego czynnika prognostycznego, mogą one pomóc lekarzom w doradzaniu pacjentom w zakresie nasilenia i przewidywanego czasu trwania choroby oraz oczekiwań związanych z leczeniem. Współistniejące CIndU, znaczna aktywność choroby, podwyższone CRP i/lub obecność obrzęku naczynioruchowego wskazują na przykład na długi czas trwania CSU i słabą odpowiedź na leczenie przeciwhistaminowe [24, 36, 37].
4.2.6. Ocena aktywności, wpływu i kontroli choroby
Pacjentów należy oceniać pod kątem aktywności, wpływu i kontroli choroby podczas pierwszej i każdej kolejnej wizyty. W tym celu powinny być stosowane zwalidowane narzędzia oceny objawów zgłaszanych przez pacjenta (PROMs), takie jak wskaźnik aktywności pokrzywki (UAS i tygodniowy wskaźnik aktywności pokrzywki, czyli UAS7, obliczony na jego podstawie), wskaźnik aktywności obrzęku naczynioruchowego (AAS), kwestionariusz jakości życia w przewlekłej pokrzywce (CU-Q2oL), kwestionariusz jakości życia w przebiegu obrzęku naczynioruchowego (AE-QoL), test kontroli pokrzywki (UCT) oraz test kontroli obrzęku naczynioruchowego (AECT) [38, 39]. PROMs są dostępne w wielu językach.
U pacjentów z CSU, u których występują bąble, aktywność choroby powinna być oceniana zarówno w opiece lekarskiej, jak i badaniach klinicznych za pomocą UAS7 (tab. 10), ujednoliconego i prostego systemu oceny, który został zaproponowany w ostatniej wersji wytycznych i zwalidowany [40, 41]. UAS7 opiera się na ocenie głównych objawów przedmiotowych i podmiotowych pokrzywki (bąble i świąd), które zostały udokumentowane przez pacjenta, co czyni ten wynik szczególnie cennym. Zastosowanie UAS7 ułatwia porównanie wyników badania z różnych ośrodków. Ponieważ aktywność pokrzywki często się zmienia, ogólną aktywność choroby najlepiej mierzyć, doradzając pacjentom, aby dokumentowali całodobowe wyniki samooceny raz dziennie przez kilka dni. UAS7, czyli łączny wynik z 7 kolejnych dni, powinien być stosowany w rutynowej praktyce klinicznej w celu okreś-lenia aktywności choroby i odpowiedzi na leczenie u pacjentów z CSU. U pacjentów z CSU, u których wystąpił obrzęk naczynioruchowy z bąblami lub bez, do oceny aktywności choroby należy stosować skalę AAS (tab. 10) [42]. U pacjentów z CSU, u których stwierdza się bąble i obrzęk naczynioruchowy, powinno się stosować łącznie UAS7 i AAS.
TABELA 10
Wskaźnik aktywności pokrzywki (UAS) oraz wskaźnik aktywności obrzęku naczynioruchowego (AAS) stosowane w ocenie aktywności choroby w przypadku CSU
[i] Uwaga: w przypadku UAS7 suma wyników (0–3 w przypadku bąbli pokrzywkowych + 0–3 w przypadku świądu) dla każdego dnia jest podsumowywana w ciągu jednego tygodnia (7 dni), co daje maksymalną wartość łączną wynoszącą 42. W przypadku AAS wyniki sumuje się do wyniku dziennej sumy AAS (0–15), 7-dniowe AAS wynika z sumy tygodniowej AAS (AAS7, 0–105), a 4 wyniki tygodniowej sumy AAS mogą zostać zsumowane do wyniku sumarycznego AAS 4-tygodniowego (AAS28, 0–420). Prawa autorskie dotyczące UAS: GA2LEN; prawa autorskie dotyczące AAS (wersja brytyjska): MOXIE GmbH (www.moxie-gmbh.de).
Poza aktywnością choroby ważna jest ocena wpływu choroby na jakość życia, a także kontroli choroby, zarówno w praktyce klinicznej, jak i w badaniach klinicznych. CU-Q2oL należy wykorzystywać do określenia pogorszenia jakości życia u pacjentów z CSU z bąblami. U pacjentów z CSU z obrzękiem naczynioruchowym, z bąblami lub bez, powinno się stosować AE-QoL. U pacjentów z CSU z bąblami i obrzękiem naczynioruchowym należy wykorzystywać CU-Q2oL i AE-QoL.
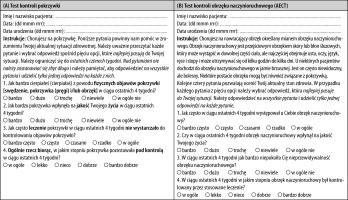
Ważna jest również ocena kontroli choroby u pacjentów z CSU. W tym celu powinno się stosować test kontroli pokrzywki (UCT) u pacjentów z CSU, u których występują bąble z obrzękiem naczynioruchowym lub bez (ryc. 2 A). U pacjentów z CSU, u których stwierdza się obrzęk naczynioruchowy z bąblami lub bez, należy wykorzystywać test kontroli obrzęku naczynioruchowego (AECT) (ryc. 2 B). U pacjentów z CSU, u których występują bąble i obrzęk naczynioruchowy, powinno się stosować zarówno UCT, jak i AECT. Skala UCT została opracowana i zwalidowana w celu określenia poziomu kontroli choroby we wszystkich postaciach CU (CSU i CIndU) [43, 44]. UCT jest prostym czteropunktowym narzędziem z jasno określoną wartością progową dla pacjentów z „dobrze kontrolowaną” lub „słabo kontrolowaną” chorobą, dzięki czemu nadaje się do prowadzenia pacjentów w rutynowej praktyce klinicznej. Okres odniesienia w przypadku tej skali wynosi 4 tygodnie. Dostępna jest również wersja UCT z 7-dniowym okresem odniesienia (UCT7). Wartość progowa UCT dla dobrze kontrolowanej choroby wynosi 12 na 16 możliwych punktów. AECT pozwala określić ilościowo kontrolę choroby u chorych na CSU z obrzękiem naczynioruchowym oraz pacjentów z innymi postaciami nawracającego obrzęku naczynioruchowego [38]. Podobnie jak UCT, AECT jest retrospektywnym PROM. Istnieją dwie wersje: jedna z 4-tygodniowym okresem odniesienia i druga z 3-miesięcznym okresem odniesienia. AECT składa się, podobnie jak UCT, z zaledwie czterech pytań. Wartość progowa dla dobrze kontrolowanej choroby wynosi 10 punktów. Zarówno UCT, jak i AECT są łatwe w stosowaniu, kompletne oraz wymierne. Mogą pomóc w podejmowaniu decyzji terapeutycznych.
RYCINA 2
A – Test kontroli pokrzywki (UCT), B – test kontroli obrzęku naczynioruchowego (AECT). Prawa autorskie do obu narzędzi: MOXIE GmbH, Berlin, Niemcy (www.moxie-gmbh.de)
4.3 BADANIA DIAGNOSTYCZNE W CINDU
U pacjentów z CIndU rutynowa diagnostyka powinna przebiegać zgodnie z uzgodnionymi zaleceniami dotyczącymi definicji, badań diagnostycznych i postępowania w przypadku CIndU [45]. Diagnostyka w przypadku CIndU ma na celu wykluczenie rozpoznań różnicowych, identyfikację podtypu CIndU i określenie progów wyzwalania [45]. To ostatnie jest ważne, ponieważ pozwala ocenić aktywność choroby i odpowiedź na leczenie.
W przypadku większości podtypów CIndU dostępne są zatwierdzone narzędzia służące do testów prowokacyjnych [45]. Przykłady obejmują pokrzywkę z zimna i ciepła, w której dostępne jest urządzenie do testów prowokacyjnych oparte na elementach Peltiera (TempTest®) [46], dermografizm objawowy, dla którego opracowano dermografometry (tester dermograficzny, FricTest) [47, 48] oraz pokrzywka opóźniona z ucisku (dermografometr). W przypadku pokrzywki cholinergicznej dostępny jest stopniowany test prowokacyjny do stosowania w gabinecie, np. ergometria sterowana tętnem [49, 50]. Pacjenci z pokrzywką kontaktową lub pokrzywką wodną powinni być oceniani za pomocą odpowiednich skórnych testów prowokacyjnych [45].
Kontrolę choroby u pacjentów z CIndU ocenia się za pomocą określenia progu prowokacji oraz stosowania UCT i AECT. Miary oceny aktywności i wpływu choroby zgłaszanych przez pacjentów są dostępne lub opracowywane w przypadku niektórych CIndU ]50, 51].
4.4. DIAGNOSTYKA U DZIECI
Pokrzywka może wystąpić we wszystkich grupach wiekowych, w tym u niemowląt i małych dzieci. Ostatnie doniesienia wskazują, że u dzieci częstość występowania CIndU i CSU, charakterystyka choroby, przyczyny CSU i odpowiedź na leczenie są bardzo podobne do tych u dorosłych [52–59].
Badania diagnostyczne w przypadku CSU u dzieci mają takie same cele jak u dorosłych. Rozpoznania różnicowe należy wykluczyć ze szczególnym uwzględnieniem okresowego zespołu związanego z kriopiryną (CAPS). CAPS to rzadka choroba z wysypką przypominającą pokrzywkę, która objawia się w dzieciństwie [60]. Jeśli jest to możliwe, tzn. w zależności od wieku dziecka, aktywność choroby, jej wpływ i kontrolę należy oceniać za pomocą narzędzi oceny podobnych do tych stosowanych u dorosłych, chociaż należy pamiętać, że jak na razie nie są dostępne żadne zwalidowane, specyficzne dla choroby narzędzia przeznaczone dla dzieci. Powinno się zidentyfikować czynniki wyzwalające zaostrzenie, a tam, gdzie to jest wskazane, należy poszukać zasadniczych przyczyn, które wydają się podobne do występujących u dorosłych. U dzieci z CIndU należy przeprowadzić podobne testy prowokacyjne oraz określić progi czynników wyzwalających (jeżeli jest to możliwe w zakresie współpracy właś-ciwej dla wieku).
5. LECZENIE POKRZYWKI
5.1. KWESTIE PODSTAWOWE
Celem terapii jest leczenie choroby aż do jej ustąpienia oraz możliwie najskuteczniejsze i najbezpieczniejsze dążenie do utrzymania wyniku w skali UAS7 = 0, pełnej kontroli i normalizacji jakości życia.
Podejście terapeutyczne do leczenia CU powinno obejmować:
poszukiwanie i, jeśli jest to możliwe, wyeliminowanie przyczyn zasadniczych, co oznacza wyleczenie choroby,
unikanie czynników wywołujących, co zmniejszy aktywność choroby,
wywołanie tolerancji, co zmniejszy aktywność choroby,
stosowanie leczenia farmakologicznego w celu zapobieżenia uwalnianiu mediatorów komórek tucznych i/lub skutkom działania mediatorów komórek tucznych, co zmniejszy aktywność choroby.
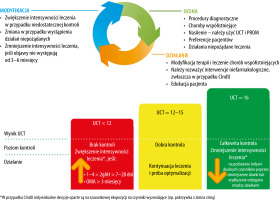
Leczenie powinno być w jak największym stopniu zgodne z podstawowymi zasadami terapii, uwzględniając fakt, że aktywność choroby może być różna. Oznacza to przejście na wyższy lub niższy poziom w algorytmie leczenia w zależności od przebiegu choroby zgodnie z zasadą oceny, dostosowania, działania i ponownej oceny (ryc. 3). Należy podkreślić, że pacjenci potrzebują dobrych porad w zakresie ciągłego leczenia i stosowania narzędzi do oceny wyników leczenia dokonywanej przez pacjenta (PROM), zwłaszcza UAS.
5.2. IDENTYFIKACJA I ELIMINACJA ZASADNICZYCH PRZYCZYN ORAZ UNIKANIE CZYNNIKÓW WYWOŁUJĄCYCH
Chociaż jest to pożądane, u większości pacjentów z pokrzywką eliminacja przyczyn zasadniczych nie jest możliwa. Przyczyny CIndU są nieznane, przyczyny ostrej pokrzywki spontanicznej pozostają niewyjaśnione u większości pacjentów, a najczęstszych przyczyn CSU, autoimmunizacji typu I i IIb, nie można wyeliminować. Wykazano, że zmniejszenie liczby autoprzeciwciał za pomocą plazmaferezy przynosi tymczasowe korzyści u niektórych ciężko chorych pacjentów z CSU [61], ale doświadczenie i dowody są ograniczone, a koszty wysokie.
Unikanie natomiast, jeśli jest to możliwe, czynników wyzwalających może być korzystne dla pacjentów z pokrzywką [62]. W przypadku CIndU unikanie specyficznych i określonych czynników wyzwalających pojawienie się objawów przedmiotowych i podmiotowych, np. niskiej temperatury w pokrzywce z zimna, może zmniejszyć aktywność choroby. W przypadku CSU uniknięcie indywidualnych istotnych i niespecyficznych czynników wyzwalających, np. stresu lub przyjmowania NLPZ, może pomóc w ograniczeniu zaostrzeń choroby. Co ważne, unikanie czynników wyzwalających u pacjentów z CIndU i z CSU może skutkować znacznym pogorszeniem jakoś-ci życia, np. u pacjentów z pokrzywką cholinergiczną, którzy powstrzymują się od wysiłku fizycznego, lub u tych z pokrzywką słoneczną, którzy unikają przebywania na zewnątrz.
5.2.1. Leki
Jeśli w trakcie badań diagnostycznych wysuwamy podejrzenie roli leków, należy je całkowicie pominąć lub – jeżeli jest to konieczne – zastąpić inną grupą leków. Leki powodujące niealergiczne reakcje nadwrażliwości (prototypami są NLPZ) mogą nie tylko wywoływać, lecz także nasilać wcześniej istniejącą CSU, tak więc eliminacja w tym drugim przypadku poprawi objawy tylko u niektórych pacjentów.
5.2.2. Określone i swoiste czynniki wyzwalające ClndU
Unikanie specyficznych i określonych czynników wywołujących CIndU może pomóc w ograniczeniu występowania bąbli i obrzęku naczynioruchowego, ale zwykle nie wystarcza do kontrolowania choroby i może się wiązać ze znacznym obciążeniem. Pacjenci powinni otrzymać informacje ułatwiające im rozpoznawanie i minimalizację istotnej ekspozycji na czynnik wyzwalający. Na przykład: pacjentów z opóźnioną pokrzywką z ucisku należy poinformować, że ucisk definiuje się jako siłę oddziałującą na powierzchnię i że proste środki, takie jak poszerzenie uchwytu ciężkich toreb, mogą być pomocne w zapobieganiu objawom. Podobne kwestie dotyczą pokrzywki z zimna, w przypadku której należy pamiętać o wpływie czynnika chłodu w postaci zimnego wiatru. W przypadku pokrzywki słonecznej dokładna identyfikacja zakresu wywołujących długości fali może być istotna w doborze odpowiednich filtrów przeciwsłonecznych lub żarówek z filtrem UV-A. U wielu pacjentów jednak wartość progowa odpowiedniego czynnika wyzwalającego jest niska, a całkowite uniknięcie objawów jest praktycznie niemożliwe. Na przykład: ciężki objawowy dermografizm jest czasami mylony z CSU, ponieważ pozornie spontanicznie pojawiające się bąble są obserwowane, gdy nawet luźna odzież ociera się o skórę pacjenta bądź niezamierzone drapanie się pacjentów łatwo powoduje pojawienie się bąbli w tym obszarze.
5.2.3. Zakażenia i procesy zapalne
W przeciwieństwie do CIndU, CSU jest związana z różnymi chorobami zapalnymi lub zakaźnymi. W niektórych przypadkach uważa się to za istotne, ale badania wykazują sprzeczne wyniki i charakteryzują się niedociągnięciami metodologicznymi. Do zakażeń, które mogą przyczyniać się do aktywności CSU, należą: zakażenia przewodu pokarmowego, takie jak zakażenie Helicobacter pylori i zakażenia bakteryjne nosogardzieli [63] (nawet jeśli związek z pokrzywką u danego pacjenta nie jest znany, a metaanaliza wykazuje ogólnie niskie dowody na terapię eradykacyjną [63], H. pylori należy wyeliminować, ponieważ sugeruje się związek z rakiem żołądka [64]). Pasożyty jelitowe, rzadka możliwa przyczyna CSU w rozwiniętych krajach uprzemysłowionych, powinny zostać wyeliminowane, jeśli jest to wskazane [63, 65]. W przeszłości kandydozę jelit uważano za bardzo ważną przyczynę CSU [63], ale nowsze wyniki nie potwierdzają istotnej roli przyczynowej [66]. Oprócz chorób zakaźnych jako potencjalnie wyzwalające CSU zidentyfikowano przewlekłe procesy zapalne wywołane różnymi innymi chorobami. Mogą one być wtórne do zakażeń. Dotyczy to zwłaszcza zapalenia żołądka, refluksowego zapalenia przełyku lub zapalenia dróg żółciowych bądź pęcherzyka żółciowego [67, 68]. W związku z tym można stwierdzić, że skuteczna eradykacja Helicobacter ma wpływ na CSU, wyłącznie jeśli następczy stan zapalny, tj. zapalenie żołądka i zapalenie przełyku, jest leczony [69]. Podobnie jak w przypadku zakażeń nie można łatwo stwierdzić, czy którakolwiek z tych przyczyn jest istotna dla CSU, ale należy je leczyć, gdyż wiele z nich może również się wiązać z rozwojem nowotworów złośliwych.
5.2.4. Stres
Chociaż mechanizmy zaostrzenia indukowanego stresem nie są dobrze zbadane, niektóre dowody wskazują, że aktywność choroby u pacjentów z CSU może być związana ze stresem [70]. Konieczne są dalsze badania w celu scharakteryzowania częstości występowania oraz istotności zaostrzania CSU przez stres, a także mechanizmów leżących u jego podłoża.
5.2.5. Zmniejszenie liczby czynnościowych autoprzeciwciał
Stwierdzono, że bezpośrednie zmniejszenie liczby czynnościowych autoprzeciwciał za pomocą plazmaferezy przynosi tymczasowe korzyści u niektórych pacjentów poważnie dotkniętych chorobą [61]. Ze względu na ograniczone doświadczenie i wysokie koszty terapia ta jest sugerowana u pacjentów z CSU z autoprzeciwciałami, którzy nie reagują na żadne inne formy leczenia. Liczba autoprzeciwciał i potencjalnie aktywowanych limfocy- tów T może także zostać zmniejszona przez leki immunosupresyjne, takie jak cyklosporyna [71].
5.2.6. Żywność
Alergia pokarmowa mediowana przez IgE jest niezwykle rzadko przyczyną CSU [72, 73]. Jeśli została zidentyfikowana, należy w miarę możliwości wyeliminować specyficzne alergeny pokarmowe, co prowadzi do remisji w czasie krótszym niż 24 godz. U części pacjentów z CSU zaobserwowano reakcje pseudoalergiczne (reakcje nadwrażliwości niezależne od IgE) na naturalnie występujące składniki żywności, a w niektórych przypadkach – na dodatki do żywności [72–77]. Dieta bez pseudoalergenów zawierająca tylko niewielką liczbę naturalnych i sztucznych pseudoalergenów spożywczych była testowana w różnych krajach [78], ponadto dieta uboga w histaminę może łagodzić objawy u niektórych pacjentów [79]. Diety te są kontrowersyjne i dotąd ich skuteczność nie została potwierdzona dobrze zaprojektowanymi, podwójnie zaślepionymi badaniami kontrolowanymi placebo. W przypadku stosowania takiej diety należy ją zazwyczaj utrzymywać przez co najmniej 2–3 tygodnie, zanim pojawią się korzystne efekty. Tego rodzaju leczenie wymaga pacjentów współpracujących, a wskaźniki powodzenia mogą się znacznie różnić ze względu na regionalne różnice w żywności i nawykach żywieniowych. Konieczne są dalsze badania dotyczące wpływu naturalnych i sztucznych składników żywności na pokrzywkę.
5.3. INDUKOWANIE TOLERANCJI
Indukowanie tolerancji może być przydatne w niektórych podtypach ClndU. Przykładami są pokrzywka z zimna, pokrzywka cholinergiczna i pokrzywka słoneczna, w przypadku której intensywna terapia UV-A okazała się skuteczna w ciągu 3 dni [80]. Indukcja tolerancji jednak trwa tylko kilka dni; w związku z tym wymagana jest stała, codzienna ekspozycja na bodziec na poziomie progowym. Indukowanie i podtrzymywanie tolerancji często nie są akceptowane przez pacjentów, np. w przypadku pokrzywki z zimna, ponieważ do osiągnięcia tego celu potrzebne są codzienne zimne kąpiele w wannie lub pod prysznicem.
5.4. OBJAWOWE LECZENIE FARMAKOLOGICZNE
5.4.1. Cele terapii farmakologicznej i konieczność kontynuacji leczenia
Obecnie zalecane opcje terapeutyczne w przypadku pokrzywki mają na celu ukierunkowanie na mediatory komórek tucznych, takie jak histamina, lub aktywatory, np. autoprzeciwciała. Nowatorskie metody leczenia, które są aktualnie opracowywane, mają na celu wyciszenie komórek tucznych za pomocą receptorów hamujących lub zmniejszenie liczby tych komórek. Ogólnym celem wszystkich tych metod leczenia objawowego jest pomoc pacjentom w ustąpieniu objawów przedmiotowych i podmiotowych do czasu, gdy nie dojdzie u nich do spontanicznej remisji. Aby to osiągnąć, leczenie farmakologiczne powinno być ciągłe, aż nie będzie już konieczne. Na przykład: niesedatywne leki przeciwhistaminowe H1 II generacji powinny być stosowane codziennie, aby zapobiec występowaniu bąbli i obrzęku naczynioruchowego, a nie doraźnie. Potwierdzają to ich profil bezpieczeństwa (dane o bezpieczeństwie są dostępne dla kilku lat ciągłego stosowania), wyniki randomizowanych badań kontrolowanych i badań prowadzonych w praktyce klinicznej [81, 82] oraz ich mechanizm działania, to znaczy ich odwrotny efekt agonistyczny na receptor H, stabilizujący jego stan nieaktywny. Niektórzy pacjenci z CIndU mogą odnieść korzyści z krótkotrwałego profilaktycznego leczenia przeciwhistaminowego przed istotną ekspozycją na czynnik wyzwalający.
5.4.2. Leczenie przeciwhistaminowe H1
Od lat 50. XX wieku dostępne są leki przeciwhistaminowe stosowane w leczeniu pokrzywki. Starsze leki przeciwhistaminowe H1 I generacji mają wyraźne działanie przeciwcholinergiczne i uspokajające. Opisywano wiele interakcji z alkoholem i innymi lekami, takimi jak leki przeciwbólowe, nasenne, uspokajające i poprawiające nastrój. Mogą również zakłócać fazę snu szybkich ruchów gałek ocznych (REM) oraz wpływać na uczenie się i aktywność. Niesprawność jest szczególnie widoczna podczas wykonywania wielu zadań jednocześnie i wykonywania złożonych zadań czuciowo-ruchowych, takich jak prowadzenie pojazdów. W stanowisku GA2LEN [83] zdecydowanie zalecono, aby nie stosować już leków przeciwhistaminowych H1 I generacji w przypadku alergii, zarówno u dorosłych, jak i zwłaszcza u dzieci. Pogląd ten został powielony w wytycznych WHO ARIA [84]. Opierając się na mocnych dowodach dotyczących potencjalnie poważnych działań niepożądanych leków przeciwhistaminowych H1 I generacji (zgłoszono przypadki śmiertelnego przedawkowania), nie zalecamy ich stosowania w rutynowym leczeniu CU jako leków pierwszego rzutu.
Nowoczesne leki przeciwhistaminowe H1 II generacji działają minimalnie uspokajająco lub nie mają takiego działania w ogóle oraz nie mają działania przeciwcholinergicznego [85]. Stwierdzono jednak, że dwa leki przeciwhistaminowe II generacji – astemizol i terfenadyna, mają działanie kardiotoksyczne u pacjentów leczonych inhibitorami izoenzymu cytochromu P450 (CYP) 3A4, takimi jak ketokonazol lub erytromycyna. Astemizol i terfenadyna nie są już dostępne w większości krajów i nie zalecamy ich stosowania.
Większość, choć nie wszystkie, leków przeciwhistaminowych H1 II generacji została przebadana specjalnie w zakresie pokrzywki, a dowody przemawiają za stosowaniem bilastyny, cetyryzyny, desloratadyny, ebastyny, feksofenadyny, lewocetyryzyny, loratadyny i rupatadyny. Jako objawowe leczenie pierwszego rzutu w przypadku pokrzywki zalecamy stosowanie nowoczesnych leków przeciwhistaminowych H1 II generacji w standardowych dawkach. Nie można jednak sformułować żadnych zaleceń co do wyboru konkretnego leku, ponieważ do tej pory brakuje dobrze zaprojektowanych badań klinicznych porównujących skuteczność i bezpieczeństwo wszystkich nowoczesnych leków przeciwhistaminowych H1 II generacji w leczeniu pokrzywki.
W kilku badaniach stwierdzono korzyści płynące ze stosowania większych dawek niż standardowe dawki leków przeciwhistaminowych H1 II generacji u pacjentów z pokrzywką [86–88], które stanowiły potwierdzenie wcześniejszych badań dotyczących leków przeciwhistaminowych H1 I generacji, w których wysnuto te same wnioski [89, 90]. Badania potwierdzają stosowanie nawet czterokrotnie wyższej od standardowej dawki bilastyny, cetyryzyny, desloratadyny, ebastyny, feksofenadyny, lewocetyryzyny i rupatadyny [86, 87, 91–94].
Podsumowując, badania te sugerują, że niektórzy pacjenci z pokrzywką, u których stwierdza się niewystarczającą odpowiedź na standardowe dawki leków przeciwhistaminowych H1 II generacji, odnoszą korzyści ze zwiększenia dawki. Jest to postępowanie preferowane względem łączenia różnych leków przeciwhistaminowych H1 II generacji, ponieważ ich właściwości farmakologiczne są różne. Dlatego też zalecamy u takich pacjentów zwiększenie dawki nawet czterokrotnie (ryc. 4). Należy poinformować pacjentów, że zwiększanie dawek leków przeciwhistaminowych H1 II generacji ma charakter pozarejestracyjny, a przekraczanie czterokrotności dawki nie jest zalecane, ponieważ nie przeprowadzono odpowiednich badań. Jednak od 2000 r. w wytycznych dotyczących pokrzywki sugerowano zwiększenie dawki i dotąd nie zgłoszono żadnych poważnych zdarzeń niepożądanych ani w piśmiennictwie nie opisano żadnego działania niepożądanego związanego z długotrwałym przyjmowaniem i potencjalnym gromadzeniem się tych leków.
RYCINA 4
Zalecany algorytm leczenia pokrzywki. AH – lek przeciwhistaminowy, CU – przewlekła pokrzywka, GRADE – Grading of Recommendations Assessment, Development and Evaluation (grupa robocza). Pierwszy rzut = wysoka jakość danych naukowych: niski koszt i ogólnoświatowa dostępność (np. nowoczesne leki przeciwhistaminowe H1 II generacji są dostępne również w krajach rozwijających się, przeważnie tańsze niż stare leki przeciwhistaminowe o działaniu uspokajającym), w przeliczeniu na dawkę dobową, ponieważ okres półtrwania jest znacznie dłuższy oraz istnieje bardzo dobry profil bezpieczeństwa i dobra skuteczność. Drugi rzut (omalizumab jako leczenie dodatkowe do leku przeciwhistaminowego H1 II generacji) = wysoka jakość dowodów: wysokie koszty, bardzo dobry profil bezpieczeństwa, bardzo dobra skuteczność. Trzecia linia (cyklosporyna jako leczenie dodatkowe) = wysoka jakość dowodów: średnie do wysokich kosztów, umiarkowany profil bezpieczeństwa, dobra skuteczność. Krótki cykl leczenia glikokortykosteroidami = niska jakość dowodów: niska cena, dostępność na całym świecie, dobry profil bezpieczeństwa (tylko w przypadku krótkiego cyklu), dobra skuteczność podczas przyjmowania leku, ale nieodpowiednie do długotrwałego leczenia.

5.4.3. Leczenie omalizumabem
Omalizumab jest jedynym innym zarejestrowanym lekiem do stosowania w leczeniu pokrzywki dla pacjentów, u których nie stwierdzono wystarczających korzyści z leczenia lekami przeciwhistaminowymi H1 II generacji, i dlatego stanowi on kolejny etap w algorytmie. Wykazano, że omalizumab (anty-IgE) jest bardzo skuteczny i bezpieczny w leczeniu CSU [95–100]. Opisywano również skuteczność omalizumabu w leczeniu CIndU [101–103], w tym pokrzywki cholinergicznej [104], pokrzywki z zimna [105, 106], pokrzywki słonecznej [107], pokrzywki cieplnej [108], objawowego dermografizmu [109, 110] i pokrzywki opóźnionej z ucisku [111]. W przypadku CSU omalizumab zapobiega rozwojowi bąbla i obrzęku naczynioruchowego [112], znacznie poprawia jakość życia [113, 114], nadaje się do długotrwałego leczenia [115] i skutecznie leczy nawroty po odstawieniu [115, 116]. Zalecana dawka początkowa w przypadku CSU wynosi 300 mg co 4 tygodnie. Dawkowanie jest niezależne od całkowitego stężenia IgE w surowicy [117].
Pacjenci z pokrzywką, u których nie stwierdzono wystarczających korzyści z leczenia omalizumabem w zarejestrowanej dawce 300 mg co 4 tygodnie, mogą być leczeni omalizumabem w większych dawkach, w krótszych odstępach lub w większych dawkach i w krótszych odstępach jednocześnie. Badania potwierdzają zasadność stosowania omalizumabu w dawkach do 600 mg i co 2 tygodnie u pacjentów, u których nie uzyskano wystarczającej odpowiedzi na standardowe dawki omalizumabu [118–121]. Pacjentów należy poinformować, że zwiększanie dawki omalizumabu ma charakter pozarejestracyjny.
5.4.4. Leczenie cyklosporyną
Pacjenci z pokrzywką, którzy nie uzyskali wystarczających korzyści z leczenia omalizumabem, powinni być leczeni cyklosporyną w dawce 3,5–5 mg/kg/dobę. Cyklosporyna wykazuje działanie immunosupresyjne i ma umiarkowany, bezpośredni wpływ na uwalnianie mediatorów z komórek tucznych [122, 123]. Skuteczność cyklosporyny w skojarzeniu z nowoczesnym lekiem przeciwhistaminowym H1 II generacji potwierdzono w badaniach kontrolowanych placebo [71, 124, 125], jak również w otwartych badaniach kontrolowanych [126] dotyczących CSU. Lek ten nie może jednak być zalecany jako standardowe leczenie ze względu na częstsze występowanie działań niepożądanych [124]. Cyklosporyna jest niezarejestrowana w leczeniu pokrzywki i jest zalecana tylko pacjentom z ciężką postacią choroby oporną na jakąkolwiek dawkę leku przeciwhistaminowego w skojarzeniu z omalizumabem. Cyklosporyna ma jednak znacznie lepszy stosunek korzyści do ryzyka w porównaniu z długotrwałym stosowaniem glikokortykosteroidów.
5.4.5. Inne leczenie objawowe
W niektórych wcześniejszych badaniach RCT oceniano stosowanie antagonistów receptora leukotrienowego. Badania są trudne do porównania ze względu na różne badane populacje, np. włączenie tylko pacjentów z nietolerancją kwasu acetylosalicylowego i dodatków do żywności lub wykluczenie pacjentów ASST-dodatnich. Ogólnie rzecz biorąc, poziom dowodów na skuteczność antagonistów receptora leukotrienowego w przypadku pokrzywki jest niski, ale najlepszy dla montelukastu.
Obecnie glikokortykosteroidy do stosowania miejscowego są często i z powodzeniem wykorzystywane w wielu chorobach alergicznych, ale w przypadku pokrzywki glikokortykosteroidy do stosowania miejscowego nie są pomocne (z możliwym wyjątkiem w przypadku pokrzywki z ucisku na podeszwach stóp jako terapia alternatywna o niskich dowodach naukowych). W przypadku stosowania glikokortykosteroidów ogólnoustrojowych potrzebne są dawki od 20 do 50 mg/dobę ekwiwalentu prednizonu (dawka jest odpowiednia dla dorosłych, a nie dla dzieci). Ponieważ tak wysokie dawki będą miały działania niepożądane w dłuższej perspektywie, zdecydowanie odradzamy stosowanie glikokortykosteroidów poza specjalistycznymi klinikami. W zależności od kraju należy zauważyć, że glikokortykosteroidy nie są również zarejestrowane do stosowania w leczeniu CU (np. prednizolon w Niemczech jest zarejestrowany wyłącznie do stosowania w leczeniu ostrej pokrzywki). W przypadku ostrej pokrzywki i ostrych zaostrzeń CSU krótki cykl doustnych glikokortykosteroidów, tj. leczenie maksymalnie do 10 dni, może być jednak pomocny w skróceniu czasu trwania choroby lub zmniejszeniu jej aktywności [127, 128]. Brakuje natomiast dobrze zaprojektowanych badań RCT.
Podczas gdy leki przeciwhistaminowe w dawkach odpowiadających nawet czterokrotności dawek zalecanych przez producentów kontrolują objawy u dużej części pacjentów z pokrzywką w praktyce ogólnej, dla pozostałych pacjentów niereagujących potrzebne są alternatywne metody leczenia. Zdecydowanie zaleca się przestrzeganie tego algorytmu, ale uznaje się, że omalizumab ma ograniczenia ze względu na wysoki koszt, a cyklosporyna – ze względu na profil bezpieczeństwa.
Ponieważ nasilenie pokrzywki może być zmienne, a spontaniczna remisja może wystąpić w dowolnym momencie, zaleca się także ponowną ocenę konieczności dalszego lub alternatywnego leczenia farmakologicznego co 3–6 miesięcy. Znajduje to również odzwierciedlenie na rycinie 3.
Wszystkie terapie niewymienione w algorytmie leczenia (ryc. 4) są oparte na badaniach klinicznych o niskim poziomie dowodów (tab. 11).
TABELA 11
Alternatywne opcje terapeutyczne
Obecnie uważa się, że leki z grupy antagonistów H2 i dapson, zalecane w poprzednich wersjach wytycznych, są związane z liczbą dowodów niewystarczającą do tego, aby zachować je jako zalecane w algorytmie. Nadal jednak mogą mieć znaczenie, ponieważ są bardzo przystępne cenowo w niektórych systemach ochrony zdrowia, w których istnieją większe ograniczenia. Sulfasalazyna, metotreksat, interferon, plazmafereza, fototerapia, dożylne immunoglobuliny (IVIG lub IGIV) i inne opcje leczenia mają niską jakość dowodów lub opublikowano tylko serie przypadków [2] (tab. 11). Pomimo braku opublikowanych danych wszystkie te leki mogą być wartościowe dla poszczególnych pacjentów w odpowiednim kontekście klinicznym [129].
Zastosowanie antagonistów czynnika martwicy nowotworu α (TNF-α) [130] i IVIG [131–134], wykorzystywanych z powodzeniem w opisach przypadków, zaleca się obecnie jedynie w wyspecjalizowanych ośrodkach jako ostatnią opcję (tj. anty-TNF-α w przypadku pokrzywki opóźnionej z ucisku i IVIG/IGIV w CSU) [135, 136].
W terapii CSU i objawowego dermografizmu do leczenia przeciwhistaminowego można dodać UV-B (wąskie pasmo UV-B, TL01), UV-A i PUVA przez 1–3 miesiące [137–139], ale należy zachować ostrożność w związku z rakotwórczym efektem leczenia światłem UV.
Niektóre wcześniej proponowane alternatywne metody leczenia okazały się nieskuteczne w badaniach prowadzonych metodą podwójnie ślepej próby kontrolowanej placebo i nie powinny być dłużej stosowane, ponieważ poziom zalecenia jest niski. Należą do nich kwas trane- ksamowy i kromoglikan sodu w przypadku CSU [140, 141], nifedypina w objawowym dermografizmie lub pokrzywce wywołanej [142] oraz kolchicyna i indometacyna w pokrzywce opóźnionej z ucisku [143, 144]. Mogą być jednak potrzebne dalsze badania w podgrupach pacjentów. Na przykład: badanie pilotażowe [145] z udziałem pacjentów z podwyższonym poziomem D-dimerów wykazało, że terapia heparyną i kwasem traneksamowym może być skuteczna.
5.5. LECZENIE SZCZEGÓLNYCH GRUP PACJENTÓW
5.5.1. Dzieci
Wielu klinicystów stosuje leki przeciwhistaminowe H1 I generacji jako leczenie pierwszego wyboru u dzieci z pokrzywką, zakładając, że ich profil bezpieczeństwa jest lepiej znany niż nowoczesnych leków przeciwhistaminowych H1 II generacji ze względu na dłuższe doświadczenie. Ponadto w wielu krajach nowoczesne leki przeciwhistaminowe H1 II generacji nie są zarejestrowane do stosowania u dzieci w wieku poniżej 6 miesięcy. Leki przeciwhistaminowe H1 I generacji mają jednak gorszy profil bezpieczeństwa w porównaniu z lekami przeciwhistaminowymi II generacji i dlatego nie są zalecane jako leczenie pierwszego rzutu u dzieci z pokrzywką. Leki przeciwhistaminowe H1 II generacji o udowodnionej skuteczności i bezpieczeństwie w populacji pediatrycznej to bilastyna [146], cetyryzyna [147], desloratadyna [148, 149], feksofenadyna [150], lewocetyryzyna [151], loratadyna [147] i rupatadyna [152]. U dzieci z pokrzywką należy wziąć pod uwagę wiek i dostępność, ponieważ nie wszystkie leki są dostępne w postaci syropu lub szybko rozpuszczających się tabletek odpowiednich dla dzieci. Najniższy wiek określony w rejestracji różni się również w zależności od kraju. Wszystkie dalsze kroki powinny opierać się na indywidualnych rozważaniach i być podejmowane ostrożnie, ponieważ zwiększenie dawki leków przeciwhistaminowych i dalsze opcje terapeutyczne nie zostały dobrze zbadane u dzieci. Ponadto krótki cykl leczenia glikokortykosteroidami, zgodnie z zaleceniami algorytmu, powinien być stosowany u dzieci jedynie w bardzo ograniczonym zakresie.
5.5.2. Kobiety w ciąży i karmiące piersią
Te same kwestie zasadniczo dotyczą kobiet w ciąży i karmiących piersią. Na ogół należy unikać stosowania jakiegokolwiek leczenia ogólnoustrojowego u kobiet w ciąży, zwłaszcza w pierwszym trymestrze. Jednocześnie kobiety w ciąży mają prawo do jak najlepszej terapii. Chociaż bezpieczeństwo leczenia nie było systematycznie badane u ciężarnych kobiet z pokrzywką, należy podkreślić, że nie badano również możliwych negatywnych skutków występujących w pokrzywce zwiększonych stopni wiązania histaminy przez receptory. Dotąd nie odnotowano przypadków wad wrodzonych u dzieci kobiet, które stosowały nowoczesne leki przeciwhistaminowe H1 II generacji w czasie ciąży. Dostępne są jednak tylko badania na małej wielkości próby w przypadku cetyryzyny [153] i jedna duża metaanaliza w przypadku loratadyny [154]. Ponadto, ponieważ kilka nowoczesnych leków przeciwhistaminowych H1 II generacji nie jest obecnie wydawanych tylko na receptę i są one powszechnie stosowane zarówno w alergicznym nieżycie nosa, jak i pokrzywce, należy założyć, że wiele kobiet stosowało te leki, zwłaszcza na początku ciąży, przynajmniej przed jej potwierdzeniem. Ponieważ zapewnienie najwyższego bezpieczeństwa jest priorytetowe w okresie ciąży, sugestią w zakresie stosowania nowoczesnych leków przeciwhistaminowych H1 II generacji jest preferowanie loratadyny z możliwą ekstrapolacją na desloratadynę i cetyryzynę z możliwą ekstrapolacją na lewocetyryzynę. Wszystkie leki przeciwhistaminowe H1 przenikają do mleka matki w małych stężeniach. Zaleca się stosowanie leków przeciwhistaminowych H1 II generacji, gdyż u niemowląt karmionych piersią sporadycznie dochodzi do sedacji po zastosowaniu starych leków przeciwhistaminowych H1 I generacji przenikających do mleka matki.
Zwiększenie dawki nowoczesnych leków przeciwhistaminowych H1 II generacji można tylko ostrożnie sugerować w okresie ciąży, ponieważ nie przeprowadzono badań dotyczących bezpieczeństwa, W przypadku loratadyny należy pamiętać, że lek ten jest metabolizowany w wątrobie, co nie dotyczy jego metabolitu – desloratadyny. Powinno się unikać przyjmowania leków przeciwhistaminowych H1 I generacji [83]. Stosowanie omalizumabu w ciąży jest uznawane za bezpieczne i dotąd nie ma dowodów wskazujących na jego teratogenność [155–158]. Wszystkie dalsze kroki powinny być oparte na indywidualnych rozważaniach, z preferencją dla leków o zadowalającym stosunku korzyści do ryzyka u kobiet w ciąży i noworodków pod względem teratogenności i embriotoksyczności. Na przykład: cyklosporyna, choć nie ma działania teratogennego, wykazuje działanie embriotoksyczne w modelach zwierzęcych i może powodować wcześniactwo oraz niską urodzeniową masę ciała u niemowląt. Niezależnie od tego, czy korzyści ze stosowania cyklosporyny w CU są istotne, ryzyko u kobiet w ciąży będzie musiało zostać określone indywidualnie. Wszystkie decyzje powinny jednak podlegać ponownej ocenie zgodnie z aktualnymi zaleceniami publikowanymi przez organy regulacyjne.
6. POTRZEBA DALSZYCH BADAŃ
Panel i uczestnicy zidentyfikowali kilka obszarów, w których potrzebne są dalsze badania. Punkty te podsumowano w tabeli 12.
TABELA 12
Obszary dalszych badań nad pokrzywką