Wstęp
Anafilaksja jest ciężką, szybko rozwijającą się, potencjalnie zagrażającą życiu, ogólnoustrojową lub układową reakcją nadwrażliwości (alergicznej lub niealergicznej). Wstrząs anafilaktyczny to ciężka, szybko rozwijająca się reakcja anafilaktyczna (anafilaksja), w przebiegu której występuje zagrażające życiu obniżenie ciśnienia tętniczego [1].
W większości przypadków objawy anafilaksji ustępują bez nawrotu po zastosowaniu szybkiej interwencji z podaniem adrenaliny. U części chorych przebieg może być powikłany, przyjmując postać anafilaksji dwufazowej, przedłużającej się lub opornej na leczenie.
Zgodnie z definicją anafilaksja dwufazowa (AD) opisywana jest jako nawrót lub wystąpienie nowych objawów spełniających kryteria anafilaksji, po ustąpieniu reakcji pierwotnej i bez ponownej ekspozycji na alergen, a nowe objawy pojawiają się po upływie od 1 do 48 godzin od ustąpienia reakcji pierwotnej, maksymalnie do 72 godzin. Większość artykułów podaje średni czas odstępu pomiędzy fazami około 8 godzin [2, 3]. Powinno mieć to przełożenie na praktykę postępowania w izbach przyjęć (IP) lub w szpitalnych oddziałach ratunkowych (SOR) i skutkować wydłużeniem obserwacji pacjentów po przebytej AD.
Za anafilaksję przedłużającą się uważa się stan, w którym objawy spełniające kryterium anafilaksji utrzymują się przez co najmniej 4 godziny [1, 2]. O anafilaksji opornej na leczenie mówimy, gdy objawy utrzymują się pomimo zastosowania co najmniej trzech adekwatnych dawek adrenaliny (0,01 mg/kg m.c., maksymalna jednorazowa wynosi 0,5 mg) domięśniowo lub adrenaliny podanej we wlewie dożylnym oraz po wdrożeniu terapii dostosowanej do obrazu klinicznego (np. płynoterapii w hipotensji) [1, 2].
Opis dotyczy przypadku dwufazowej reakcji alergicznej podczas epizodu anafilaksji w przebiegu użądlenia polnego przez osę oraz w trakcie fazy wstępnej immunoterapii alergenowej (AIT) jadem osy u dziecka.
Opis przypadku
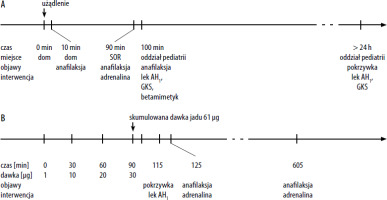
Siedmioletni chłopiec został użądlony przez osę w udo prawe w sierpniu 2022 roku. Po około 10 minutach od zdarzenia wystąpiła zlewna pokrzywka, duszność, głośny, świszczący oddech, „duszący” kaszel oraz mowa przerywanymi zdaniami. Objawy spełniały kryterium III stopnia anafilaksji wg czterostopniowej klasyfikacji Ringa i Messmera [4]. W przeszłości był jednokrotnie żądlony przez osę w palec, wówczas wystąpiła duża reakcja miejscowa, nigdy nie był żądlony przez pszczołę. Chłopiec został transportem własnym przekazany do SOR, gdzie otrzymał 0,2 mg adrenaliny domięśniowo (i.m.) z poprawą. Rodzice nie otrzymali karty informacyjnej z SOR, nie są znane parametry życiowe z okresu bezpośrednio przed podaniem adrenaliny. Następnie dziecko było hospitalizowane na oddziale pediatrii. W chwili przyjęcia jego stan ogólny był oceniony jako dobry, parametry życiowe (zmierzone po podaniu adrenaliny) mieściły się w normie dla wieku (saturacja 100%, akcja serca 86/min, ciśnienie tętnicze 113/65 mm Hg). Z odchyleń od normy w badaniu fizykalnym stwierdzono na skórze całego ciała wykwity pokrzywkowe, a osłuchowo – nad polami płucnymi wydłużony wydech. W leczeniu stosowano klemastynę dożylnie (i.v.), hydrokortyzon i.v., salbutamol w inhalacji, płyny i.v. oraz doustny lek przeciwhistaminowy (AH1) z poprawą. W kolejnej dobie hospitalizacji zaobserwowano nawrót pokrzywki, która uległa remisji po jednorazowym podaniu leku AH1 i hydrokortyzonu ( ryc. 1 A).
Rycina 1
Prezentacja sekwencji czasowej zdarzeń i zastosowanej interwencji w przebiegu anafilaksji dwufazowej: po użądleniu polnym (A) i po terapeutycznym podaniu jadu (B)
Ponadto w wywiadzie do 6. roku życia u chłopca stwierdzono nawracające zakażenia dróg oddechowych w postaci zapaleń oskrzeli z obturacją, na tej podstawie rozpoznano astmę wczesnodziecięcą nieatopową. Wywiad w kierunku atopowego zapalenia skóry i alergii pokarmowej był ujemny, nie obserwowano zmian skórnych typowych dla mastocytozy.
W styczniu 2023 roku w warunkach szpitalnych dziecko miało przeprowadzoną diagnostykę alergii na jad owadów błonkoskrzydłych. Wykonano testy skórne z jadem osy: punktowe (PTS) w stężeniu 100 µg/ml, których wynik był ujemny, oraz testy śródskórne (TŚ), których wyniki były dodatnie we wszystkich badanych stężeniach (tab. 1), bez klinicznych objawów niepożądanych w trakcie wykonywania testów. Podczas oceny sIgE we krwi, oznaczanych metodą ImmunoCAP, uzyskano dodatnie wyniki w klasie 3 i 4 zarówno dla ekstraktu jadu osy, jak i dla komponent alergenowych jadu osy Ves v 1 oraz Ves v 5. Wynik sIgE dla ekstraktu jadu pszczoły był ujemny. Podstawowe stężenie tryptazy mieściło się w zakresie dolnych przedziałów normy (N: 0,01–15 µg/l) (tab. 2). W badaniu spirometrycznym nie uzyskano wystarczającej współpracy ze strony dziecka.
Tabela 1
Wyniki testów punktowych i testów śródskórnych z jadem osy
Tabela 2
Wyniki badań immunologicznych
| Badanie | Wynik |
|---|---|
| sIgE jad pszczoły | 0,05 kU/l (kl. 0) |
| sIgE jad osy | 17,7 kU/l (kl. 4) |
| Ves v 1 | 34,3 kU/l (kl. 4) |
| Ves v 5 | 3,65 kU/l (kl. 3) |
| tryptaza | 3,10 ug/l |
U chłopca rozpoznano alergię na jad osy z reakcją systemową wykraczającą poza objawy skórne. Na podstawie kryteriów przyjętych przez międzynarodowe i krajowe wytyczne zakwalifikowano go do immunoterapii alergenowej (allergen immunotherapy – AIT) jadem osy [5, 6]. Chłopca kolejny raz hospitalizowano. Podczas tej hospitalizacji podstawowe badania laboratoryjne były prawidłowe, a PTS wykonane w dniu poprzedzającym immunoterapię wykazały uczulenie na alergeny roztoczy kurzu domowego.
W warunkach kontrolowanych rozpoczęto AIT nieoczyszczonym wodnym preparatem jadu osy (Pharmalgen jad osy) wg schematu bardzo szybkiego (ultrarush) (tab. 3). Po upływie 25 minut od podania czwartej dawki preparatu (po sumarycznej dawce 61 µg) wystąpiła pokrzywka zlokalizowana na twarzy, szyi i karku, bez innych odchyleń w badaniu fizykalnym. Parametry życiowe mieściły się w zakresie normy dla wieku (saturacja 97%, akcja serca 92/min, ciśnienie tętnicze 107/69 mm Hg). Chłopcu podano doustny lek AH1 w podwójnej dawce. Po kolejnych 10 minutach chłopiec zgłosił duszność, zmiany pokrzywkowe nasiliły się, wystąpił obrzęk naczynioruchowy okolicy szyi, pojawiła się chrypka, osłuchowo stwierdzono pojedyncze świsty nad polami płucnymi, ciśnienie tętnicze krwi obniżyło się, ale pozostawało w zakresie normy dla wieku [94/63 mm Hg; dla dziecka w wieku pomiędzy 1. a 10. rokiem życia granicą hipotensji jest wartość ciśnienia skurczowego obliczona wg wzoru: (70 + 2 × wiek w latach) mm Hg]. Chłopcu podano 0,2 mg adrenaliny i.m. oraz płyny i.v., uzyskując ustąpienie dolegliwości. Odstąpiono od kontynuacji AIT i podania kolejnej planowej dawki 40 µg jadu osy w tym dniu.
Tabela 3
Zrealizowane dawkowanie preparatu Pharmalgen jad osy wg protokołu bardzo szybkiego (ultrarush) immunoterapii, przed wystąpieniem anafilaksji
| Czas | Dawka jadu |
|---|---|
| 0’ | 1 µg |
| 30’ | 10 µg |
| 60’ | 20 µg |
| 90’ | 30 µg |
Po około 8 godzinach obserwacji stwierdzono nawrót dolegliwości w formie pokrzywki obejmującej twarz, szyję, kark i kończyny oraz kaszlu i obturacji oskrzeli. Parametry życiowe wynosiły: saturacja 92%, ciśnienie tętnicze 107/62 mm Hg, osłuchowo nad polami płucnymi stwierdzono świsty. Ponownie podano 0,2 mg adrenaliny i.m., płyny i.v., lek AH1 i glikokortykosteroid (GKS) doustnie, uzyskując poprawę ( ryc. 1 B). Nie zidentyfikowano kofaktorów reakcji w postaci infekcji, dużego wysiłku fizycznego lub nasilonego stresu.
Podczas kolejnej hospitalizacji na oddziale ponownie rozpoczęto AIT preparatem Pharmalgen jad osy wg zmodyfikowanego schematu szybkiego (rush) (tab. 4). Łącznie podano dawkę skumulowaną 131 µg jadu osy, nie odnotowując odczynów natychmiastowych. Po 6 godzinach od podania ostatniej dawki preparatu zaobserwowano łagodne zmiany pokrzywkowe, które ustąpiły po jednorazowym podaniu leku AH1 w standardowej dawce.
Tabela 4
Zmodyfikowany protokół szybki (rush) immunoterapii preparatem Pharmalgen jad osy, na podstawie którego kontynuowano immunoterapię po reakcji dwufazowej
| Dzień 1. | Dzień 2. | ||
|---|---|---|---|
| Czas | Dawka jadu | Czas | Dawka jadu |
| 0’ | 1 µg | 0’ | 10 µg |
| 30’ | 10 µg | 30’ | 20 µg |
| 60’ | 20 µg | 60’ | 30 µg |
| 120’ | 40 µg | ||
W trakcie kolejnych hospitalizacji kontynuowano AIT jadem osy w dawkach frakcjonowanych: 10 + 15 + 25 + 50 µg, początkowo preparatem wodnym (Pharmalgen), a następnie z uwagi na jego niedostępność preparatem depot (Alutard). Nie obserwowano odczynów natychmiastowych, AD nie powtórzyła się. Obecnie chłopiec pozostaje na etapie leczenia dawką podtrzymującą, nie wymaga frakcjonowania dawki, w trakcie AIT nie był żądlony.
Dyskusja
Do najczęstszych przyczyn anafilaksji u dzieci zalicza się pokarmy, jady owadów błonkoskrzydłych oraz leki, natomiast u dorosłych (kolejno od najczęstszych) leki, pokarmy i jady owadów [7]. Wśród anafilaksji z wszystkich przyczyn AD stanowi od 1% do 15% przypadków [8, 9]. Obserwowane różnice mogą wynikać ze sposobu zbierania danych (SOR vs inne oddziały lub placówki medyczne) lub mogą zależeć od charakterystyki demograficznej badanych kohort. Przykładowo: w badaniu obserwacyjnym analizującym dane z hospitalizacji w dziecięcych oddziałach ratunkowych w Japonii w latach 2010–2017 częstość AD była niska – u 1,7% (sześcioro dzieci spośród 353 dzieci z anafilaksją) wystąpiła reakcja dwufazowa, w tym u 0,3% reakcja ta była istotna klinicznie i wymagała podania adrenaliny [10]. Według danych duńskich oddziałów intensywnej terapii odsetek hospitalizowanych w nich pacjentów z AD był niski (nie przekraczał 4,8%), a ich przebieg był łagodny [11]. Natomiast według zapisów przyjęć z kanadyjskich pediatrycznych oddziałów SOR AD rozpoznano u 14,7% dzieci [9].
Podane wartości dotyczą anafilaksji ze wszystkich przyczyn. Mało jest prac odnoszących się stricte do częstości występowania AD wśród pacjentów z anafilaksją na jad owadów błonkoskrzydłych. Według autorów, którzy analizują to zjawisko w grupie chorych z anafilaksją na jad, dotyczy ono około 10% do 20% osób dorosłych i około 3% do 5% dzieci [12, 13]. Brakuje danych na temat częstości występowania AD w przebiegu AIT. Analizując zjawisko AD w przebiegu AIT podskórnej alergenem wziewnym, starsze prace podają, że jej częstość wynosi około 10%, a objawy na ogół są łagodne i samoograniczające się [14, 15]. Część badań wskazuje, że u chorych, u których immunoterapia prowadzona jest alergenem wziewnym z powodu objawów alergicznego nieżytu nosa, AD częściej dotyczy pacjentów z obniżonym szczytowym przepływem wydechowym (PEF) i współistniejącą astmą [15].
Objawy drugiej fazy AD mogą być podobne lub łagodniejsze niż w reakcji pierwszej fazy; mogą też różnić się pomiędzy obydwoma fazami [10]. W przedstawianym przypadku objawy drugiej fazy podczas pierwszego epizodu anafilaksji (po użądleniu polnym) miały łagodniejszy przebieg (pokrzywka) niż reakcja pierwszej fazy (anafilaksja) i wystąpiły w odstępie około 24 godzin. W przebiegu drugiego epizodu anafilaksji związanej z rozpoczęciem AIT jadem reakcja zarówno pierwszej fazy, jak i drugiej fazy miała charakter anafilaksji. Obie fazy wymagały interwencji z podaniem adrenaliny, a odstęp czasu pomiędzy nimi wyniósł około 8 godzin, mieszcząc się w zakresie obserwowanym też przez innych autorów [2, 3].
Z punktu widzenia lekarza praktyka niezmiernie istotną kwestią rzutującą na strategię postępowania z pacjentem jest znajomość czynników ryzyka występowania AD oraz czasu obserwacji po przebytej anafilaksji. Większość autorów wśród czynników ryzyka wystąpienia AD wymienia opóźnienie w podaniu adrenaliny (> 30–90 minut od początku reakcji), potrzebę podania więcej niż 1 dawki adrenaliny oraz anafilaksję wywołaną przez czynnik nieznany (idiopatyczną) [3, 9, 16, 17]. Na podstawie danych z Europejskiego Rejestru Anafilaksji w odniesieniu do wszystkich grup wiekowych wśród czynników ryzyka dla AD wymienia się dodatkowo: ciężkość reakcji pierwszej fazy, objawy z wielu układów, anafilaksję wywołaną orzechami drzew lub ziemnymi, anafilaksję powysiłkową, współistniejącą pokrzywkę przewlekłą, długi odstęp czasu między zadziałaniem czynnika a początkiem reakcji oraz leczeniem lekiem AH1 [8]. Inni badacze zidentyfikowali kilka dodatkowych niezależnych czynników predykcyjnych dla AD: wiek od 6 do 9 lat, opóźnienie zgłoszenia się na SOR dłuższe niż 90 minut od wystąpienia początkowych objawów, dużą amplitudę tętna podczas oceny klinicznej w triażu, konieczność podania wziewnych β-agonistów na SOR [9]. Część autorów podaje także związek pomiędzy podstawowym stężeniem tryptazy, astmą oraz utratą przytomności w przebiegu reakcji pierwotnej a wystąpieniem AD [18].
W codziennej praktyce klinicznej przeważa zbyt rzadkie stosowanie adrenaliny w leczeniu pierwotnej oraz dwufazowej anafilaksji i nadużywanie terapii drugiego rzutu, tj. leków AH1 i GKS, które nie chronią przed pogłębianiem się objawów systemowych reakcji [19]. Wczesna podaż adrenaliny może chronić przed rozwojem AD [9, 20]. Leki AH1 mają znaczenie jedynie w ograniczaniu objawów skórnych, takich jak pokrzywka, świąd i obrzęk. Zastosowanie GKS systemowych w anafilaksji budzi wiele kontrowersji – część wcześniejszych badań wskazywała na ich ochronny wpływ na rozwój AD. Obecne obserwacje są odmienne i sugerują, że GKS stosowane w leczeniu reakcji pierwotnej mogą zwiększać ryzyko wystąpienia AD, głównie wśród dzieci [21].
W przedstawionym opisie przypadku w leczeniu reakcji pierwotnej po użądleniu polnym zastosowano adrenalinę, lek AH1 i GKS systemowy, a w łagodniejszej reakcji drugiej fazy lek AH1 i GKS. Podczas drugiego epizodu AD związanego z AIT reakcja pierwotna wymagała interwencji z użyciem adrenaliny i leku AH1. Nie podawano GKS systemowych, a podczas reakcji drugiej fazy ponownie zastosowano adrenalinę, lek AH1 i GKS.
W analizie porównawczej wyników 31 570 japońskich pacjentów z anafilaksją, spośród których 89,2% było leczonych GKS systemowymi w dniu przyjęcia, ogólny odsetek reakcji dwufazowych w ciągu 7 dni od przyjęcia wyniósł 11,2%. Nie stwierdzono istotnej różnicy w częstości występowania AD pomiędzy pacjentami z anafilaksją leczonych GKS lub bez nich (10,7% vs 10,5%) [22].
Stąd obecnie nie zaleca się rutynowego podawania GKS systemowych w przebiegu anafilaksji, z wyjątkiem sytuacji, w których dochodzi do obrzęku gardła lub krtani albo obturacji oskrzeli [21].
Bardzo istotną kwestią w postępowaniu z pacjentem z anafilaksją jest czas obserwacji, którego optymalna wartość nie jest ściśle zdefiniowana [2]. Dane z metaanalizy 12 badań obejmujących chorych dorosłych (2890 z anafilaksją i 143 z AD) wskazują, że czas obserwacji wynoszący co najmniej 6 godzin od ustąpienia początkowych objawów anafilaksji pozwala wykluczyć nawrót objawów anafilaksji u ponad 95% pacjentów. Jednak dłuższy czas obserwacji, wynoszący zgodnie z obowiązującymi wytycznymi od 6 do 12 godzin, skutkował wykryciem jeszcze większej liczby reakcji dwufazowych [23]. Podany zakres czasu obserwacji jest wartością zalecaną, a nie obligatoryjną – w każdym przypadku decyzja dotycząca zwolnienia chorego z obserwacji szpitalnej powinna być indywidualna.
Zalecany obecnie czas obserwacji wynika z ciężkości anafilaksji, odpowiedzi na zastosowane leczenie, chorób współistniejących i wywiadu AD w przeszłości. Pacjenci z dobrą reakcją na pojedynczą dawkę adrenaliny, podanej do 30 min od pierwszych objawów anafilaksji, po całkowitym ustąpieniu objawów i przeszkoleniu w zakresie stosowania adrenaliny do samodzielnego podania mogą zostać wypisani z izby przyjęć lub SOR po 2 godzinach obserwacji [2, 19].
W przypadku konieczności podania 2 dawek adrenaliny lub wywiadu AD obserwacje powinno się wydłużyć do 6 godzin [2, 19]. Obserwacja trwająca co najmniej 12 godzin dotyczy chorych z ciężką anafilaksją, pacjentów wymagających podania więcej niż 2 dawek adrenaliny, chorych z ciężką astmą, pacjentów, w przypadku których jest możliwe przedłużone wchłanianie alergenu (np. leku), oraz pacjentów zamieszkałych w dużej odległości od placówek medycznych [19].
Wnioski
Wydaje się, że w dalszym ciągu AD jest słabo poznana i może być niedoszacowana w codziennej praktyce klinicznej. Bez względu na wiek pacjenta z anafilaksją po użądleniu nie należy zapominać o problemie AD. Wskazane jest uszczegółowienie wywiadu w tym kierunku, a jeśli wskazuje on na AD – monitorowanie pod kątem jej wystąpienia, podczas ekspozycji zarówno naturalnej (użądlenie polne), jak i leczniczej (AIT), z uwzględnieniem dłuższego okresu obserwacji. Przebycie w wywiadzie AD uzasadnia zaopatrzenie pacjenta w co najmniej dwa opakowania adrenaliny do samodzielnego podania.
Należy podkreślić konieczność szczegółowego dokumentowania stwierdzanych objawów, podanych leków oraz odpowiedzi na nie. Dokumentacja powinna być sporządzona na każdym etapie interwencji medycznej, a jej kopia przekazana pacjentowi lub jego rodzicom albo opiekunom. Brak szczegółowej dokumentacji źródłowej ze zdarzenia anafilaksji stanowi często utrudnienie w postępowaniu i w obiektywnej ocenie ciężkości zdarzenia na szczeblu specjalistycznym.







