Wyniki LUX – Lung 3 na ASCO 2012
W dniu 26. marca 2012 roku na stronach internetowych Lancet Oncology opublikowano 2 artykuły, przedstawiające wyniki badań klinicznych z cząsteczką BIBW 2992 (afatynib) u chorych z zaawansowanym rakiem płuca.
Cząsteczka BIBW 2992 (afatynib), opracowana przez naukowców w firmie Boehringer Ingelheim, jest nieodwracalnym inhibitorem, kowalentnie łączącym się z homo- i heterodimerami utworzonymi przez receptory z rodziny ErbB: EGFR (ErbB1), HER2 (ErbB2), ErbB3 i ErbB4. Obecnie znajduje się w szerokim programie badań klinicznych w różnych wskazaniach. Program badawczy LUX - Lung składa się z kilku badań prowadzonych u chorych z rakiem płuca. W badaniach przedklinicznych afatynib wykazał aktywność przeciwko komórkom raka płuca z obecnością mutacji w genie EGFR, zarówno aktywujących (L858R i delecje 19), jak i związanych z opornością na odwracalne inhibitory kinaz tyrozynowych EGFR (T790M). W prezentowanych artykułach opisano badania LUX - Lung 1 i LUX – Lung 2.
Yang J. i wsp. Afatinib for patients with lung adenocarcinoma and epidermal growth factor receptor mutations (LUX-Lung 2): phase 2 trial.
www.thelancet.com/oncology Published online March 26, 2012 DOI:10.1016/S1470-2045(12)70086-4
Miller V. i wsp. Afatinib versus placebo for patients with advanced, metastatic non-small-cell lung cancer after failure of erlotinib, gefi tinib, or both, and one or two lines of chemotherapy (LUX-Lung 1): a phase 2b/3 randomised trial.
www.thelancet.com/oncology Published online March 26, 2012 DOI:10.1016/S1470-2045(12)70087-6
Najważniejsze informacje dotyczące schematu obu badań i zastosowanych metod przedstawiono w Tab. 1.
Najważniejsze wyniki.
W badaniu LUX – Lung 1 mediana OS wyniosła 10,8 mies. (95% CI 10,0 – 12,0) w grupie z afatynibem i 12,0 mies. (95% CI 10,2 – 14,3) w grupie placebo (HR 1,08, 95% CI 0,86 – 1,35; p=0,74) (Ryc. 1). Mediana PFS była dłuższa w grupie z afatynibem (3,3 mies., 95% CI 2,79 – 4,40) niż w grupie placebo (1,1 mies., 95% CI 0,95 – 1,68; HR 0,38, 95% CI 0,31 – 0,48; p<0,0001) (Ryc. 2). Nie odnotowano całkowitej odpowiedzi, 29 (7%) chorych miało odpowiedź częściową w grupie z afatynibem a 1 chory w grupie placebo. Kolejne linie leczenia przeciwnowotworowego otrzymało 257 (68%) chorych w grupie z afatynibem i 153 (79%) w grupie placebo. Najczęstszym działaniem niepożądanym była biegunka 9339 [87%] z 390 chorych; 66 [17%] stopnia 3) oraz zmiany skórne (305 [78%] chorych; 56 [14%] stopnia 3). Zdarzenia te były mniej częstsze w grupie placebo (głównie stopnia 1 i 2). Ciężkie działania niepożądane związane z podawanym leczeniem obserwowano u 39 (10%) chorych w grupie z afatynibem i u 1 (<1%) chorego w grupie placebo. Odnotowano 2 przypadki zgonów, prawdopodobnie związanych ze stosowanym leczeniem w grupie z afatynibem.
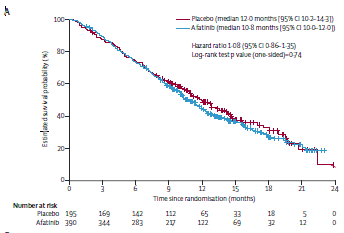
Ryc. 1. Krzywe Kaplana – Meiera dotyczące przeżycia całkowitego.

Ryc. 2. Krzywe Kaplana – Meiera dotyczące przeżycia wolnego od progresji choroby w ocenie niezależnej (A) i ocenie badaczy (B).
WNIOSKI AUTORÓW
Chociaż nie odnotowaliśmy korzyści w zakresie przeżycia całkowitego po afatynibie (co mogłoby wynikać z kolejnych linii leczenia przeciwnowotworowego, stosowanych w obu grupach), nasze wyniki dotyczące przeżycia wolnego od progresji choroby i odpowiedzi guza na leczenie sugerują, że zastosowanie afatynibu może przynieść korzyści u chorych z zaawansowanym gruczolakorakiem płuc, u których nie powiodła się stosowana wcześniej przez co najmniej 12 tygodni terapia inhibitorami kinaz tyrozynowych EGFR.
Najważniejsze wyniki.
W badaniu LUX – Lung 2 u 79 (61%) spośród 129 chorych stwierdzono obiektywną odpowiedź (2 odpowiedzi całkowite, 77 odpowiedzi częściowych). Odnotowano 70 (66%) obiektywnych odpowiedzi w grupie 106 chorych z najczęstszymi mutacjami aktywującymi genu EGFR (delecje 19 i L858R) oraz 9 (39%) wśród 23 chorych z mniej częstszymi rodzajami mutacji (Ryc. 1). Podobne odsetki odpowiedzi obserwowano, analizując chorych pod względem początkowej dawki afatynibu: 18 (60%) z 30 chorych otrzymujących 40 mg w porównaniu z 61 (62%) spośród 99 chorych otrzymujących 50 mg. Mediana przeżycia wolnego od progresji choroby (PFS) u wszystkich chorych wyniosła 10,1 mies. (Ryc. 2), a mediana przeżycia całkowitego (OS) u wszystkich chorych – 24,8 mies. (Ryc. 3). Spośród dwóch najczęstszych działań niepożądanych (biegunka i zmiany skórne), stopień 3 częściej obserwowano u chorych otrzymujących jako początkową dawkę 50 mg afatynibu (biegunka 22[22%] z 99 chorych; zmiany skórne 28 [28%] z 99 chorych) niż w grupie otrzymującej wyjściowo 40 mg (biegunka i zmiany skórne po 2 [7%] z 30 chorych). Ciężkie działania niepożądane prawdopodobnie związane z podawanym leczeniem były mniej częste u chorych otrzymujących dawkę 40 mg afatynibu (2 z 30 w porównaniu z 14 z 99 chorych). Odnotowano 1 przypadek zgon, prawdopodobnie związany ze stosowanym leczeniem (śródmiąższowa choroba płuc).

Ryc. 1. Wykres „waterfall” przedstawiający odpowiedzi na leczenie u wszystkich chorych (A), chorych z delecją w eksonie 19 (B), chorych z mutacją L858R (C) oraz u chorych z innymi mutacjami (D).

Ryc. 2. Krzywe Kaplana - Meiera dla PFS w całej grupie chorych (A), w zależności od linii leczenia (B) oraz u chorych otrzymujących afatynib w pierwszej (C) i drugiej (D) linii terapeutycznej w zależności od typu mutacji EGFR.

Ryc. 3. Krzywe Kaplana - Meiera dla OS w całej grupie chorych (A), w zależności od linii leczenia (B) oraz u chorych otrzymujących afatynib w pierwszej (C) i drugiej (D) linii terapeutycznej w zależności od typu mutacji EGFR.
WNIOSKI AUTORÓW
Afatynib wykazuje aktywność w leczeniu chorych z zaawansowanym gruczolakorakiem płuc z obecnością mutacji EGFR, szczególnie w grupie chorych z delecją w eksonie 19 i mutacją L858R. Skuteczność afatynibu w dawce 40 mg powinna zostać porównana z chemioterapią lub innymi inhibitorami kinazy tyrozynowej EGFR u chorych z NDRP z obecnością mutacji EGFR.
Obie cytowane powyżej prace zostały opatrzone artykułem wstępnym autorstwa Freda R. Hirscha i Paula A. Bunn Jr z Uniwersytetu Colorado, USA
www.thelancet.com/oncology Published online March 26, 2012 DOI:10.1016/S1470-2045(12)70124-9
Autorzy poterdzają skutecznośc biologiczną afatynibu, choć jasno precyzują swoje wątpliwości oraz wskazują dalsze, możliwe kierunki rozwoju leku i stawiają pytania na przyszłość.
Sporo odpowiedzi powinny dostarczyć dane, które zostaną zaprezentowane na tegorocznym kongresie ASCO w Chicago w czerwcu 2012 roku. W szczególności oczekiwane sa wyniki kolejnego badania z programu – LUX – Lung 3, w kltórym porównano skuteczność afatyniby i chemioterapii u chorych z zaawansowanym rakiem płuca z obecnościa mtacji w genie EGFR.
Opracował
Dr n. med.Dariusz Stencel
Senior Medical Affairs Manager
Boehringer Ingelheim
Yang J. i wsp. Afatinib for patients with lung adenocarcinoma and epidermal growth factor receptor mutations (LUX-Lung 2): phase 2 trial.
www.thelancet.com/oncology Published online March 26, 2012 DOI:10.1016/S1470-2045(12)70086-4
Miller V. i wsp. Afatinib versus placebo for patients with advanced, metastatic non-small-cell lung cancer after failure of erlotinib, gefi tinib, or both, and one or two lines of chemotherapy (LUX-Lung 1): a phase 2b/3 randomised trial.
www.thelancet.com/oncology Published online March 26, 2012 DOI:10.1016/S1470-2045(12)70087-6
Najważniejsze informacje dotyczące schematu obu badań i zastosowanych metod przedstawiono w Tab. 1.
| Lux – Lung 1 | LUX – Lung 2 | |
| Schemat badania | Randomizowane, podwójnie zaślepione, wieloośrodkowe | Jednoramienne |
| Faza | 2b/3 | 2 |
| Kraje uczestniczące | Chiny, Hong Kong, Korea, Singapur, Taiwan, Tajlandia, Belgia, Niemcy, Francja, Włochy, Holandia, UK, Hiszpania, Kanada, USA | Taiwan, USA |
| Główne kryteria włączenia | Adenocarcinoma płuc IIIB lub IV z obecnością choroby mierzalnej; niepowodzenie 1 lub 2 wcześniejszych linii terapii, w tym terapii adjuwantowej; progresja choroby po co najmniej 12 tygodniowym okresie leczenia erlotynibem lub gefitynibem; ECOG 0-2; | Adenocarcinoma płuc IIIB lub IV z obecnością choroby mierzalnej; ECOG 0-2; chorzy uprzednio nieleczeni lub po co najwyżej jednej linii chemioterapii |
| Główne kryteria wykluczenia | Aktywne przerzuty do OUN; ciąża; choroby serca; ciężkie choroby gastroenterologiczne; ciężkie zakażenia; nieprawidłowości wątroby, nerek, krwiotwórcze. | Wcześniejsze leczenie (chemioterapia, radioterapia, hormonoterapia, immunoterapia, inhibitory EGFR) w okresie 4 tygodnie (RT-2) przed badaniem; niestabilne przerzuty do OUN; choroby serca; ciężkie choroby gastroenterologiczne z biegunką jako główny objaw; ciężkie aktywne zakażenia; nieprawidłowości wątroby, nerek, krwiotwórcze. |
| Ocena mutacji EGFR | Bez konieczności; stwierdzona obecność mutacji EGFR u 68% chorych (67% w grupie z afatynibem, 71% w grupie placebo). | Obecność mutacji aktywujących w eksonach 18-21 genu EGFR (sekwencjonowanie DNA). |
| Ramię aktywne | Afatynib 50 mg raz na dobę doustnie (do progresji choroby lub nieakceptowalnej toksyczności) + BSC | Afatynib 50 mg (po aktualizacji protokołu – 40 mg) raz na dobę doustnie (do progresji choroby lub nieakceptowalnej toksyczności) |
| Ramię kontrolne | Placebo + BSC | NA |
| Pierwszorzędowy punkt końcowy | OS (ITT) | ORR (RECIST) |
| Drugorzędowe punkty końcowe | PFS; ORR; czas trwania odpowiedzi; bezpieczeństwo, QoL | % chorych z DCR; czas do uzyskania OR; czas trwania OR; zmniejszenie się guza, OS, PFS |
| Liczba włączonych chorych | 585 (afatynib n=390; placebo n=195) | 129 (1. linia n=61; 2. linia n=68) |
| Numer w bazie ClinicalTrials.gov | NCT00656136 | NCT00525148 |
Najważniejsze wyniki.
W badaniu LUX – Lung 1 mediana OS wyniosła 10,8 mies. (95% CI 10,0 – 12,0) w grupie z afatynibem i 12,0 mies. (95% CI 10,2 – 14,3) w grupie placebo (HR 1,08, 95% CI 0,86 – 1,35; p=0,74) (Ryc. 1). Mediana PFS była dłuższa w grupie z afatynibem (3,3 mies., 95% CI 2,79 – 4,40) niż w grupie placebo (1,1 mies., 95% CI 0,95 – 1,68; HR 0,38, 95% CI 0,31 – 0,48; p<0,0001) (Ryc. 2). Nie odnotowano całkowitej odpowiedzi, 29 (7%) chorych miało odpowiedź częściową w grupie z afatynibem a 1 chory w grupie placebo. Kolejne linie leczenia przeciwnowotworowego otrzymało 257 (68%) chorych w grupie z afatynibem i 153 (79%) w grupie placebo. Najczęstszym działaniem niepożądanym była biegunka 9339 [87%] z 390 chorych; 66 [17%] stopnia 3) oraz zmiany skórne (305 [78%] chorych; 56 [14%] stopnia 3). Zdarzenia te były mniej częstsze w grupie placebo (głównie stopnia 1 i 2). Ciężkie działania niepożądane związane z podawanym leczeniem obserwowano u 39 (10%) chorych w grupie z afatynibem i u 1 (<1%) chorego w grupie placebo. Odnotowano 2 przypadki zgonów, prawdopodobnie związanych ze stosowanym leczeniem w grupie z afatynibem.

Ryc. 1. Krzywe Kaplana – Meiera dotyczące przeżycia całkowitego.

Ryc. 2. Krzywe Kaplana – Meiera dotyczące przeżycia wolnego od progresji choroby w ocenie niezależnej (A) i ocenie badaczy (B).
WNIOSKI AUTORÓW
Chociaż nie odnotowaliśmy korzyści w zakresie przeżycia całkowitego po afatynibie (co mogłoby wynikać z kolejnych linii leczenia przeciwnowotworowego, stosowanych w obu grupach), nasze wyniki dotyczące przeżycia wolnego od progresji choroby i odpowiedzi guza na leczenie sugerują, że zastosowanie afatynibu może przynieść korzyści u chorych z zaawansowanym gruczolakorakiem płuc, u których nie powiodła się stosowana wcześniej przez co najmniej 12 tygodni terapia inhibitorami kinaz tyrozynowych EGFR.
Najważniejsze wyniki.
W badaniu LUX – Lung 2 u 79 (61%) spośród 129 chorych stwierdzono obiektywną odpowiedź (2 odpowiedzi całkowite, 77 odpowiedzi częściowych). Odnotowano 70 (66%) obiektywnych odpowiedzi w grupie 106 chorych z najczęstszymi mutacjami aktywującymi genu EGFR (delecje 19 i L858R) oraz 9 (39%) wśród 23 chorych z mniej częstszymi rodzajami mutacji (Ryc. 1). Podobne odsetki odpowiedzi obserwowano, analizując chorych pod względem początkowej dawki afatynibu: 18 (60%) z 30 chorych otrzymujących 40 mg w porównaniu z 61 (62%) spośród 99 chorych otrzymujących 50 mg. Mediana przeżycia wolnego od progresji choroby (PFS) u wszystkich chorych wyniosła 10,1 mies. (Ryc. 2), a mediana przeżycia całkowitego (OS) u wszystkich chorych – 24,8 mies. (Ryc. 3). Spośród dwóch najczęstszych działań niepożądanych (biegunka i zmiany skórne), stopień 3 częściej obserwowano u chorych otrzymujących jako początkową dawkę 50 mg afatynibu (biegunka 22[22%] z 99 chorych; zmiany skórne 28 [28%] z 99 chorych) niż w grupie otrzymującej wyjściowo 40 mg (biegunka i zmiany skórne po 2 [7%] z 30 chorych). Ciężkie działania niepożądane prawdopodobnie związane z podawanym leczeniem były mniej częste u chorych otrzymujących dawkę 40 mg afatynibu (2 z 30 w porównaniu z 14 z 99 chorych). Odnotowano 1 przypadek zgon, prawdopodobnie związany ze stosowanym leczeniem (śródmiąższowa choroba płuc).

Ryc. 1. Wykres „waterfall” przedstawiający odpowiedzi na leczenie u wszystkich chorych (A), chorych z delecją w eksonie 19 (B), chorych z mutacją L858R (C) oraz u chorych z innymi mutacjami (D).

Ryc. 2. Krzywe Kaplana - Meiera dla PFS w całej grupie chorych (A), w zależności od linii leczenia (B) oraz u chorych otrzymujących afatynib w pierwszej (C) i drugiej (D) linii terapeutycznej w zależności od typu mutacji EGFR.

Ryc. 3. Krzywe Kaplana - Meiera dla OS w całej grupie chorych (A), w zależności od linii leczenia (B) oraz u chorych otrzymujących afatynib w pierwszej (C) i drugiej (D) linii terapeutycznej w zależności od typu mutacji EGFR.
WNIOSKI AUTORÓW
Afatynib wykazuje aktywność w leczeniu chorych z zaawansowanym gruczolakorakiem płuc z obecnością mutacji EGFR, szczególnie w grupie chorych z delecją w eksonie 19 i mutacją L858R. Skuteczność afatynibu w dawce 40 mg powinna zostać porównana z chemioterapią lub innymi inhibitorami kinazy tyrozynowej EGFR u chorych z NDRP z obecnością mutacji EGFR.
Obie cytowane powyżej prace zostały opatrzone artykułem wstępnym autorstwa Freda R. Hirscha i Paula A. Bunn Jr z Uniwersytetu Colorado, USA
www.thelancet.com/oncology Published online March 26, 2012 DOI:10.1016/S1470-2045(12)70124-9
Autorzy poterdzają skutecznośc biologiczną afatynibu, choć jasno precyzują swoje wątpliwości oraz wskazują dalsze, możliwe kierunki rozwoju leku i stawiają pytania na przyszłość.
Sporo odpowiedzi powinny dostarczyć dane, które zostaną zaprezentowane na tegorocznym kongresie ASCO w Chicago w czerwcu 2012 roku. W szczególności oczekiwane sa wyniki kolejnego badania z programu – LUX – Lung 3, w kltórym porównano skuteczność afatyniby i chemioterapii u chorych z zaawansowanym rakiem płuca z obecnościa mtacji w genie EGFR.
Opracował
Dr n. med.Dariusz Stencel
Senior Medical Affairs Manager
Boehringer Ingelheim
Kategorie:
Płuco i opłucna