Naczyniaki niemowląt (wczesnodziecięce)

Na przestrzeni ostatniego dziesięciolecia nastąpił ogromny rozwój wiedzy w dziedzinie naczyniaków niemowląt. Lepiej poznano patofizjologię tej jednostki chorobowej, zdefiniowano nowe czynniki ryzyka i opisano różne postacie kliniczne naczyniaków niemowląt.
Autorzy:
Marta Kurzeja1, Katarzyna Pawlik1, Agnieszka Sienicka1, Małgorzata Olszewska1, Lidia Rudnicka1
1Klinika Dermatologii Warszawskiego Uniwersytetu Medycznego
Wprowadzenie
Naczyniaki wczesnodziecięce (infantile hemangiomas – IHs) są najczęstszymi niezłośliwymi nowotworami naczyń krwionośnych występującymi w wieku dziecięcym [1]. Naczyniaki niemowląt zazwyczaj nie są widoczne po porodzie, w większości przypadków pojawiają się w czasie 1–2 tygodni po urodzeniu. Rozwój naczyniaków niemowląt można podzielić na 3 fazy: faza szybkiego wzrostu (wzrostu), faza plateau i faza inwolucji [2, 3]. Klasyfikacja kliniczna IHs opiera się na głębokości (powierzchowne, mieszane i głębokie) oraz rozległości zajęcia skóry (ogniskowe, wieloogniskowe, segmentarne, pośrednie). Większość ma przebieg samoograniczający się i nie wymaga leczenia. W niektórych jednak przypadkach mogą wiązać się z występowaniem powikłań, do których należą: owrzodzenie, niedrożność dróg oddechowych, upośledzenie czynnościowe; lub oszpeceniem; obniżają też jakość życia. U takich pacjentów lekiem pierwszego rzutu jest propranolol [4].
Epidemiologia i czynniki ryzyka
Naczyniaki wczesnodziecięce są najczęstszymi nowotworami naczyń krwionośnych w wieku dziecięcym. Częstość występowania IHs wynosi 4–5 proc., ale u wcześniaków może sięgać nawet 20 proc. [5]. IHs pojawiają się częściej u niemowląt rasy białej oraz 2–3-krotnie częściej u dziewczynek niż chłopców [6, 7]. Istnieje także związek między częstością naczyniaków niemowląt i niską masą urodzeniową (naczyniaki mogą dotyczyć nawet 30 proc. niemowląt o masie < 1 kg przy urodzeniu). Na podstawie dostępnych doniesień stwierdzono również, że u wcześniaków z IHs częściej rozwijają się owrzodzenia niż u niemowląt urodzonych o czasie [8, 9]. Ponadto IHs częściej występują u niemowląt z ciąż mnogich. Wśród innych prenatalnych czynników ryzyka należy wymienić: starszy wiek matki, palenie papierosów przez matkę, zapłodnienie in vitro, krwawienie z dróg rodnych w pierwszym trymestrze ciąży, łożysko przodujące, stan przedrzucawkowy i obciążony wywiad rodzinny w kierunku IHs [1, 6, 10].
Patogeneza
Patogeneza naczyniaków wczesnodziecięcych nie została w pełni wyjaśniona. W piśmiennictwie wysunięto kilka hipotez dotyczących czynników patogenetycznych tego schorzenia. Aktualnie dostępne dane naukowe wskazują, że u podłoża naczyniaków leży klonalna proliferacja komórek progenitorowych śródbłonka wewnętrznego lub angioblastów pochodzenia łożyskowego [11–13]. Wydaje się, że proliferacja IHs jest skutkiem zaburzenia równowagi pomiędzy pozytywnymi i negatywnymi czynnikami naczyniotwórczymi ulegającymi ekspresji w naczyniaku i otaczającej zdrowej tkance [14–16].
Z obserwacji klinicznych wynika, że kluczową rolę w patogenezie naczyniaków niemowląt może odgrywać niedotlenienie tkanek [17, 18]. Teorię tę potwierdzają wyniki badań molekularnych, m.in. wzmożona ekspresja czynników indukowanych niedotlenieniem: czynnika 1α, naczyniowo-śródbłonkowego czynnika wzrostu (vascular endothelial growth factor – VEGF), transportera glukozy 1 (glucose transporter isoform 1 – GLUT-1) oraz insulinopodobnego czynnika wzrostu 2 (insulin-like growth factor-2 – IGF-2) [16].
Wykazano, że GLUT-1 jest wysoce swoistym markerem, który w przeciwieństwie do innych malformacji naczyniowych oraz prawidłowej skóry i tkanki podskórnej ulega ekspresji w komórkach śródbłonka naczyniaków niemowląt zarówno w fazie proliferacji, jak i inwolucji [19]. Wskazuje się ponadto, że synteza GLUT-1 jest indukowana przez niedotlenienie, a ekspresja GLUT-1 na powierzchni komórek podobnych do śródbłonka pochodzących z monocytów ulega wzmocnieniu wskutek niedotlenienia [20].
Wiele czynników ryzyka naczyniaków niemowląt, m.in. poród przedwczesny, niska masa urodzeniowa i stan przedrzucawkowy, wiąże się z niedotlenieniem. Ponadto stwierdzono, że czynnikiem inicjującym rozwój naczyniaków może być niedotlenienie in utero, a także niedotlenienie miejscowe. Uważa się, że faza proliferacji stanowi próbę utrzymania homeostazy i normalizacji stężenia tlenu w tkankach [21].
Ze względu na ekspresję markerów łożyskowych: GLUT-1, receptora γFC, merozyny, antygenu Lewis Y i dejodynazy jodotyroninowej typu 3, wysunięto także hipotezę o pochodzeniu embrionalnym naczyniaków. Ponadto w IHs wykazano obecność swoistych cząsteczek charakterystycznych dla komórek rdzenia mezenchymalnego kosmówki łożyska (ludzkiej gonadotropiny kosmówkowej β i ludzkiego laktogenu łożyskowego). Na tej podstawie zaproponowano hipotezę, według której IHs wywodzą się z komórek rdzenia mezenchymalnego kosmówki ulegających embolizacji we wczesnym okresie życia płodowego [19, 22, 23].
Wykazano, że układ renina–angiotensyna (renin--angiotensin system – RAS) odgrywa istotną rolę w proliferacji komórek śródbłonka w naczyniakach niemowląt. Zaobserwowano, że komórki śródbłonka naczyniaków w fazie proliferacji wykazują ekspresję enzymu konwertującego angiotensynę (angiotensin converting enzyme – ACE) i receptora angiotensyny II, które są komponentami RAS [24]. Uważa się, że wysokie stężenie angiotensyny II (ATII) wraz z VEGF nasila proliferację komórek. Na potwierdzenie tej teorii wskazywano, że stężenie reniny w surowicy jest znacznie podwyższone w czasie pierwszych 3 miesięcy życia i stopniowo zmniejsza się w sposób odpowiadający naturalnemu wzorcowi rozwoju naczyniaków niemowląt [25]. Ponadto podwyższone stężenie reniny wykryto w grupach uznawanych za szczególnie narażone na występowanie IHs, tj. u niemowląt rasy białej, u płci żeńskiej, a także urodzonych przedwcześnie [26, 27].
Obraz kliniczny
W rozwoju naczyniaków niemowląt można wyróżnić trzy charakterystyczne fazy: proliferacji, plateau i inwolucji. U większości noworodków naczyniaki nie są obecne przy urodzeniu i pojawiają się dopiero w czasie kilku pierwszych tygodni życia. W niektórych przypadkach po porodzie u dziecka widoczna jest zmiana prekursorowa w postaci zbielenia związanego z wazokonstrykcją, zmiany przypominającej krwiaka lub jasnoczerwonej plamy z teleangiektazjami. Faza proliferacji rozpoczyna się po okresie utajenia trwającym około 1–3 tygodni i trwa 3–5 miesięcy, tempo rozwoju zmiany jest najszybsze między 5. i 8. tygodniem życia [28–32]. W późniejszym okresie faza proliferacji przebiega wolniej, naczyniak rozwija się do wieku 9–12 miesięcy, ale w pojedynczych przypadkach proces ten może trwać nawet powyżej 36. miesiąca życia. Dłuższa faza proliferacyjna częściej dotyczy IHs umiejscowionych w obrębie głowy i szyi, zwłaszcza na czubku nosa, w okolicy oczu, ust i uszu, a także dużych, segmentarnych i/lub głębokich naczyniaków [2, 28–32]. Po fazie proliferacji następuje faza plateau, a następnie faza samoistnej inwolucji. W tym czasie IHs ulegają w większości przypadków prawie calkowitemu zanikowi. Faza inwolucji rozpoczyna się zwykle po upływie roku i może mieć zróżnicowany czas trwania. W około 90 proc. IHs etap inwolucji kończy się przez 4. rokiem życia, w większości przypadków nie obserwuje się znaczącej poprawy po 3. roku życia [32, 33]. Naczyniaki głębokie zazwyczaj wchodzą w fazę inwolucji później niż naczyniaki powierzchowne [34]. U 69 proc. pacjentów nawet po fazie inwolucji obserwowane są zmiany resztkowe, m.in. teleangiektazje, nadmierna objętość tkanki włóknistej oraz wiotkość skóry spowodowana utratą tkanki elastycznej [31, 32].
IHs są klasyfikowane w zależności od głębokości naciekania na powierzchowne, mieszane i głębokie. Powierzchowne naczyniaki niemowląt są umiejscowione w warstwie powierzchownej skóry właściwej. W obrazie klinicznym mają postać płaskich guzków o budowie zrazikowej. Powierzchowne naczyniaki niemowląt wcześniej określane były jako „naczyniaki truskawkowe” lub „naczyniaki kapilarne”, są najczęstsze [30, 31, 34, 35]. Głębokie naczyniaki niemowląt rozwijają się w dolnej części skóry właściwej i/lub w tkance podskórnej i mają postać guzków w kolorze skóry lub w kolorze jasnoniebieskim. Wcześniej zmiany te określano jako „naczyniaki jamiste”(obecnie malformacje żylne). Naczyniaki mieszane skóry właściwej i tkanki podskórnej mają cechy kliniczne zarówno powierzchownych, jak i głębokich IHs [34, 35].
Inna klasyfikacja IHs opiera się na rozległości naczyniaka i obejmuje naczyniaki ogniskowe, segmentarne, wieloogniskowe i nieokreślone [36]. Ogniskowe naczyniaki niemowląt mają postać wyraźnie odgraniczonych, pojedynczych zmian umiejscowionych w obrębie jednego obszaru anatomicznego. Naczyniaki segmentarne mają ksztalt linijny i są bardziej rozległe. Wydaje się, że lokalizacja naczyniaków ma związek z rozwojem embrionalnym bądź znajduje się w obszarze zaopatrywanym przez tętnice embrionalne, naczyniaki nie zajmują zazwyczaj dermatomów lub nie są zlokalizowane wzdłuż linii Blashko. Naczyniaki segmentarne występują częściej u niemowląt płci żeńskiej [36, 37]. Ponadto naczyniaki segmentarne częściej wymagają intensywnej i przewlekłej terapii [36, 38]. Naczniaki segmentarne umiejscowione na twarzy lub w okolicy lędźwiowo-krzyżowej mogą być składową zespołów PHACE ((P)osterior fossa and other structural brain malformations; large (H)emangiomas of the face, neck, and/or scalp; anatomical anomalies of the cerebral or cervical (A)rteries; (C)ardiac anomalies/(C)oarctation of the aorta; and (E)ye abnormalities) i LUMBAR ((L)ower body congenital infantile hemangiomas and other skin defects; (U)rogenital anomalies and ulceration; (M)yelopathy; (B)ony deformities; (A)norectal malformations and arterial anomalies; and (R)ectal anomalies). Mnogie naczyniaki niemowląt, definiowane jako obecność ponad 5, a według innych publikacji ponad 10 zmian, dotyczą nawet 20 proc. niemowląt [29]. Występują częściej u dzieci z ciąż mnogich. Mnogie naczyniaki niemowląt wiążą się ze zwiększonym ryzykiem zmian narządowych, głównie w obrębie przewodu pokarmowego i wątroby [33]. Naczyniaki niemowląt, które nie spełniają kryteriów żadnej z tych kategorii, mogą być oznaczone jako nieokreślone [31].
Powikłania
Większość naczyniaków wczesnodziecięcych nie wywołuje powikłań i nie wymaga żadnej interwencji.
Najczęstszym powikłaniem jest owrzodzenie, które występuje u 16–23 proc. pacjentów, najczęściej między 4. i 8. miesiącem życia. Wczesnym objawem rozwijającego się owrzodzenia są odbarwienia widoczne na brzegach zmiany. Wyższe ryzyko owrzodzeń występuje w przypadku dużych powierzchownych i segmentarnych naczyniaków niż w przypadku innych typów. Oprócz tego zwiększone prawdopodobieństwo owrzodzenia obserwowane jest w obrębie naczyniaków umiejscowionych na dolnej wardze, szyi i w okolicy anogenitalnej [30, 31]. Owrzodzenie może powodować krwawienie (41 proc.) lub zakażenie (16 proc.) oraz bolesność. W niemal we wszystkich przypadkach owrzodzenie wiąże się z powstaniem blizny [4, 8, 39].
Naczyniaki niemowląt umiejscowione na powiece lub w pobliżu oka mogą powodować upośledzenie widzenia w fazie proliferacji, co może prowadzić do trwałego niedowidzenia, astygmatyzmu, zeza, przesunięcia do przodu gałek ocznych (proptozy), niedomykalności powiek, a nawet uszkodzenia nerwu wzrokowego. IHs zlokalizowane w okolicy przedusznej, na skórze żuchwy, na wardze dolnej, brodzie i przedniej powierzchni szyi mogą być związane z obecnością IHs w drogach oddechowych. To może prowadzić do zagrażającej życiu niedrożności górnych dróg oddechowych. IHs rozwijające się w zewnętrznym przewodzie słuchowym stwarzają ryzyko niedosłuchu przewodzeniowego [40, 41].
Naczyniaki niemowląt umiejscowione w środkowej części twarzy lub w okolicy ślinianek przyusznych, a także rozległe naczyniaki na klatce piersiowej powodują problemy estetyczne. IHs rozwijające się na nosie i wardze często wykazują niepełną samoistną regresję. Naczyniaki podskórne zlokalizowane w okolicy ślinianek przyusznych utrzymują się dłużej niż inne rodzaje naczyniaków [30, 31, 40, 41].
Mnogie naczyniaki niemowląt mogą wiązać się z występowaniem naczyniaków wątroby. Istnieje również ryzyko rozwoju niedoczynności tarczycy związanej z ekspresją dejodynazy jodotyroninowej u pacjentów z rozległymi naczyniakami oraz naczyniakami wieloogniskowymi. U dzieci z rozległymi naczyniakami zlokalizowanymi w obrębie skóry, jak również z rozsianymi naczyniakami wątroby może występować niewydolność serca ze zwiększoną pojemnością minutową [30, 31]. Czynniki ryzyka wpływające na rozwój powikłań zestawiono w tabeli I.
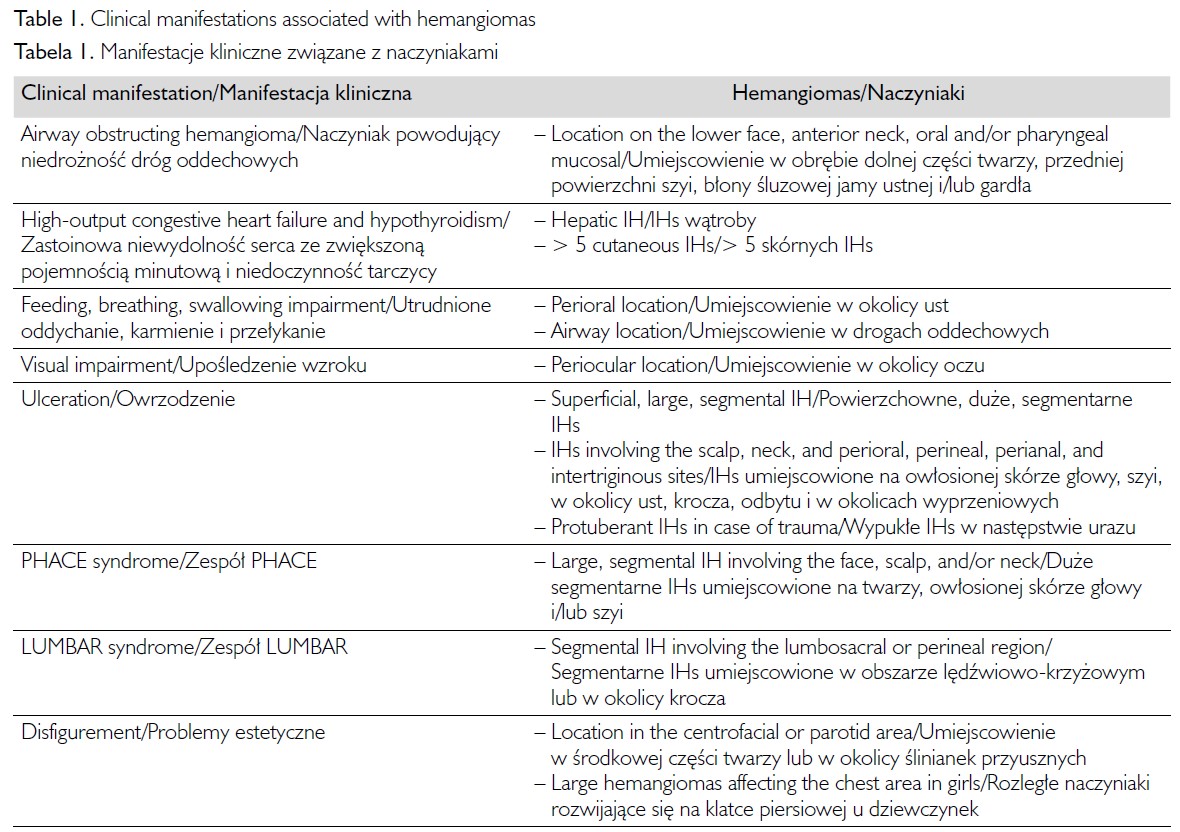
Rozpoznanie
W większości przypadków rozpoznanie opiera się na obrazie klinicznym [30, 39]. Badania obrazowe należy wykonywać wyłącznie wówczas, gdy rozpoznanie IHs jest niepewne lub gdy mogą występować nieprawidłowości anatomiczne. U niemowląt, u których występuje ≥ 5 naczyniaków w obrębie skóry, zaleca się wykonanie USG jamy brzusznej ze względu na zwiększone ryzyko występowania naczyniaków trzewnych, głównie wątroby [40]. W przypadku podejrzenia zespołu PHACE zaleca się wykonanie badania MRI głowy i szyi. Gdy u pacjenta podejrzewa się zespół LUMBAR, wskazane jest badanie MRI kręgosłupa i miednicy [30].
Diagnostyka różnicowa
W diagnostyce różnicowej należy uwzględnić przede wszystkim nieprawidłowości naczyń, naczyniaki wrodzone, ziarniniaki naczyniowe oraz naczyniakośródbłoniaki o typie mięsaka Kaposiego (Kaposiform hemangioendothelioma) [30, 42–44].
Nieprawidłowości naczyniowe dzielą się na malformacje naczyniowe oraz guzy naczyniowe. Malformacje naczyniowe są obecne przy urodzeniu, rosną proporcjonalnie do wzrostu dziecka i nigdy nie ustępują samoistnie [30, 45]. Natomiast guzy naczyniowe mogą, choć nie muszą, być obecne przy urodzeniu i mają tendencję do rozrostu. W przypadku powiększającego się guza u noworodka, jeśli rozpoznanie naczyniaka wczesnodziecięcego jest niepewne na podstawie obrazu klinicznego, należy wykonać biopsję do badania histologicznego [30, 44].
Naczyniaki wrodzone przypominają naczyniaki niemowląt, jednak są obecne przy urodzeniu i nie wykazują ekspresji GLUT1, czyli immunohistologicznego wskaźnika IHs. Według klasycznego podziału naczyniaków wrodzonych wyróżnia się typ szybko zanikający (rapidly involuting congenital haemangioma – RICH), niezanikający (non-involuting congenital haemangioma – NICH) i częściowo zanikający (partially involuting congenital hemangiomas – PICH). Naczyniaki typu RICH osiągają swoje maksymalne rozmiary przed urodzeniem lub przy urodzeniu. Oprócz tego naczyniaki RICH mogą wywoływać niewydolność serca ze zwiększoną pojemnością minutową, a także przejściową małopłytkowość. Zmiany tego rodzaju wcześnie wchodzą w fazę regresji, która w większości przypadków kończy się w ciągu roku. Naczyniaki typu NICH nie wykazują oznak regresji. Leczenie naczyniaków wrodzonych jest konieczne wyłącznie ze względów estetycznych [30, 31].
Ziarniniak naczyniowy (pyogenic granuloma – PG) jest powszechnie występującym guzem naczyniowym o charakterze nabytym. Częstość występowania PG jest oceniana na 0,5–1,0%. U niemowląt odsetek ten wynosi około 12%, a większość przypadków stwierdza się poniżej 4. miesiąca życia. Ziarniniaki naczyniowe zazwyczaj rozwijają się w miejscu drobnego urazu jako egzofityczne guzki o średnicy od 1 do 10 mm. Większość PG jest zlokalizowanych na twarzy oraz szyi, często krwawi [30, 43].
Naczyniakośródbłoniak o typie mięsaka Kaposiego (Kaposiform hemangioendothelioma) jest rzadkim guzem naczyniowym, którego częstość występowania określa się jako 0,9 przypadka na 100 000 pacjentów. Najczęściej pojawia się w czasie pierwszych 2 lat życia, u 60 proc. pacjentów w okresie noworodkowym. W obrazie klinicznym Kaposiform hemangioendothelioma może być widoczny w postaci guzka zlokalizowanego powierzchownie lub rozległego słabo odgraniczonego guza położonego głęboko w tkankach miękkich [30]. Kaposiform hemangioendothelioma może współwystępować z zespołem Kasabacha-Merritt, w którym dochodzi do nasilonej trombocytopenii w następstwie rozsianej koagulopatii. Leczeniem pierwszego wyboru jest winkrystyna, ale u pacjentów z Kaposiform hemangioendothelioma można także stosować sirolimus [2, 30].
Leczenie
Większość naczyniaków niemowląt nie wywołuje powikłań, w związku z tym leczenie nie jest konieczne. Tylko 10–20 proc. IHs wymaga terapii z powodu powikłań [40]. Każdy wzrost wielkości zmiany o 10 cm2 oznacza zwiększenie o 4,0 proc. prawdopodobieństwa, że pacjent będzie wymagać leczenia, oraz podwyższa o 5,0 proc. ryzyko wystąpienia powikłań [4]. Wskazania do leczenia obejmują naczyniaki niemowląt, które zagrażają życiu (IHs umiejscowione w okolicy podgłośniowej; powodujące ucisk struktur nerwowych; naczyniaki krwawiące w obrębie przewodu pokarmowego; IHs powodujące niewydolność serca lub upośledzenie czynności wątroby), naczyniaki wczesnodziecięce powodujące zaburzenia czynnościowe (IHs w okolicy okołogałkowej; wywołujące niedrożność, zwłaszcza nosa lub przewodu słuchowego zewnętrznego; wrzodziejące), oraz naczyniaki wczesnodziecięce powodujące problem estetyczny (guzy twarzy, głównie umiejscowione na nosie, wargach lub w okolicy przedusznej oraz rozległe naczyniaki na klatce piersiowej) [46].
Dzieci z naczyniakiem wymagającym leczenia powinny być kierowane w pierwszych 5 tygodniach życia do specjalisty w dziedzinie nieprawidłowości naczyniowych [47]. Podczas podejmowania decyzji o ewentualnym kierowaniu pacjentów do ośrodka referencyjnego lekarze podstawowej opieki zdrowotnej mogą korzystać z algorytmu Infantile Hemangioma Referral Score [48]. Przy określaniu, którzy pacjenci wymagają leczenia, pomocna jest skala oceny aktywności naczyniaków (Hemangioma Activity Score (HAS)), natomiast w monitorowaniu odpowiedzi na leczenie przydatna jest skala oceny stopnia nasilenia naczyniaków (Hemangioma Severity Scale (HSS)) [49, 50].
Lekiem pierwszego wyboru w IHs wymagających leczenia ogólnego jest nieselektywny lek β-adrenolityczny – propranolol. Skuteczność i bezpieczeństwo stosowania propranololu w leczeniu IHs potwierdzono w kilku kontrolowanych badaniach z randomizacją [51, 52]. Propranolol jest lekiem zatwierdzonym w 2014 roku przez amerykańską Agencję Żywności i Leków (Food and Drug Administration – FDA) oraz Europejską Agencję Leków (European Medicines Agency – EMA) we wskazaniu do leczenia naczyniaków wczesnodziecięcych [47].
Przed podjęciem leczenia u wszystkich pacjentów konieczne jest zebranie szczegółowego wywiadu, a także badanie przedmiotowe ze szczególnym uwzględnieniem układu krążenia i płuc. Wyjściowe badanie stężenia glukozy jest konieczne wyłącznie u wcześniaków, niemowląt z niską masą ciała lub dodatnim wywiadem w kierunku hipoglikemii lub zaburzeń karmienia [46]. Badanie elektrokardiograficzne jest wskazane u niemowląt z obciążonym wywiadem rodzinnym w kierunku arytmii, jeśli badanie kliniczne budzi podejrzenie zaburzeń rytmu serca, oraz u niemowląt z utratą przytomności w wywiadzie. Badanie echokardiograficzne nie jest konieczne, ale należy je rozważyć u wszystkich pacjentów z nieprawidłowościami układu krążenia stwierdzonymi w badaniu przedmiotowym lub u pacjentów z naczyniakami segmentarnymi [46, 47].
W leczeniu doustnie propranololem początkowo zalecana jest dawka dobowa 1 mg/kg w 2–3 dawkach podzielonych. Dawkę można zwiększyć do maksymalnie 3 mg/kg na dobę [46]. Odsetek pacjentów, u których obserwowano poprawę po 6 miesiącach terapii propranololem w dawce 2–3 mg/kg/dobę, wynosił 96–98%. Leczenie doustnie propranololem należy rozpocząć w fazie proliferacji, choć lek może także przynieść poprawę, jeśli zostanie wdrożony po ukończeniu przez dziecko 9–12 miesięcy życia. Terapia trwa do 12.–18. miesiąca [49, 50]. Zgodnie z zaleceniami europejskiej grupy ekspertów rozpoczęcie leczenia w warunkach szpitalnych jest wskazane u wszystkich niemowląt poniżej 2. miesiąca życia (lub do 3. miesiąca życia; brak konsensusu), niemowląt o masie ciała poniżej 3,5 kg, wszystkich niemowląt z naczyniakiem zagrażającym życiu, dzieci z chorobami układu krążenia, płuc lub utrzymującymi się zaburzeniami stężenia glukozy we krwi oraz u niemowląt z niedostateczną opieką. U starszych pacjentów pediatrycznych leczenie można rozpocząć w trybie ambulatoryjnym, monitorując układ krążenia (wykonując pomiary częstości czynności serca i ciśnienia tętniczego wyjściowo oraz po upływie 1 i 2 godzin) [46]. Autorzy amerykańscy ustalili, że hospitalizacja i monitorowanie układu krążenia nie są konieczne w celu rozpoczęcia terapii propranololem u zdrowych niemowląt, urodzonych o czasie, w wieku postkoncepcyjnym powyżej 45. tygodnia, z prawidłową masą ciała, ustalonym sposobem karmienia, przyrostami masy ciała i odpowiednią opieką [2]. Po przerwaniu leczenia nawrót choroby występuje u 10–15 proc. pacjentów. Naczyniaki segmentarne i głębokie charakteryzują się zwiększonym ryzykiem nawrotu. Można je obniżyć, wydłużając okres leczenia u niemowląt zaliczanych do grupy ryzyka. Do najczęstszych (20–25 proc.) działań niepożądanych występujących podczas leczenia propranololem należą zaburzenia snu, senność i drażliwość. U mniej niż 1 proc. pacjentów występuje skurcz oskrzeli lub zapalenie oskrzelików oraz bezobjawowe niedociśnienie tętnicze. W rzadkich przypadkach obserwowane są ciężkie działania niepożądane, m.in. bradykardia, ujawnienie nierozpoznanego wcześniej bloku przedsionkowo-komorowego, objawowe niedociśnienie tętnicze lub hipoglikemia. Istnieje również teoretyczne ryzyko, że ze względu na zdolność przekraczania bariery krew–mózg propranolol może wpływać na rozwój neurologiczny lub kognitywny [2, 46, 47].
Opracowano nowy system nośnikowy dla propranololu (PRN), wykorzystujący proces enkapsulacji z zastosowaniem nanocząsteczek krzemionki mezoporowatej (MSN). Wyjściowe nanocząsteczki są poddawane przetwarzaniu przy użyciu alkoholu poliwinylowego (PVA) w celu wytworzenia nanocząsteczek PVA-MSN-PRN. Ustalono, że ten innowacyjny system dostarczania nanoleków charakteryzuje się wysoką skutecznością terapeutyczną i niską cytotoksycznością oraz umożliwia rzadsze podawanie leku. Dzięki tym zaletom należy uznać go za obiecującą strategię leczenia IHs [53].
W obejmujących niewielką liczbę pacjentów badaniach niekontrolowanych inne β-adrenolityki, m.in. atenolol i nadolol, wykazały również skuteczność w leczeniu naczyniaków niemowląt. Ustalono, że skuteczność atenololu i nadololu jest porównywalna ze skutecznością propranololu, a nawet wyższa, a liczba działań niepożądanych mniejsza [54, 55]. Atenolol i nadolol mają właściwości hydrofilowe i nie przekraczają bariery krew–mózg, a zatem teoretycznie mogą wiązać się z mniejszym ryzykiem występowania działań niepożądanych w obrębie ośrodkowego układu nerwowego. Ponadto atenolol należy do selektywnych antagonistów receptora β1, co oznacza, że jego stosowanie wiąże się z mniejszym ryzykiem wystąpienia skurczu oskrzeli i hipoglikemii [54]. Nadolol jest nieselektywnym lekiem β-adrenolitycznym, który nie wywołuje efektu sympatykomimetycznego, ale odznacza się łagodnym działaniem depresyjnym na mięsień sercowy. Należy jednak zaznaczyć, że nadolol jest usuwany z organizmu poprzez wydalanie w postaci niezmienionej, głównie przez przewód pokarmowy. Istnieje zatem potencjalne ryzyko, że każdy proces spowalniający tranzyt jelitowy może prowadzić do reabsorpcji i gromadzenia się leku [55].
U pacjentów z naczyniakami powierzchownymi skuteczne jest także leczenie miejscowe z zastosowaniem 0,5-proc. maleinianu tymololu, który również należy do grupy nieselektywnych leków β-adrenolitycznych [56, 57]. Przeprowadzone badania wykazały, że u pacjentów z powierzchownymi IHs leczenie miejscowe tymololem jest równie skuteczne jak terapia doustna propranolem [57]. Wiąże się również z mniejszym odsetkiem zdarzeń niepożądanych (3,0 proc.). Są to głównie objawy miejscowe o łagodnym przebiegu, choć w bardzo rzadkich przypadkach zgłaszano także występowanie bradykardii, zaburzeń snu i skurczu oskrzeli. Leczenie miejscowe z zastosowaniem tymololu nie jest zalecane w przypadku naczyniaków niemowląt o dużej grubości oraz naczyniaków niemowląt głębokich ze względu na niską skuteczność i większe ryzyko wystąpienia powikłań ogólnoustrojowych. W przyszłości miejscowo stosowany tymolol może odgrywać rolę w terapii sekwencyjnej, umożliwiając skrócenie czasu leczenia propranololem [58, 59].
Przez wiele lat filarem leczenia były glikokortykosteroidy, ale ze względu na ryzyko wystąpienia działań niepożądanych nie są już stosowane jako leki pierwszego rzutu [2]. Prednizon lub prednizolon jest obecnie zalecany tylko w przypadku, kiedy występują przeciwwskazania do leczenia propranololem. Jeśli naczyniak jest umiejscowiony w okolicy kluczowych struktur anatomicznych, np. na wardze, lekarze powinni rozważyć doogniskowe podawanie triamcynolonu i/lub betametazonu [2, 60, 61].
Wyniki badań dotyczących stosowania laseroterapii w leczeniu IHs są niespójne. Pulsacyjny laser barwnikowy (PDL) o długości fali 595 nm jest najczęściej stosowany w leczeniu powierzchownych IHs, natomiast laser Nd:YAG o dłuższej fali 1064 nm jest bardziej odpowiedni w terapii głębiej położonych IHs [46, 47]. Potwierdzono także skuteczność lasera naczyniowego w leczeniu teleangiektazji po ustąpieniu IHs [46, 62, 63].
Wnioski
Na przestrzeni ostatniego dziesięciolecia nastąpił ogromny rozwój wiedzy w dziedzinie naczyniaków niemowląt. Lepiej poznano patofizjologię tej jednostki chorobowej, zdefiniowano nowe czynniki ryzyka i opisano różne postacie kliniczne naczyniaków niemowląt. Wykazano także, że naczyniaki niemowląt można skutecznie leczyć β-adrenolitykami, co otworzyło nowe opcje terapeutyczne.
Konflikt interesów
Autorzy nie zgłaszają konfliktu interesów.
Piśmiennictwo
1. Munden A., Butschek R., Tom W.L., Marshall J.S., Poeltler D.M., Krohne S.E., et al.: Prospective study of infantile haemangiomas: incidence, clinical characteristics and association with placental anomalies. Br J Dermatol 2014, 170, 907-913.
2. Krowchuk D.P., Frieden I.J., Mancini A.J., Darrow D.H., Blei F., Greene A.K., et al.: Clinical practice guideline for the management of infantile hemangiomas. Pediatrics 2019, 143, e20183475.
3. Wassef M., Blei F., Adams D., Alomari A., Baselga E., Berenstein A., et al.: Vascular anomalies classification: recommendations from the International Society for the Study of Vascular Anomalies. Pediatrics 2015, 136, e203-e214.
4. Haggstrom A.N., Drolet B.A., Baselga E., Chamlin S.L., Garzon M.C., Horii K.A., et al.: Prospective study of infantile hemangiomas: clinical characteristics predicting complications and treatment. Pediatrics 2006, 118, 882-887.
5. Kilcline C., Frieden I.J.: Infantile hemangiomas: how common are they? A systematic review of the medical literature. Pediatr Dermatol 2008, 25, 168-173.
6. Haggstrom A.N., Drolet B.A., Baselga E., Chamlin S.L., Garzon M.C., Horii K.A., et al.: Prospective study of infantile hemangiomas: demographic, prenatal, and perinatal characteristics. J Pediatr 2007, 150, 291-294.
7. Goelz R., Poets C.F.: Incidence and treatment of infantile haemangioma in preterm infants. Arch Dis Child Fetal Neonatal Ed 2015, 100, F85-91.
8. Castrén E., Salminen P., Gissler M., Stefanovic V., Pitkäranta A., Klockars T.: Risk factors and morbidity of infantile haemangioma: preterm birth promotes ulceration. Acta Paediatr 2016, 105, 940-945.
9. Campbell J.M., Banta-Wright S.A.: Neonatal skin disorders: a review of selected dermatologic abnormalities. J Perinat Neonatal Nurs 2000, 14, 63-83.
10. Blei F., Walter J., Orlow S.J., Marchuk D.A.: Familial segregation of hemangiomas and vascular malformations as an autosomal dominant trait. Arch Dermatol 1998, 134, 718-722.
11. Walter J.W., North P.E., Waner M., Mizeracki A., Blei F., Walker J.W., et al.: Somatic mutation of vascular endothelial growth factor receptors in juvenile hemangioma. Genes Chromosomes Cancer 2002, 33, 295-303.
12. Boye E., Yu Y., Paranya G., Mulliken J.B., Olsen B.R., Bischoff J.: Clonality and altered behavior of endothelial cells from hemangiomas. J Clin Invest 2001, 107, 745-752.
13. Nguyen V.A., Fürhapter C., Romani N., Weber F., Sepp N.: Infantile hemangioma is a proliferation of beta 4-negative endothelial cells adjacent to HLA-DR-positive cells with dendritic cell morphology. Hum Pathol 2004, 35, 739-744.
14. Bielenberg D.R., Bucana C.D., Sanchez R., Mulliken J.B., Folkman J., Fidler I.J.: Progressive growth of infantile cutaneous hemangiomas is directly correlated with hyperplasia and angiogenesis of adjacent epidermis and inversely correlated with expression of the endogenous angiogenesis inhibitor, IFN-beta. Int J Oncol 1999, 14, 401-408.
15. Yu Y., Flint A.F., Mulliken J.B., Wu J.K., Bischoff J.: Endothelial progenitor cells in infantile hemangioma. Blood 2004, 103, 1373-1375.
16. Ritter M.R., Dorrell M.I., Edmonds J., Friedlander S.F., Friedlander M.: Insulin-like growth factor 2 and potential regulators of hemangioma growth and involution identified by large-scale expression analysis. Proc Natl Acad Sci USA 2002, 99, 7455-7460.
17. Colonna V., Resta L., Napoli A., Bonifazi E.: Placental hypoxia and neonatal haemangioma: clinical and histological observations. Br J Dermatol 2010, 162, 208-209.
18. de Jong S., Itinteang T., Withers A.H., Davis P.F., Tan S.T.: Does hypoxia play a role in infantile hemangioma? Arch Dermatol Res 2016, 308, 219-227.
19. North P.E., Waner M., Mizeracki A., Mrak R.E., Nicholas R., Kincannon J., et al.: A unique microvascular phenotype shared by juvenile hemangiomas and human placenta. Arch Dermatol 2001, 137, 559-570.
20. Herbert A., Ng H., Jessup W., Kockx M., Cartland S., Thomas S.R., et al.: Hypoxia regulates the production and activity of glucose transporter-1 and indoleamine 2,3-dioxygenase in monocyte-derived endothelial-like cells: possible relevance to infantile haemangioma pathogenesis. Br J Dermatol 2011, 164, 308-315.
21. Drolet B.A., Frieden I.J.: Characteristics of infantile hemangiomas as clues to pathogenesis: does hypoxia connect the dots? Arch Dermatol 2010, 146, 1295-1299.
22. Itinteang T., Withers A.H., Davis P.F., Tan S.T.: Biology of infantile hemangioma. Front Surg 2014, 1, 38.
23. Barnés C.M., Huang S., Kaipainen A., Sanoudou D., Chen E.J., Eichler G.S., et al.: Evidence by molecular profiling for a placental origin of infantile hemangioma. Proc Natl Acad Sci USA 2005, 102, 19097-19102.
24. Itinteang T., Brasch H.D., Tan S.T., Day D.J.: Expression of components of the renin-angiotensin system in proliferating infantile haemangioma may account for the propranolol-induced accelerated involution. J Plast Reconstr Aesthet Surg 2011, 64, 759-765.
25. Fiselier T.J., Lijnen P., Monnens L., van Munster P., Jansen M., Peer P.: Levels of renin, angiotensin I and II, angiotensin-converting enzyme and aldosterone in infancy and childhood. Eur J Pediatr 1983, 141, 3-7.
26. Broughton Pipkin F., Smales O.R., O’Callaghan M.: Renin and angiotensin levels in children. Arch Dis Child 1981, 56, 298-302.
27. Stephenson T.J., Broughton Pipkin F., Elias-Jones A.C.: Factors influencing plasma renin and renin substrate in premature infants. Arch Dis Child 1991, 66, 1150-1154.
28. Bruckner A.L., Frieden I.J.: Hemangiomas of infancy. J Am Acad Dermatol 2003, 48, 477-493.
29. Drolet B.A., Esterly N.B., Frieden I.J.: Hemangiomas in children. N Engl J Med 1999, 341, 173-181.
30. Léauté-Labrèze C., Harper J.I., Hoeger P.H.: Infantile haemangioma. Lancet 2017, 390, 85-94.
31. Rodriguez Bandera A., Sebaratnam D.F., Wargon O., Wong L.C.: Infantile hemangioma. Part 1: epidemiology, pathogenesis, clinical presentation and assessment. J Am Acad Dermatol 2021, 85, 1379-1392.
32. Baselga E., Roe E., Coulie J., Muñoz F.Z., Boon L.M., McCuaig C., et al.: Risk factors for degree and type of sequelae after involution of untreated hemangiomas of infancy. JAMA Dermatol 2016, 152, 1239-1243.
33. Couto R.A., Maclellan R.A., Zurakowski D., Greene A.K.: Infantile hemangioma: clinical assessment of the involuting phase and implications for management. Plast Reconstr Surg 2012, 130, 619-624.
34. Chang L.C., Haggstrom A.N., Drolet B.A., Baselga E., Chamlin S.L., Garzon M.C., et al.: Growth characteristics of infantile hemangiomas: implications for management. Pediatrics 2008, 122, 360-367.
35. Hand J.L., Frieden I.J.: Vascular birthmarks of infancy: resolving nosologic confusion. Am J Med Genet 2002, 108, 257-264.
36. Frieden I.J., Eichenfield L.F., Esterly N.B., Geronemus R., Mallory S.B.: Guidelines of care for hemangiomas of infancy. American Academy of Dermatology Guidelines/Outcomes Committee. J Am Acad Dermatol 1997, 37, 631-637.
37. Chiller K.G., Passaro D., Frieden I.J.: Hemangiomas of infancy: clinical characteristics, morphologic subtypes, and their relationship to race, ethnicity, and sex. Arch Dermatol 2002, 138, 1567-1576.
38. Haggstrom A.N., Lammer E.J., Schneider R.A., Marcucio R., Frieden I.J.: Patterns of infantile hemangiomas: new clues to hemangioma pathogenesis and embryonic facial development. Pediatrics 2006, 117, 698-703.
39. Garzon M.C., Epstein L.G., Heyer G.L., Frommelt P.C., Orbach D.B., Baylis A.L., et al.: PHACE syndrome: consensus-derived diagnosis and care recommendations. J Pediatr 2016, 178, 24-33.
40. Chamlin S.L., Haggstrom A.N., Drolet B.A., Baselga E., Frieden I.J., Garzon M.C., et al.: Multicenter prospective study of ulcerated hemangiomas. J Pediatr 2007, 151, 684-689.
41. Schwartz S.R., Blei F., Ceisler E., Steele M., Furlan L., Kodsi S.: Risk factors for amblyopia in children with capillary hemangiomas of the eyelids and orbit. J AAPOS 2006, 10, 262-268.
42. Thomas M.W., Burkhart C.N., Vaghani S.P., Morrell D.S., Wagner A.M.: Failure to thrive in infants with complicated facial hemangiomas. Pediatr Dermatol 2012, 29, 49-52.
43. Schneider M.H., Garcia C.F.V., Aleixo P.B., Kiszewski A.E.: Congenital cutaneous pyogenic granuloma: report of two cases and review of the literature. J Cutan Pathol 2019, 46, 691-697.
44. Ţarcă E., Cojocaru E., Roşu S.T., Butnariu L.I., Plămădeală P., Moisă Ş.M.: Differential diagnosis difficulties related to infantile hemangioma – case report and literature review. Rom J Morphol Embryol 2019, 60, 1375-1379.
45. Sznurkowska K., Wyrzykowski D., Kamińska B.: Naczyniaki u dzieci – problem interdyscyplinarny. Forum Med Rodz 2011, 5, 460-467.
46. Hoeger P.H., Harper J.I., Baselga E., Bonnet D., Boon L.M., Ciofi Degli Atti M., et al.: Treatment of infantile haemangiomas: recommendations of a European expert group. Eur J Pediatr 2015, 174, 855-865.
47. Sebaratnam D.F., Rodríguez Bandera A.L., Wong L.F., Wargon O.J.: Infantile hemangioma. Part 2: Management. J Am Acad Dermatol 2021, 85, 1395-1404.
48. Leaute-Labreze C., Baselga Torres E., Weibel L., Boon L.M., El Hachem M., van der Vleuten C., et al.: The infantile hemangioma referral score: a validated tool for physicians. Pediatrics 2020, 145, e20191628.
49. Janmohamed S.R., de Waard-van der Spek F.B., Madern G.C., de Laat P.C., Hop W.C., Oranje A.P.: Scoring the proliferative activity of haemangioma of infancy: the Haemangioma Activity Score (HAS). Clin Exp Dermatol 2011, 36, 715-723.
50. Moyakine A.V., Herwegen B., van der Vleuten C.J.M.: Use of the Hemangioma Severity Scale to facilitate treatment decisions for infantile hemangiomas. J Am Acad Dermatol 2017, 77, 868-873.
51. Hogeling M., Adams S., Wargon O.: A randomized controlled trial of propranolol for infantile hemangiomas. Pediatrics 2011, 128, e259-e266.
52. Léauté-Labrèze C., Hoeger P., Mazereeuw-Hautier J., Guibaud L., Baselga E., Posiunas G., et al.: A randomized, controlled trial of oral propranolol in infantile hemangioma. N Engl J Med 2015, 372, 735-746.
53. Wu H., Wang X., Zheng J., Zhang L., Li X., Yuan W.E., et al.: Propranolol-loaded mesoporous silica nanoparticles for treatment of infantile hemangiomas. Adv Healthc Mater 2019, 8, e1801261.
54. Bayart C.B., Tamburro J.E., Vidimos A.T., Wang L., Golden A.B.: Atenolol versus propranolol for treatment of infantile hemangiomas during the proliferative phase: a retrospective noninferiority study. Pediatr Dermatol 2017, 34, 413-421.
55. Pope E., Chakkittakandiyil A., Lara-Corrales I., Maki E., Weinstein M.: Expanding the therapeutic repertoire of infantile haemangiomas: cohort-blinded study of oral nadolol compared with propranolol. Br J Dermatol 2013, 168, 222-224.
56. Semkova K., Kazandjieva J.: Topical timolol maleate for treatment of infantile haemangiomas: preliminary results of a prospective study. Clin Exp Dermatol 2013, 38, 143-146.
57. Moehrle M., Léauté-Labrèze C., Schmidt V., Röcken M., Poets C.F., Goelz R.: Topical timolol for small hemangiomas of infancy. Pediatr Dermatol 2013, 30, 245-249.
58. Marey H.M., Elmazar H.F., Mandour S.S., Khairy H.A.: Combined oral and topical beta blockers for the treatment of early proliferative superficial periocular infantile capillary hemangioma. J Pediatr Ophthalmol Strabismus 2018, 55, 37-42.
59. Muñoz-Garza F.Z., Ríos M., Roé-Crespo E., Bernabeu-Wittel J., Montserrat-García M.T., Puig L., et al.: Efficacy and safety of topical timolol for the treatment of infantile hemangioma in the early proliferative stage: a randomized clinical trial. JAMA Dermatol 2021, 157, 583-587.
60. Couto J.A., Greene A.K.: Management of problematic infantile hemangioma using intralesional triamcinolone: efficacy and safety in 100 infants. J Plast Reconstr Aesthet Surg 2014, 67, 1469-1474.
61. Greene A.K., Couto R.A.: Oral prednisolone for infantile hemangioma: efficacy and safety using a standardized treatment protocol. Plast Reconstr Surg 2011, 128, 743-752.
62. Kwon S.H., Choi J.W., Byun S.Y., Kim B.R., Park K.C., Youn S.W., et al.: Effect of early long-pulse pulsed dye laser treatment in infantile hemangiomas. Dermatol Surg 2014, 40, 405-411.
63. Satterfield K.R., Chambers C.B.: Current treatment and management of infantile hemangiomas. Surv Ophthalmol 2019, 64, 608-618.
Marta Kurzeja1, Katarzyna Pawlik1, Agnieszka Sienicka1, Małgorzata Olszewska1, Lidia Rudnicka1
1Klinika Dermatologii Warszawskiego Uniwersytetu Medycznego
Wprowadzenie
Naczyniaki wczesnodziecięce (infantile hemangiomas – IHs) są najczęstszymi niezłośliwymi nowotworami naczyń krwionośnych występującymi w wieku dziecięcym [1]. Naczyniaki niemowląt zazwyczaj nie są widoczne po porodzie, w większości przypadków pojawiają się w czasie 1–2 tygodni po urodzeniu. Rozwój naczyniaków niemowląt można podzielić na 3 fazy: faza szybkiego wzrostu (wzrostu), faza plateau i faza inwolucji [2, 3]. Klasyfikacja kliniczna IHs opiera się na głębokości (powierzchowne, mieszane i głębokie) oraz rozległości zajęcia skóry (ogniskowe, wieloogniskowe, segmentarne, pośrednie). Większość ma przebieg samoograniczający się i nie wymaga leczenia. W niektórych jednak przypadkach mogą wiązać się z występowaniem powikłań, do których należą: owrzodzenie, niedrożność dróg oddechowych, upośledzenie czynnościowe; lub oszpeceniem; obniżają też jakość życia. U takich pacjentów lekiem pierwszego rzutu jest propranolol [4].
Epidemiologia i czynniki ryzyka
Naczyniaki wczesnodziecięce są najczęstszymi nowotworami naczyń krwionośnych w wieku dziecięcym. Częstość występowania IHs wynosi 4–5 proc., ale u wcześniaków może sięgać nawet 20 proc. [5]. IHs pojawiają się częściej u niemowląt rasy białej oraz 2–3-krotnie częściej u dziewczynek niż chłopców [6, 7]. Istnieje także związek między częstością naczyniaków niemowląt i niską masą urodzeniową (naczyniaki mogą dotyczyć nawet 30 proc. niemowląt o masie < 1 kg przy urodzeniu). Na podstawie dostępnych doniesień stwierdzono również, że u wcześniaków z IHs częściej rozwijają się owrzodzenia niż u niemowląt urodzonych o czasie [8, 9]. Ponadto IHs częściej występują u niemowląt z ciąż mnogich. Wśród innych prenatalnych czynników ryzyka należy wymienić: starszy wiek matki, palenie papierosów przez matkę, zapłodnienie in vitro, krwawienie z dróg rodnych w pierwszym trymestrze ciąży, łożysko przodujące, stan przedrzucawkowy i obciążony wywiad rodzinny w kierunku IHs [1, 6, 10].
Patogeneza
Patogeneza naczyniaków wczesnodziecięcych nie została w pełni wyjaśniona. W piśmiennictwie wysunięto kilka hipotez dotyczących czynników patogenetycznych tego schorzenia. Aktualnie dostępne dane naukowe wskazują, że u podłoża naczyniaków leży klonalna proliferacja komórek progenitorowych śródbłonka wewnętrznego lub angioblastów pochodzenia łożyskowego [11–13]. Wydaje się, że proliferacja IHs jest skutkiem zaburzenia równowagi pomiędzy pozytywnymi i negatywnymi czynnikami naczyniotwórczymi ulegającymi ekspresji w naczyniaku i otaczającej zdrowej tkance [14–16].
Z obserwacji klinicznych wynika, że kluczową rolę w patogenezie naczyniaków niemowląt może odgrywać niedotlenienie tkanek [17, 18]. Teorię tę potwierdzają wyniki badań molekularnych, m.in. wzmożona ekspresja czynników indukowanych niedotlenieniem: czynnika 1α, naczyniowo-śródbłonkowego czynnika wzrostu (vascular endothelial growth factor – VEGF), transportera glukozy 1 (glucose transporter isoform 1 – GLUT-1) oraz insulinopodobnego czynnika wzrostu 2 (insulin-like growth factor-2 – IGF-2) [16].
Wykazano, że GLUT-1 jest wysoce swoistym markerem, który w przeciwieństwie do innych malformacji naczyniowych oraz prawidłowej skóry i tkanki podskórnej ulega ekspresji w komórkach śródbłonka naczyniaków niemowląt zarówno w fazie proliferacji, jak i inwolucji [19]. Wskazuje się ponadto, że synteza GLUT-1 jest indukowana przez niedotlenienie, a ekspresja GLUT-1 na powierzchni komórek podobnych do śródbłonka pochodzących z monocytów ulega wzmocnieniu wskutek niedotlenienia [20].
Wiele czynników ryzyka naczyniaków niemowląt, m.in. poród przedwczesny, niska masa urodzeniowa i stan przedrzucawkowy, wiąże się z niedotlenieniem. Ponadto stwierdzono, że czynnikiem inicjującym rozwój naczyniaków może być niedotlenienie in utero, a także niedotlenienie miejscowe. Uważa się, że faza proliferacji stanowi próbę utrzymania homeostazy i normalizacji stężenia tlenu w tkankach [21].
Ze względu na ekspresję markerów łożyskowych: GLUT-1, receptora γFC, merozyny, antygenu Lewis Y i dejodynazy jodotyroninowej typu 3, wysunięto także hipotezę o pochodzeniu embrionalnym naczyniaków. Ponadto w IHs wykazano obecność swoistych cząsteczek charakterystycznych dla komórek rdzenia mezenchymalnego kosmówki łożyska (ludzkiej gonadotropiny kosmówkowej β i ludzkiego laktogenu łożyskowego). Na tej podstawie zaproponowano hipotezę, według której IHs wywodzą się z komórek rdzenia mezenchymalnego kosmówki ulegających embolizacji we wczesnym okresie życia płodowego [19, 22, 23].
Wykazano, że układ renina–angiotensyna (renin--angiotensin system – RAS) odgrywa istotną rolę w proliferacji komórek śródbłonka w naczyniakach niemowląt. Zaobserwowano, że komórki śródbłonka naczyniaków w fazie proliferacji wykazują ekspresję enzymu konwertującego angiotensynę (angiotensin converting enzyme – ACE) i receptora angiotensyny II, które są komponentami RAS [24]. Uważa się, że wysokie stężenie angiotensyny II (ATII) wraz z VEGF nasila proliferację komórek. Na potwierdzenie tej teorii wskazywano, że stężenie reniny w surowicy jest znacznie podwyższone w czasie pierwszych 3 miesięcy życia i stopniowo zmniejsza się w sposób odpowiadający naturalnemu wzorcowi rozwoju naczyniaków niemowląt [25]. Ponadto podwyższone stężenie reniny wykryto w grupach uznawanych za szczególnie narażone na występowanie IHs, tj. u niemowląt rasy białej, u płci żeńskiej, a także urodzonych przedwcześnie [26, 27].
Obraz kliniczny
W rozwoju naczyniaków niemowląt można wyróżnić trzy charakterystyczne fazy: proliferacji, plateau i inwolucji. U większości noworodków naczyniaki nie są obecne przy urodzeniu i pojawiają się dopiero w czasie kilku pierwszych tygodni życia. W niektórych przypadkach po porodzie u dziecka widoczna jest zmiana prekursorowa w postaci zbielenia związanego z wazokonstrykcją, zmiany przypominającej krwiaka lub jasnoczerwonej plamy z teleangiektazjami. Faza proliferacji rozpoczyna się po okresie utajenia trwającym około 1–3 tygodni i trwa 3–5 miesięcy, tempo rozwoju zmiany jest najszybsze między 5. i 8. tygodniem życia [28–32]. W późniejszym okresie faza proliferacji przebiega wolniej, naczyniak rozwija się do wieku 9–12 miesięcy, ale w pojedynczych przypadkach proces ten może trwać nawet powyżej 36. miesiąca życia. Dłuższa faza proliferacyjna częściej dotyczy IHs umiejscowionych w obrębie głowy i szyi, zwłaszcza na czubku nosa, w okolicy oczu, ust i uszu, a także dużych, segmentarnych i/lub głębokich naczyniaków [2, 28–32]. Po fazie proliferacji następuje faza plateau, a następnie faza samoistnej inwolucji. W tym czasie IHs ulegają w większości przypadków prawie calkowitemu zanikowi. Faza inwolucji rozpoczyna się zwykle po upływie roku i może mieć zróżnicowany czas trwania. W około 90 proc. IHs etap inwolucji kończy się przez 4. rokiem życia, w większości przypadków nie obserwuje się znaczącej poprawy po 3. roku życia [32, 33]. Naczyniaki głębokie zazwyczaj wchodzą w fazę inwolucji później niż naczyniaki powierzchowne [34]. U 69 proc. pacjentów nawet po fazie inwolucji obserwowane są zmiany resztkowe, m.in. teleangiektazje, nadmierna objętość tkanki włóknistej oraz wiotkość skóry spowodowana utratą tkanki elastycznej [31, 32].
IHs są klasyfikowane w zależności od głębokości naciekania na powierzchowne, mieszane i głębokie. Powierzchowne naczyniaki niemowląt są umiejscowione w warstwie powierzchownej skóry właściwej. W obrazie klinicznym mają postać płaskich guzków o budowie zrazikowej. Powierzchowne naczyniaki niemowląt wcześniej określane były jako „naczyniaki truskawkowe” lub „naczyniaki kapilarne”, są najczęstsze [30, 31, 34, 35]. Głębokie naczyniaki niemowląt rozwijają się w dolnej części skóry właściwej i/lub w tkance podskórnej i mają postać guzków w kolorze skóry lub w kolorze jasnoniebieskim. Wcześniej zmiany te określano jako „naczyniaki jamiste”(obecnie malformacje żylne). Naczyniaki mieszane skóry właściwej i tkanki podskórnej mają cechy kliniczne zarówno powierzchownych, jak i głębokich IHs [34, 35].
Inna klasyfikacja IHs opiera się na rozległości naczyniaka i obejmuje naczyniaki ogniskowe, segmentarne, wieloogniskowe i nieokreślone [36]. Ogniskowe naczyniaki niemowląt mają postać wyraźnie odgraniczonych, pojedynczych zmian umiejscowionych w obrębie jednego obszaru anatomicznego. Naczyniaki segmentarne mają ksztalt linijny i są bardziej rozległe. Wydaje się, że lokalizacja naczyniaków ma związek z rozwojem embrionalnym bądź znajduje się w obszarze zaopatrywanym przez tętnice embrionalne, naczyniaki nie zajmują zazwyczaj dermatomów lub nie są zlokalizowane wzdłuż linii Blashko. Naczyniaki segmentarne występują częściej u niemowląt płci żeńskiej [36, 37]. Ponadto naczyniaki segmentarne częściej wymagają intensywnej i przewlekłej terapii [36, 38]. Naczniaki segmentarne umiejscowione na twarzy lub w okolicy lędźwiowo-krzyżowej mogą być składową zespołów PHACE ((P)osterior fossa and other structural brain malformations; large (H)emangiomas of the face, neck, and/or scalp; anatomical anomalies of the cerebral or cervical (A)rteries; (C)ardiac anomalies/(C)oarctation of the aorta; and (E)ye abnormalities) i LUMBAR ((L)ower body congenital infantile hemangiomas and other skin defects; (U)rogenital anomalies and ulceration; (M)yelopathy; (B)ony deformities; (A)norectal malformations and arterial anomalies; and (R)ectal anomalies). Mnogie naczyniaki niemowląt, definiowane jako obecność ponad 5, a według innych publikacji ponad 10 zmian, dotyczą nawet 20 proc. niemowląt [29]. Występują częściej u dzieci z ciąż mnogich. Mnogie naczyniaki niemowląt wiążą się ze zwiększonym ryzykiem zmian narządowych, głównie w obrębie przewodu pokarmowego i wątroby [33]. Naczyniaki niemowląt, które nie spełniają kryteriów żadnej z tych kategorii, mogą być oznaczone jako nieokreślone [31].
Powikłania
Większość naczyniaków wczesnodziecięcych nie wywołuje powikłań i nie wymaga żadnej interwencji.
Najczęstszym powikłaniem jest owrzodzenie, które występuje u 16–23 proc. pacjentów, najczęściej między 4. i 8. miesiącem życia. Wczesnym objawem rozwijającego się owrzodzenia są odbarwienia widoczne na brzegach zmiany. Wyższe ryzyko owrzodzeń występuje w przypadku dużych powierzchownych i segmentarnych naczyniaków niż w przypadku innych typów. Oprócz tego zwiększone prawdopodobieństwo owrzodzenia obserwowane jest w obrębie naczyniaków umiejscowionych na dolnej wardze, szyi i w okolicy anogenitalnej [30, 31]. Owrzodzenie może powodować krwawienie (41 proc.) lub zakażenie (16 proc.) oraz bolesność. W niemal we wszystkich przypadkach owrzodzenie wiąże się z powstaniem blizny [4, 8, 39].
Naczyniaki niemowląt umiejscowione na powiece lub w pobliżu oka mogą powodować upośledzenie widzenia w fazie proliferacji, co może prowadzić do trwałego niedowidzenia, astygmatyzmu, zeza, przesunięcia do przodu gałek ocznych (proptozy), niedomykalności powiek, a nawet uszkodzenia nerwu wzrokowego. IHs zlokalizowane w okolicy przedusznej, na skórze żuchwy, na wardze dolnej, brodzie i przedniej powierzchni szyi mogą być związane z obecnością IHs w drogach oddechowych. To może prowadzić do zagrażającej życiu niedrożności górnych dróg oddechowych. IHs rozwijające się w zewnętrznym przewodzie słuchowym stwarzają ryzyko niedosłuchu przewodzeniowego [40, 41].
Naczyniaki niemowląt umiejscowione w środkowej części twarzy lub w okolicy ślinianek przyusznych, a także rozległe naczyniaki na klatce piersiowej powodują problemy estetyczne. IHs rozwijające się na nosie i wardze często wykazują niepełną samoistną regresję. Naczyniaki podskórne zlokalizowane w okolicy ślinianek przyusznych utrzymują się dłużej niż inne rodzaje naczyniaków [30, 31, 40, 41].
Mnogie naczyniaki niemowląt mogą wiązać się z występowaniem naczyniaków wątroby. Istnieje również ryzyko rozwoju niedoczynności tarczycy związanej z ekspresją dejodynazy jodotyroninowej u pacjentów z rozległymi naczyniakami oraz naczyniakami wieloogniskowymi. U dzieci z rozległymi naczyniakami zlokalizowanymi w obrębie skóry, jak również z rozsianymi naczyniakami wątroby może występować niewydolność serca ze zwiększoną pojemnością minutową [30, 31]. Czynniki ryzyka wpływające na rozwój powikłań zestawiono w tabeli I.

Rozpoznanie
W większości przypadków rozpoznanie opiera się na obrazie klinicznym [30, 39]. Badania obrazowe należy wykonywać wyłącznie wówczas, gdy rozpoznanie IHs jest niepewne lub gdy mogą występować nieprawidłowości anatomiczne. U niemowląt, u których występuje ≥ 5 naczyniaków w obrębie skóry, zaleca się wykonanie USG jamy brzusznej ze względu na zwiększone ryzyko występowania naczyniaków trzewnych, głównie wątroby [40]. W przypadku podejrzenia zespołu PHACE zaleca się wykonanie badania MRI głowy i szyi. Gdy u pacjenta podejrzewa się zespół LUMBAR, wskazane jest badanie MRI kręgosłupa i miednicy [30].
Diagnostyka różnicowa
W diagnostyce różnicowej należy uwzględnić przede wszystkim nieprawidłowości naczyń, naczyniaki wrodzone, ziarniniaki naczyniowe oraz naczyniakośródbłoniaki o typie mięsaka Kaposiego (Kaposiform hemangioendothelioma) [30, 42–44].
Nieprawidłowości naczyniowe dzielą się na malformacje naczyniowe oraz guzy naczyniowe. Malformacje naczyniowe są obecne przy urodzeniu, rosną proporcjonalnie do wzrostu dziecka i nigdy nie ustępują samoistnie [30, 45]. Natomiast guzy naczyniowe mogą, choć nie muszą, być obecne przy urodzeniu i mają tendencję do rozrostu. W przypadku powiększającego się guza u noworodka, jeśli rozpoznanie naczyniaka wczesnodziecięcego jest niepewne na podstawie obrazu klinicznego, należy wykonać biopsję do badania histologicznego [30, 44].
Naczyniaki wrodzone przypominają naczyniaki niemowląt, jednak są obecne przy urodzeniu i nie wykazują ekspresji GLUT1, czyli immunohistologicznego wskaźnika IHs. Według klasycznego podziału naczyniaków wrodzonych wyróżnia się typ szybko zanikający (rapidly involuting congenital haemangioma – RICH), niezanikający (non-involuting congenital haemangioma – NICH) i częściowo zanikający (partially involuting congenital hemangiomas – PICH). Naczyniaki typu RICH osiągają swoje maksymalne rozmiary przed urodzeniem lub przy urodzeniu. Oprócz tego naczyniaki RICH mogą wywoływać niewydolność serca ze zwiększoną pojemnością minutową, a także przejściową małopłytkowość. Zmiany tego rodzaju wcześnie wchodzą w fazę regresji, która w większości przypadków kończy się w ciągu roku. Naczyniaki typu NICH nie wykazują oznak regresji. Leczenie naczyniaków wrodzonych jest konieczne wyłącznie ze względów estetycznych [30, 31].
Ziarniniak naczyniowy (pyogenic granuloma – PG) jest powszechnie występującym guzem naczyniowym o charakterze nabytym. Częstość występowania PG jest oceniana na 0,5–1,0%. U niemowląt odsetek ten wynosi około 12%, a większość przypadków stwierdza się poniżej 4. miesiąca życia. Ziarniniaki naczyniowe zazwyczaj rozwijają się w miejscu drobnego urazu jako egzofityczne guzki o średnicy od 1 do 10 mm. Większość PG jest zlokalizowanych na twarzy oraz szyi, często krwawi [30, 43].
Naczyniakośródbłoniak o typie mięsaka Kaposiego (Kaposiform hemangioendothelioma) jest rzadkim guzem naczyniowym, którego częstość występowania określa się jako 0,9 przypadka na 100 000 pacjentów. Najczęściej pojawia się w czasie pierwszych 2 lat życia, u 60 proc. pacjentów w okresie noworodkowym. W obrazie klinicznym Kaposiform hemangioendothelioma może być widoczny w postaci guzka zlokalizowanego powierzchownie lub rozległego słabo odgraniczonego guza położonego głęboko w tkankach miękkich [30]. Kaposiform hemangioendothelioma może współwystępować z zespołem Kasabacha-Merritt, w którym dochodzi do nasilonej trombocytopenii w następstwie rozsianej koagulopatii. Leczeniem pierwszego wyboru jest winkrystyna, ale u pacjentów z Kaposiform hemangioendothelioma można także stosować sirolimus [2, 30].
Leczenie
Większość naczyniaków niemowląt nie wywołuje powikłań, w związku z tym leczenie nie jest konieczne. Tylko 10–20 proc. IHs wymaga terapii z powodu powikłań [40]. Każdy wzrost wielkości zmiany o 10 cm2 oznacza zwiększenie o 4,0 proc. prawdopodobieństwa, że pacjent będzie wymagać leczenia, oraz podwyższa o 5,0 proc. ryzyko wystąpienia powikłań [4]. Wskazania do leczenia obejmują naczyniaki niemowląt, które zagrażają życiu (IHs umiejscowione w okolicy podgłośniowej; powodujące ucisk struktur nerwowych; naczyniaki krwawiące w obrębie przewodu pokarmowego; IHs powodujące niewydolność serca lub upośledzenie czynności wątroby), naczyniaki wczesnodziecięce powodujące zaburzenia czynnościowe (IHs w okolicy okołogałkowej; wywołujące niedrożność, zwłaszcza nosa lub przewodu słuchowego zewnętrznego; wrzodziejące), oraz naczyniaki wczesnodziecięce powodujące problem estetyczny (guzy twarzy, głównie umiejscowione na nosie, wargach lub w okolicy przedusznej oraz rozległe naczyniaki na klatce piersiowej) [46].
Dzieci z naczyniakiem wymagającym leczenia powinny być kierowane w pierwszych 5 tygodniach życia do specjalisty w dziedzinie nieprawidłowości naczyniowych [47]. Podczas podejmowania decyzji o ewentualnym kierowaniu pacjentów do ośrodka referencyjnego lekarze podstawowej opieki zdrowotnej mogą korzystać z algorytmu Infantile Hemangioma Referral Score [48]. Przy określaniu, którzy pacjenci wymagają leczenia, pomocna jest skala oceny aktywności naczyniaków (Hemangioma Activity Score (HAS)), natomiast w monitorowaniu odpowiedzi na leczenie przydatna jest skala oceny stopnia nasilenia naczyniaków (Hemangioma Severity Scale (HSS)) [49, 50].
Lekiem pierwszego wyboru w IHs wymagających leczenia ogólnego jest nieselektywny lek β-adrenolityczny – propranolol. Skuteczność i bezpieczeństwo stosowania propranololu w leczeniu IHs potwierdzono w kilku kontrolowanych badaniach z randomizacją [51, 52]. Propranolol jest lekiem zatwierdzonym w 2014 roku przez amerykańską Agencję Żywności i Leków (Food and Drug Administration – FDA) oraz Europejską Agencję Leków (European Medicines Agency – EMA) we wskazaniu do leczenia naczyniaków wczesnodziecięcych [47].
Przed podjęciem leczenia u wszystkich pacjentów konieczne jest zebranie szczegółowego wywiadu, a także badanie przedmiotowe ze szczególnym uwzględnieniem układu krążenia i płuc. Wyjściowe badanie stężenia glukozy jest konieczne wyłącznie u wcześniaków, niemowląt z niską masą ciała lub dodatnim wywiadem w kierunku hipoglikemii lub zaburzeń karmienia [46]. Badanie elektrokardiograficzne jest wskazane u niemowląt z obciążonym wywiadem rodzinnym w kierunku arytmii, jeśli badanie kliniczne budzi podejrzenie zaburzeń rytmu serca, oraz u niemowląt z utratą przytomności w wywiadzie. Badanie echokardiograficzne nie jest konieczne, ale należy je rozważyć u wszystkich pacjentów z nieprawidłowościami układu krążenia stwierdzonymi w badaniu przedmiotowym lub u pacjentów z naczyniakami segmentarnymi [46, 47].
W leczeniu doustnie propranololem początkowo zalecana jest dawka dobowa 1 mg/kg w 2–3 dawkach podzielonych. Dawkę można zwiększyć do maksymalnie 3 mg/kg na dobę [46]. Odsetek pacjentów, u których obserwowano poprawę po 6 miesiącach terapii propranololem w dawce 2–3 mg/kg/dobę, wynosił 96–98%. Leczenie doustnie propranololem należy rozpocząć w fazie proliferacji, choć lek może także przynieść poprawę, jeśli zostanie wdrożony po ukończeniu przez dziecko 9–12 miesięcy życia. Terapia trwa do 12.–18. miesiąca [49, 50]. Zgodnie z zaleceniami europejskiej grupy ekspertów rozpoczęcie leczenia w warunkach szpitalnych jest wskazane u wszystkich niemowląt poniżej 2. miesiąca życia (lub do 3. miesiąca życia; brak konsensusu), niemowląt o masie ciała poniżej 3,5 kg, wszystkich niemowląt z naczyniakiem zagrażającym życiu, dzieci z chorobami układu krążenia, płuc lub utrzymującymi się zaburzeniami stężenia glukozy we krwi oraz u niemowląt z niedostateczną opieką. U starszych pacjentów pediatrycznych leczenie można rozpocząć w trybie ambulatoryjnym, monitorując układ krążenia (wykonując pomiary częstości czynności serca i ciśnienia tętniczego wyjściowo oraz po upływie 1 i 2 godzin) [46]. Autorzy amerykańscy ustalili, że hospitalizacja i monitorowanie układu krążenia nie są konieczne w celu rozpoczęcia terapii propranololem u zdrowych niemowląt, urodzonych o czasie, w wieku postkoncepcyjnym powyżej 45. tygodnia, z prawidłową masą ciała, ustalonym sposobem karmienia, przyrostami masy ciała i odpowiednią opieką [2]. Po przerwaniu leczenia nawrót choroby występuje u 10–15 proc. pacjentów. Naczyniaki segmentarne i głębokie charakteryzują się zwiększonym ryzykiem nawrotu. Można je obniżyć, wydłużając okres leczenia u niemowląt zaliczanych do grupy ryzyka. Do najczęstszych (20–25 proc.) działań niepożądanych występujących podczas leczenia propranololem należą zaburzenia snu, senność i drażliwość. U mniej niż 1 proc. pacjentów występuje skurcz oskrzeli lub zapalenie oskrzelików oraz bezobjawowe niedociśnienie tętnicze. W rzadkich przypadkach obserwowane są ciężkie działania niepożądane, m.in. bradykardia, ujawnienie nierozpoznanego wcześniej bloku przedsionkowo-komorowego, objawowe niedociśnienie tętnicze lub hipoglikemia. Istnieje również teoretyczne ryzyko, że ze względu na zdolność przekraczania bariery krew–mózg propranolol może wpływać na rozwój neurologiczny lub kognitywny [2, 46, 47].
Opracowano nowy system nośnikowy dla propranololu (PRN), wykorzystujący proces enkapsulacji z zastosowaniem nanocząsteczek krzemionki mezoporowatej (MSN). Wyjściowe nanocząsteczki są poddawane przetwarzaniu przy użyciu alkoholu poliwinylowego (PVA) w celu wytworzenia nanocząsteczek PVA-MSN-PRN. Ustalono, że ten innowacyjny system dostarczania nanoleków charakteryzuje się wysoką skutecznością terapeutyczną i niską cytotoksycznością oraz umożliwia rzadsze podawanie leku. Dzięki tym zaletom należy uznać go za obiecującą strategię leczenia IHs [53].
W obejmujących niewielką liczbę pacjentów badaniach niekontrolowanych inne β-adrenolityki, m.in. atenolol i nadolol, wykazały również skuteczność w leczeniu naczyniaków niemowląt. Ustalono, że skuteczność atenololu i nadololu jest porównywalna ze skutecznością propranololu, a nawet wyższa, a liczba działań niepożądanych mniejsza [54, 55]. Atenolol i nadolol mają właściwości hydrofilowe i nie przekraczają bariery krew–mózg, a zatem teoretycznie mogą wiązać się z mniejszym ryzykiem występowania działań niepożądanych w obrębie ośrodkowego układu nerwowego. Ponadto atenolol należy do selektywnych antagonistów receptora β1, co oznacza, że jego stosowanie wiąże się z mniejszym ryzykiem wystąpienia skurczu oskrzeli i hipoglikemii [54]. Nadolol jest nieselektywnym lekiem β-adrenolitycznym, który nie wywołuje efektu sympatykomimetycznego, ale odznacza się łagodnym działaniem depresyjnym na mięsień sercowy. Należy jednak zaznaczyć, że nadolol jest usuwany z organizmu poprzez wydalanie w postaci niezmienionej, głównie przez przewód pokarmowy. Istnieje zatem potencjalne ryzyko, że każdy proces spowalniający tranzyt jelitowy może prowadzić do reabsorpcji i gromadzenia się leku [55].
U pacjentów z naczyniakami powierzchownymi skuteczne jest także leczenie miejscowe z zastosowaniem 0,5-proc. maleinianu tymololu, który również należy do grupy nieselektywnych leków β-adrenolitycznych [56, 57]. Przeprowadzone badania wykazały, że u pacjentów z powierzchownymi IHs leczenie miejscowe tymololem jest równie skuteczne jak terapia doustna propranolem [57]. Wiąże się również z mniejszym odsetkiem zdarzeń niepożądanych (3,0 proc.). Są to głównie objawy miejscowe o łagodnym przebiegu, choć w bardzo rzadkich przypadkach zgłaszano także występowanie bradykardii, zaburzeń snu i skurczu oskrzeli. Leczenie miejscowe z zastosowaniem tymololu nie jest zalecane w przypadku naczyniaków niemowląt o dużej grubości oraz naczyniaków niemowląt głębokich ze względu na niską skuteczność i większe ryzyko wystąpienia powikłań ogólnoustrojowych. W przyszłości miejscowo stosowany tymolol może odgrywać rolę w terapii sekwencyjnej, umożliwiając skrócenie czasu leczenia propranololem [58, 59].
Przez wiele lat filarem leczenia były glikokortykosteroidy, ale ze względu na ryzyko wystąpienia działań niepożądanych nie są już stosowane jako leki pierwszego rzutu [2]. Prednizon lub prednizolon jest obecnie zalecany tylko w przypadku, kiedy występują przeciwwskazania do leczenia propranololem. Jeśli naczyniak jest umiejscowiony w okolicy kluczowych struktur anatomicznych, np. na wardze, lekarze powinni rozważyć doogniskowe podawanie triamcynolonu i/lub betametazonu [2, 60, 61].
Wyniki badań dotyczących stosowania laseroterapii w leczeniu IHs są niespójne. Pulsacyjny laser barwnikowy (PDL) o długości fali 595 nm jest najczęściej stosowany w leczeniu powierzchownych IHs, natomiast laser Nd:YAG o dłuższej fali 1064 nm jest bardziej odpowiedni w terapii głębiej położonych IHs [46, 47]. Potwierdzono także skuteczność lasera naczyniowego w leczeniu teleangiektazji po ustąpieniu IHs [46, 62, 63].
Wnioski
Na przestrzeni ostatniego dziesięciolecia nastąpił ogromny rozwój wiedzy w dziedzinie naczyniaków niemowląt. Lepiej poznano patofizjologię tej jednostki chorobowej, zdefiniowano nowe czynniki ryzyka i opisano różne postacie kliniczne naczyniaków niemowląt. Wykazano także, że naczyniaki niemowląt można skutecznie leczyć β-adrenolitykami, co otworzyło nowe opcje terapeutyczne.
Konflikt interesów
Autorzy nie zgłaszają konfliktu interesów.
Piśmiennictwo
1. Munden A., Butschek R., Tom W.L., Marshall J.S., Poeltler D.M., Krohne S.E., et al.: Prospective study of infantile haemangiomas: incidence, clinical characteristics and association with placental anomalies. Br J Dermatol 2014, 170, 907-913.
2. Krowchuk D.P., Frieden I.J., Mancini A.J., Darrow D.H., Blei F., Greene A.K., et al.: Clinical practice guideline for the management of infantile hemangiomas. Pediatrics 2019, 143, e20183475.
3. Wassef M., Blei F., Adams D., Alomari A., Baselga E., Berenstein A., et al.: Vascular anomalies classification: recommendations from the International Society for the Study of Vascular Anomalies. Pediatrics 2015, 136, e203-e214.
4. Haggstrom A.N., Drolet B.A., Baselga E., Chamlin S.L., Garzon M.C., Horii K.A., et al.: Prospective study of infantile hemangiomas: clinical characteristics predicting complications and treatment. Pediatrics 2006, 118, 882-887.
5. Kilcline C., Frieden I.J.: Infantile hemangiomas: how common are they? A systematic review of the medical literature. Pediatr Dermatol 2008, 25, 168-173.
6. Haggstrom A.N., Drolet B.A., Baselga E., Chamlin S.L., Garzon M.C., Horii K.A., et al.: Prospective study of infantile hemangiomas: demographic, prenatal, and perinatal characteristics. J Pediatr 2007, 150, 291-294.
7. Goelz R., Poets C.F.: Incidence and treatment of infantile haemangioma in preterm infants. Arch Dis Child Fetal Neonatal Ed 2015, 100, F85-91.
8. Castrén E., Salminen P., Gissler M., Stefanovic V., Pitkäranta A., Klockars T.: Risk factors and morbidity of infantile haemangioma: preterm birth promotes ulceration. Acta Paediatr 2016, 105, 940-945.
9. Campbell J.M., Banta-Wright S.A.: Neonatal skin disorders: a review of selected dermatologic abnormalities. J Perinat Neonatal Nurs 2000, 14, 63-83.
10. Blei F., Walter J., Orlow S.J., Marchuk D.A.: Familial segregation of hemangiomas and vascular malformations as an autosomal dominant trait. Arch Dermatol 1998, 134, 718-722.
11. Walter J.W., North P.E., Waner M., Mizeracki A., Blei F., Walker J.W., et al.: Somatic mutation of vascular endothelial growth factor receptors in juvenile hemangioma. Genes Chromosomes Cancer 2002, 33, 295-303.
12. Boye E., Yu Y., Paranya G., Mulliken J.B., Olsen B.R., Bischoff J.: Clonality and altered behavior of endothelial cells from hemangiomas. J Clin Invest 2001, 107, 745-752.
13. Nguyen V.A., Fürhapter C., Romani N., Weber F., Sepp N.: Infantile hemangioma is a proliferation of beta 4-negative endothelial cells adjacent to HLA-DR-positive cells with dendritic cell morphology. Hum Pathol 2004, 35, 739-744.
14. Bielenberg D.R., Bucana C.D., Sanchez R., Mulliken J.B., Folkman J., Fidler I.J.: Progressive growth of infantile cutaneous hemangiomas is directly correlated with hyperplasia and angiogenesis of adjacent epidermis and inversely correlated with expression of the endogenous angiogenesis inhibitor, IFN-beta. Int J Oncol 1999, 14, 401-408.
15. Yu Y., Flint A.F., Mulliken J.B., Wu J.K., Bischoff J.: Endothelial progenitor cells in infantile hemangioma. Blood 2004, 103, 1373-1375.
16. Ritter M.R., Dorrell M.I., Edmonds J., Friedlander S.F., Friedlander M.: Insulin-like growth factor 2 and potential regulators of hemangioma growth and involution identified by large-scale expression analysis. Proc Natl Acad Sci USA 2002, 99, 7455-7460.
17. Colonna V., Resta L., Napoli A., Bonifazi E.: Placental hypoxia and neonatal haemangioma: clinical and histological observations. Br J Dermatol 2010, 162, 208-209.
18. de Jong S., Itinteang T., Withers A.H., Davis P.F., Tan S.T.: Does hypoxia play a role in infantile hemangioma? Arch Dermatol Res 2016, 308, 219-227.
19. North P.E., Waner M., Mizeracki A., Mrak R.E., Nicholas R., Kincannon J., et al.: A unique microvascular phenotype shared by juvenile hemangiomas and human placenta. Arch Dermatol 2001, 137, 559-570.
20. Herbert A., Ng H., Jessup W., Kockx M., Cartland S., Thomas S.R., et al.: Hypoxia regulates the production and activity of glucose transporter-1 and indoleamine 2,3-dioxygenase in monocyte-derived endothelial-like cells: possible relevance to infantile haemangioma pathogenesis. Br J Dermatol 2011, 164, 308-315.
21. Drolet B.A., Frieden I.J.: Characteristics of infantile hemangiomas as clues to pathogenesis: does hypoxia connect the dots? Arch Dermatol 2010, 146, 1295-1299.
22. Itinteang T., Withers A.H., Davis P.F., Tan S.T.: Biology of infantile hemangioma. Front Surg 2014, 1, 38.
23. Barnés C.M., Huang S., Kaipainen A., Sanoudou D., Chen E.J., Eichler G.S., et al.: Evidence by molecular profiling for a placental origin of infantile hemangioma. Proc Natl Acad Sci USA 2005, 102, 19097-19102.
24. Itinteang T., Brasch H.D., Tan S.T., Day D.J.: Expression of components of the renin-angiotensin system in proliferating infantile haemangioma may account for the propranolol-induced accelerated involution. J Plast Reconstr Aesthet Surg 2011, 64, 759-765.
25. Fiselier T.J., Lijnen P., Monnens L., van Munster P., Jansen M., Peer P.: Levels of renin, angiotensin I and II, angiotensin-converting enzyme and aldosterone in infancy and childhood. Eur J Pediatr 1983, 141, 3-7.
26. Broughton Pipkin F., Smales O.R., O’Callaghan M.: Renin and angiotensin levels in children. Arch Dis Child 1981, 56, 298-302.
27. Stephenson T.J., Broughton Pipkin F., Elias-Jones A.C.: Factors influencing plasma renin and renin substrate in premature infants. Arch Dis Child 1991, 66, 1150-1154.
28. Bruckner A.L., Frieden I.J.: Hemangiomas of infancy. J Am Acad Dermatol 2003, 48, 477-493.
29. Drolet B.A., Esterly N.B., Frieden I.J.: Hemangiomas in children. N Engl J Med 1999, 341, 173-181.
30. Léauté-Labrèze C., Harper J.I., Hoeger P.H.: Infantile haemangioma. Lancet 2017, 390, 85-94.
31. Rodriguez Bandera A., Sebaratnam D.F., Wargon O., Wong L.C.: Infantile hemangioma. Part 1: epidemiology, pathogenesis, clinical presentation and assessment. J Am Acad Dermatol 2021, 85, 1379-1392.
32. Baselga E., Roe E., Coulie J., Muñoz F.Z., Boon L.M., McCuaig C., et al.: Risk factors for degree and type of sequelae after involution of untreated hemangiomas of infancy. JAMA Dermatol 2016, 152, 1239-1243.
33. Couto R.A., Maclellan R.A., Zurakowski D., Greene A.K.: Infantile hemangioma: clinical assessment of the involuting phase and implications for management. Plast Reconstr Surg 2012, 130, 619-624.
34. Chang L.C., Haggstrom A.N., Drolet B.A., Baselga E., Chamlin S.L., Garzon M.C., et al.: Growth characteristics of infantile hemangiomas: implications for management. Pediatrics 2008, 122, 360-367.
35. Hand J.L., Frieden I.J.: Vascular birthmarks of infancy: resolving nosologic confusion. Am J Med Genet 2002, 108, 257-264.
36. Frieden I.J., Eichenfield L.F., Esterly N.B., Geronemus R., Mallory S.B.: Guidelines of care for hemangiomas of infancy. American Academy of Dermatology Guidelines/Outcomes Committee. J Am Acad Dermatol 1997, 37, 631-637.
37. Chiller K.G., Passaro D., Frieden I.J.: Hemangiomas of infancy: clinical characteristics, morphologic subtypes, and their relationship to race, ethnicity, and sex. Arch Dermatol 2002, 138, 1567-1576.
38. Haggstrom A.N., Lammer E.J., Schneider R.A., Marcucio R., Frieden I.J.: Patterns of infantile hemangiomas: new clues to hemangioma pathogenesis and embryonic facial development. Pediatrics 2006, 117, 698-703.
39. Garzon M.C., Epstein L.G., Heyer G.L., Frommelt P.C., Orbach D.B., Baylis A.L., et al.: PHACE syndrome: consensus-derived diagnosis and care recommendations. J Pediatr 2016, 178, 24-33.
40. Chamlin S.L., Haggstrom A.N., Drolet B.A., Baselga E., Frieden I.J., Garzon M.C., et al.: Multicenter prospective study of ulcerated hemangiomas. J Pediatr 2007, 151, 684-689.
41. Schwartz S.R., Blei F., Ceisler E., Steele M., Furlan L., Kodsi S.: Risk factors for amblyopia in children with capillary hemangiomas of the eyelids and orbit. J AAPOS 2006, 10, 262-268.
42. Thomas M.W., Burkhart C.N., Vaghani S.P., Morrell D.S., Wagner A.M.: Failure to thrive in infants with complicated facial hemangiomas. Pediatr Dermatol 2012, 29, 49-52.
43. Schneider M.H., Garcia C.F.V., Aleixo P.B., Kiszewski A.E.: Congenital cutaneous pyogenic granuloma: report of two cases and review of the literature. J Cutan Pathol 2019, 46, 691-697.
44. Ţarcă E., Cojocaru E., Roşu S.T., Butnariu L.I., Plămădeală P., Moisă Ş.M.: Differential diagnosis difficulties related to infantile hemangioma – case report and literature review. Rom J Morphol Embryol 2019, 60, 1375-1379.
45. Sznurkowska K., Wyrzykowski D., Kamińska B.: Naczyniaki u dzieci – problem interdyscyplinarny. Forum Med Rodz 2011, 5, 460-467.
46. Hoeger P.H., Harper J.I., Baselga E., Bonnet D., Boon L.M., Ciofi Degli Atti M., et al.: Treatment of infantile haemangiomas: recommendations of a European expert group. Eur J Pediatr 2015, 174, 855-865.
47. Sebaratnam D.F., Rodríguez Bandera A.L., Wong L.F., Wargon O.J.: Infantile hemangioma. Part 2: Management. J Am Acad Dermatol 2021, 85, 1395-1404.
48. Leaute-Labreze C., Baselga Torres E., Weibel L., Boon L.M., El Hachem M., van der Vleuten C., et al.: The infantile hemangioma referral score: a validated tool for physicians. Pediatrics 2020, 145, e20191628.
49. Janmohamed S.R., de Waard-van der Spek F.B., Madern G.C., de Laat P.C., Hop W.C., Oranje A.P.: Scoring the proliferative activity of haemangioma of infancy: the Haemangioma Activity Score (HAS). Clin Exp Dermatol 2011, 36, 715-723.
50. Moyakine A.V., Herwegen B., van der Vleuten C.J.M.: Use of the Hemangioma Severity Scale to facilitate treatment decisions for infantile hemangiomas. J Am Acad Dermatol 2017, 77, 868-873.
51. Hogeling M., Adams S., Wargon O.: A randomized controlled trial of propranolol for infantile hemangiomas. Pediatrics 2011, 128, e259-e266.
52. Léauté-Labrèze C., Hoeger P., Mazereeuw-Hautier J., Guibaud L., Baselga E., Posiunas G., et al.: A randomized, controlled trial of oral propranolol in infantile hemangioma. N Engl J Med 2015, 372, 735-746.
53. Wu H., Wang X., Zheng J., Zhang L., Li X., Yuan W.E., et al.: Propranolol-loaded mesoporous silica nanoparticles for treatment of infantile hemangiomas. Adv Healthc Mater 2019, 8, e1801261.
54. Bayart C.B., Tamburro J.E., Vidimos A.T., Wang L., Golden A.B.: Atenolol versus propranolol for treatment of infantile hemangiomas during the proliferative phase: a retrospective noninferiority study. Pediatr Dermatol 2017, 34, 413-421.
55. Pope E., Chakkittakandiyil A., Lara-Corrales I., Maki E., Weinstein M.: Expanding the therapeutic repertoire of infantile haemangiomas: cohort-blinded study of oral nadolol compared with propranolol. Br J Dermatol 2013, 168, 222-224.
56. Semkova K., Kazandjieva J.: Topical timolol maleate for treatment of infantile haemangiomas: preliminary results of a prospective study. Clin Exp Dermatol 2013, 38, 143-146.
57. Moehrle M., Léauté-Labrèze C., Schmidt V., Röcken M., Poets C.F., Goelz R.: Topical timolol for small hemangiomas of infancy. Pediatr Dermatol 2013, 30, 245-249.
58. Marey H.M., Elmazar H.F., Mandour S.S., Khairy H.A.: Combined oral and topical beta blockers for the treatment of early proliferative superficial periocular infantile capillary hemangioma. J Pediatr Ophthalmol Strabismus 2018, 55, 37-42.
59. Muñoz-Garza F.Z., Ríos M., Roé-Crespo E., Bernabeu-Wittel J., Montserrat-García M.T., Puig L., et al.: Efficacy and safety of topical timolol for the treatment of infantile hemangioma in the early proliferative stage: a randomized clinical trial. JAMA Dermatol 2021, 157, 583-587.
60. Couto J.A., Greene A.K.: Management of problematic infantile hemangioma using intralesional triamcinolone: efficacy and safety in 100 infants. J Plast Reconstr Aesthet Surg 2014, 67, 1469-1474.
61. Greene A.K., Couto R.A.: Oral prednisolone for infantile hemangioma: efficacy and safety using a standardized treatment protocol. Plast Reconstr Surg 2011, 128, 743-752.
62. Kwon S.H., Choi J.W., Byun S.Y., Kim B.R., Park K.C., Youn S.W., et al.: Effect of early long-pulse pulsed dye laser treatment in infantile hemangiomas. Dermatol Surg 2014, 40, 405-411.
63. Satterfield K.R., Chambers C.B.: Current treatment and management of infantile hemangiomas. Surv Ophthalmol 2019, 64, 608-618.
Źródło:
Dermatology Review/Przegląd Dermatologiczny 2022, 107, 204-216, DOI: https://doi.org/10.5114/dr.2022.120178
Dermatology Review/Przegląd Dermatologiczny 2022, 107, 204-216, DOI: https://doi.org/10.5114/dr.2022.120178




