Skuteczność i bezpieczeństwo wysokich dawek kwasu ursodezoksycholowego u pacjentów z niealkoholowym zapaleniem wątroby

Jeden z najwybitniejszych badaczy w dziedzinie hepatologii oraz niealkoholowej stłuszczeniowej choroby wątroby (nonalcoholic fatty liver disease – NAFLD) – Vlad Ratziu, przeprowadził randomizowane, kontrolowane badanie nad wpływem wysokich dawek kwasu ursodezoksycholowego (high doses ursodeoxycholic acid – HD-UDCA) na przebieg niealkoholowego stłuszczeniowego zapalenia wątroby (nonalcoholic steatohepatitis – NASH).
Autor artykułu: Marek Waluga Katedra i Klinika Gastroenterologii i Hepatologii, Śląski Uniwersytet Medyczny w Katowicach
Wstęp
Znaczenie badań nad niealkoholową stłuszczeniową chorobą wątroby (nonalcoholic fatty liver disease – NAFLD) i jej bardziej aktywną postacią – niealkoholowym zapaleniem wątroby (nonalcoholic steatohepatitis – NASH) jest ogromne, gdyż choroby te dotyczą dużej części populacji świata, zwłaszcza krajów wysoko rozwiniętych. Obecnie są one najczęściej rozpoznawaną przyczyną przewlekłej choroby wątroby. Ten wzrost częstości występowania jest związany głównie z ogólnoświatową epidemią otyłości i cukrzycy. NASH znamiennie zmniejsza czas przeżycia z powodu powikłań sercowo-naczyniowych [1] i 10-krotnie zwiększa śmiertelność z powodu chorób wątroby [2–5]. Ma przebieg postępujący i może prowadzić do marskości wątroby, niewydolności tego narządu lub bezpośrednio do rozwoju raka wątrobowokomórkowego (hepatocellular carcinoma – HCC). Postępowanie niefarmakologiczne jest u tych chorych niewystarczające, dotąd nie było też wystarczająco skutecznego leku do leczenia NASH.
Dotychczasowe doniesienia
Przesłanką do przeprowadzenia badania Ratziu i wsp. [6] było pytanie, czy kwas ursodezoksycholowy (ursodeoxycholic acid – UDCA) może mieć właściwości przeciwzapalne i przeciwwłóknieniowe oraz czy może zmniejszać uszkodzenie wątroby w przebiegu NASH. Do 2010 r. nie było badań nad wpływem oraz bezpieczeństwem wysokich dawek UDCA (high-dose UDCA – HD-UDCA) u pacjentów z NASH. Wcześniejsze badania podstawowe wykazały, że UDCA zmniejsza przepuszczalność błony mitochondrialnej i uwalnianie enzymów hydrolitycznych z uszkodzonych hepatocytów, a także poprawia oporność na wolne rodniki tlenowe oraz ekspresję antyapoptotycznych ścieżek sygnałowych. UDCA zmniejsza także produkcję prozapalnego TNF-u pacjentów z pierwotnym zapaleniem przewodów żółciowych (PBC, dawniej pierwotna żółciowa marskość wątroby), zmniejsza poziom osoczowy TGF- odnawia aktywność uszkodzonych komórek NK (natural killer cells) i może hamować włóknienie u pacjentów z NASH.
Wcześniejsze badania kliniczne, choć dawały niejednoznaczne wyniki, wskazywały, że UDCA obniża aktywność aminotransferazy alaninowej (ALT) i -glutamylotranspeptydazy (GGTP) oraz zmniejsza stłuszczenie wątroby, a połączenie UDCA z witaminą E znamiennie zmniejsza poziom ALT i stopień stłuszczenia.
Przebieg badania
Ratziu wraz z zespołem przeprowadził 12-miesięczne, randomizowane, kontrolowane, wieloośrodkowe (15 ośrodków francuskich) badanie obejmujące 126 pacjentów z NASH potwierdzonym na podstawie badania histopatologicznego bioptatów wątroby oraz z podwyższoną aktywnością ALT. Kryterium kwalifikacji do badania było stwierdzenie aktywności ALT > 50 IU/l przynajmniej 3-krotnie w ciągu 12 miesięcy poprzedzających włączenie do badania oraz wynik biopsji wątroby (wykonanej w ciągu 18 miesięcy poprzedzających włączenie do badania) spełniający histologiczne kryteria NASH, m.in. stłuszczenie powyżej 20% hepatocytów, zwyrodnienie balonowate hepatocytów i/lub martwica międzyzrazikowa. Pacjenci otrzymywali UDCA w wysokich dawkach (28–35 mg/kg m.c./dobę) – HD-UDCA. Pierwszym punktem końcowym badania była redukcja aktywności ALT u pacjentów leczonych HD-UDCA w porównaniu z placebo. Drugim punktem końcowym była normalizacja ALT, względne zmniejszenie wskaźników osoczowych włóknienia i zapalenia wątroby, a także bezpieczeństwo i tolerancja HD-UDCA.
Wyniki
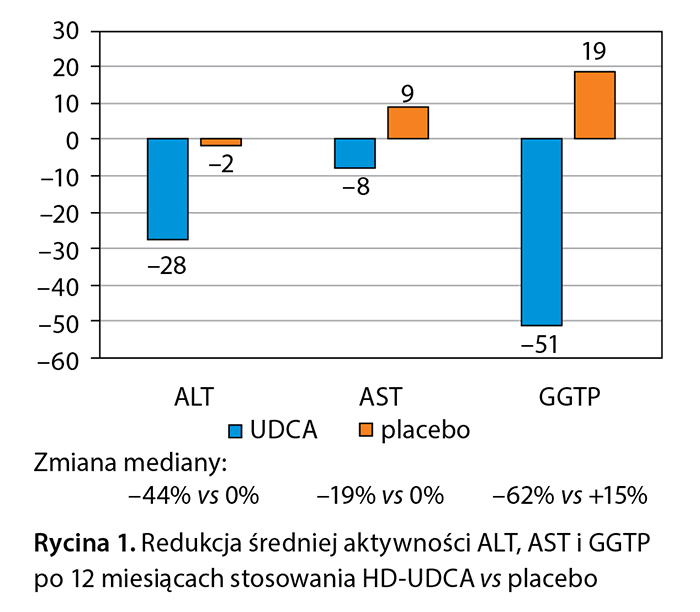
Po 12 miesiącach leczenia w grupie otrzymującej HD-UDCA uzyskano znamienne zmniejszenie średniej aktywności ALT – o 28,3% w stosunku do wartości wyjściowych w porównaniu z redukcją o 1,6% średniej aktywności tego enzymu w grupie otrzymującej placebo (p < 0,001), zmniejszenie średniej aktywności aminotransferazy asparaginowej (AST) o 8% w stosunku do wartości wyjściowych vs wzrost o 9% w grupie placebo oraz zmniejszenie aktywności GGTP o 51% w stosunku do wartości wyjściowej vs wzrost o 19% w grupie placebo (ryc. 1). Również redukcja mediany ALT była znamienna (–43,5%) w porównaniu z placebo (–0,4%), p < 0,001. Zmniejszenie mediany aktywności ALT po 12 miesiącach leczenia wynosiło w stosunku do wartości wyjściowych 33,9% w grupie HD-UDCA vs 3,1% w grupie placebo (p < 0,001). Pod koniec badania normalizację poziomu ALT (≤ 35 IU/l) uzyskano u 24,5% pacjentów leczonych HD-UDCA i u 4,8% pacjentów, którzy otrzymywali placebo (p = 0,003).
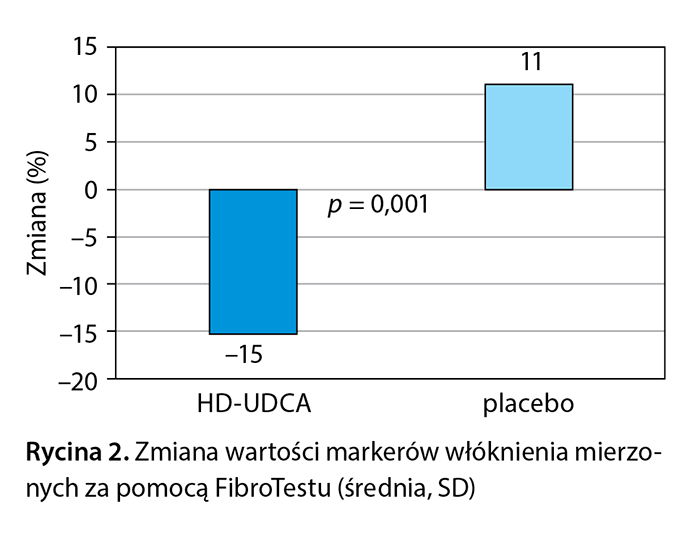
Przyjmowanie HD-UDCA znamiennie obniżało poziom markerów włóknienia mierzonych FibroTestem w porównaniu z placebo (p < 0,001). Spadek wynosił 18,0% po 6 miesiącach i 10,5% po 12 miesiącach u pacjentów leczonych HD-UDCA, podczas gdy w grupie placebo odnotowano wzrost odpowiednio o 3,8% i 9,6% (p < 0,006 w obu punktach czasowych). Wydaje się, że pacjenci bez zaawansowanego włóknienia odnieśli większą korzyść z leczenia HD-UDCA. W tej grupie średnie wartości FibroTestu spadły o 15% w porównaniu ze wzrostem o 11,2% w grupie placebo (p = 0,001) (ryc. 2). Zmiana mediany wyników FibroTestu w grupie osób z zaawansowanym włóknieniem wyniosła: –19,7% po 3 miesiącach, –19,2% po 6 miesiącach, –18,6% po 9 miesiącach i –18,9% w 12. miesiącu w grupie leczonych HD-UDCA, w porównaniu z odpowiednio 0%, +7,3%, –2,5% i 0% w grupie placebo. Poprawa tych wartości nie była zależna od zmian masy ciała.
Leczenie za pomocą HD-UDCA powodowało znamienny spadek poziomu GGTP (zmiana mediany –62% vs +15% w ramieniu z placebo). Nie obserwowano istotnych różnic w aktywności fosfatazy alkalicznej (ALP), bilirubiny całkowitej i stężeniu kwasu hialuronowego pomiędzy grupami. Również w zakresie cholesterolu HDL, cholesterolu LDL, cholesterolu całkowitego i trójglicerydów nie zauważono istotnych różnic między grupami.
Wysokie dawki UDCA znacząco poprawiły kontrolę glikemii oraz wskaźniki oporności na insulinę. Zaobserwowano istotne zmniejszenie osoczowego stężenia glukozy, hemoglobiny glikozylowanej i osoczowego stężenia insuliny oraz wartości HOMA (homeostatic model assessment scores) w porównaniu z grupą placebo.
Większość pacjentów włączonych do badania nie zgłaszała żadnych objawów ubocznych ani przed, ani w trakcie terapii HD-UDCA, a liczba tych, u których występowały jakieś objawy, była porównywalna w grupie HD-UDCA i placebo. Zaobserwowano natomiast trend do zmniejszenia astenii i bólu w prawym kwadrancie brzucha oraz wzdęcia u pacjentów leczonych HD-UDCA.
Podsumowanie i wnioski
Wcześniejsze badania wykazały, że zmiany aktywności ALT podczas leczenia UDCA wskazują na zmiany stopnia zapalenia, ale nie stłuszczenia czy włóknienia. Omawiane badanie Ratziu i wsp. poprzez szczegółowe badanie parametrów laboratoryjnych, zwłaszcza aktywności ALT, wskazało, że leczenie HD-UDCA zmniejsza nasilenie zmian martwiczo-zapalnych w wątrobie i może mieć działanie hepatoprotekcyjne. Autorzy sugerują ponadto, że wyższe dawki UDCA mogą powodować istotniejsze efekty biologiczne u pacjentów z NASH, widoczne bardziej niż w przypadku pacjentów z innymi chorobami. Standardowe dawki UDCA nie są silnym modulatorem receptorów TGR-5, receptorów farnezoidowych X typu lub małego partnera heterodimerowego, podczas gdy wyższe dawki UDCA mogą powodować znamienną modulację tych receptorów jądrowych i komórkowych. Co więcej, UDCA skoniugowane z tauryną redukują stres retikulum endoplazmatycznego występujący w otyłości i poprawiają działanie insuliny w wątrobie, co pozwala odzyskiwać insulinowrażliwość i zmniejszać stopień stłuszczenia, przynajmniej w badaniach eksperymentalnych.
Stwierdzony w badaniu Ratziu i wsp. fakt lepszego działania HD-UDCA w przypadku pacjentów z mniej zaawansowanym włóknieniem jest zrozumiały, ponieważ wiadomo, że bardziej zaawansowane włóknienie jest niemal nieodwracalne. Dlatego korzyści można uzyskać głównie w mniej zaawansowanych stadiach choroby. Z drugiej strony ze względów statystyczno-epidemiologicznych jest to korzystne, ponieważ większość pacjentów z NASH ma zmiany mniej zaawansowane. Dlatego leczenie przy użyciu HD-UDCA może potencjalnie przynieść efekty w większej grupie pacjentów.
Badanie Ratziu i wsp. jest bardzo ważne w hepatologii, wskazuje na korzystny wpływ zastosowania HD-UDCA na parametry wątrobowe i metaboliczne, a także na zmniejszenie włóknienia u pacjentów z NASH, szczególnie w mniej zaawansowanym stadium. Jednocześnie wykazało, że stosowanie HD-UDCA jest bezpieczne i nie wiąże się ze zwiększeniem ilości objawów ubocznych.
Piśmiennictwo:
1. Lomonaco R, Chen J, Cusi K. An endocrine perspective of nonalcoholic fatty liver disease (NAFLD). Ther Adv Endocrinol Metab 2011; 2: 211-225.
2. Adams LA, Lymp JF, St. Sauver J i wsp. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology 2005; 129: 113-121.
3. Ekstedt M, Franzen LE, Mathiesen UL i wsp. Long-term follow-up of patients with NAFLD and elevated liver enzymes. Hepatology 2006; 44: 865-873.
4. Jepsen P, Vilstrup H, Mellemkjaer L i wsp. Prognosis of patients with a diagnosis of fatty liver – a registry-based cohort study. Hepatogastroenterology 2003; 50: 2101-2104.
5. Soderberg C, Stal P, Askling J i wsp. Decreased survival of subjects with elevated liver function tests during a 28-year follow-up. Hepatology 2010; 51: 595-602.
6. de Ledinghen V, Oberti F i wsp. A randomized controlled trial of high-dose ursodesoxycholic acid for nonalcoholic steatohepatitis. J Hepatol 2011; 54: 1011–1019.
1. Lomonaco R, Chen J, Cusi K. An endocrine perspective of nonalcoholic fatty liver disease (NAFLD). Ther Adv Endocrinol Metab 2011; 2: 211-225.
2. Adams LA, Lymp JF, St. Sauver J i wsp. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology 2005; 129: 113-121.
3. Ekstedt M, Franzen LE, Mathiesen UL i wsp. Long-term follow-up of patients with NAFLD and elevated liver enzymes. Hepatology 2006; 44: 865-873.
4. Jepsen P, Vilstrup H, Mellemkjaer L i wsp. Prognosis of patients with a diagnosis of fatty liver – a registry-based cohort study. Hepatogastroenterology 2003; 50: 2101-2104.
5. Soderberg C, Stal P, Askling J i wsp. Decreased survival of subjects with elevated liver function tests during a 28-year follow-up. Hepatology 2010; 51: 595-602.
6. de Ledinghen V, Oberti F i wsp. A randomized controlled trial of high-dose ursodesoxycholic acid for nonalcoholic steatohepatitis. J Hepatol 2011; 54: 1011–1019.
Wstęp
Znaczenie badań nad niealkoholową stłuszczeniową chorobą wątroby (nonalcoholic fatty liver disease – NAFLD) i jej bardziej aktywną postacią – niealkoholowym zapaleniem wątroby (nonalcoholic steatohepatitis – NASH) jest ogromne, gdyż choroby te dotyczą dużej części populacji świata, zwłaszcza krajów wysoko rozwiniętych. Obecnie są one najczęściej rozpoznawaną przyczyną przewlekłej choroby wątroby. Ten wzrost częstości występowania jest związany głównie z ogólnoświatową epidemią otyłości i cukrzycy. NASH znamiennie zmniejsza czas przeżycia z powodu powikłań sercowo-naczyniowych [1] i 10-krotnie zwiększa śmiertelność z powodu chorób wątroby [2–5]. Ma przebieg postępujący i może prowadzić do marskości wątroby, niewydolności tego narządu lub bezpośrednio do rozwoju raka wątrobowokomórkowego (hepatocellular carcinoma – HCC). Postępowanie niefarmakologiczne jest u tych chorych niewystarczające, dotąd nie było też wystarczająco skutecznego leku do leczenia NASH.
Dotychczasowe doniesienia
Przesłanką do przeprowadzenia badania Ratziu i wsp. [6] było pytanie, czy kwas ursodezoksycholowy (ursodeoxycholic acid – UDCA) może mieć właściwości przeciwzapalne i przeciwwłóknieniowe oraz czy może zmniejszać uszkodzenie wątroby w przebiegu NASH. Do 2010 r. nie było badań nad wpływem oraz bezpieczeństwem wysokich dawek UDCA (high-dose UDCA – HD-UDCA) u pacjentów z NASH. Wcześniejsze badania podstawowe wykazały, że UDCA zmniejsza przepuszczalność błony mitochondrialnej i uwalnianie enzymów hydrolitycznych z uszkodzonych hepatocytów, a także poprawia oporność na wolne rodniki tlenowe oraz ekspresję antyapoptotycznych ścieżek sygnałowych. UDCA zmniejsza także produkcję prozapalnego TNF-u pacjentów z pierwotnym zapaleniem przewodów żółciowych (PBC, dawniej pierwotna żółciowa marskość wątroby), zmniejsza poziom osoczowy TGF- odnawia aktywność uszkodzonych komórek NK (natural killer cells) i może hamować włóknienie u pacjentów z NASH.

Wcześniejsze badania kliniczne, choć dawały niejednoznaczne wyniki, wskazywały, że UDCA obniża aktywność aminotransferazy alaninowej (ALT) i -glutamylotranspeptydazy (GGTP) oraz zmniejsza stłuszczenie wątroby, a połączenie UDCA z witaminą E znamiennie zmniejsza poziom ALT i stopień stłuszczenia.
Przebieg badania
Ratziu wraz z zespołem przeprowadził 12-miesięczne, randomizowane, kontrolowane, wieloośrodkowe (15 ośrodków francuskich) badanie obejmujące 126 pacjentów z NASH potwierdzonym na podstawie badania histopatologicznego bioptatów wątroby oraz z podwyższoną aktywnością ALT. Kryterium kwalifikacji do badania było stwierdzenie aktywności ALT > 50 IU/l przynajmniej 3-krotnie w ciągu 12 miesięcy poprzedzających włączenie do badania oraz wynik biopsji wątroby (wykonanej w ciągu 18 miesięcy poprzedzających włączenie do badania) spełniający histologiczne kryteria NASH, m.in. stłuszczenie powyżej 20% hepatocytów, zwyrodnienie balonowate hepatocytów i/lub martwica międzyzrazikowa. Pacjenci otrzymywali UDCA w wysokich dawkach (28–35 mg/kg m.c./dobę) – HD-UDCA. Pierwszym punktem końcowym badania była redukcja aktywności ALT u pacjentów leczonych HD-UDCA w porównaniu z placebo. Drugim punktem końcowym była normalizacja ALT, względne zmniejszenie wskaźników osoczowych włóknienia i zapalenia wątroby, a także bezpieczeństwo i tolerancja HD-UDCA.
Wyniki
Po 12 miesiącach leczenia w grupie otrzymującej HD-UDCA uzyskano znamienne zmniejszenie średniej aktywności ALT – o 28,3% w stosunku do wartości wyjściowych w porównaniu z redukcją o 1,6% średniej aktywności tego enzymu w grupie otrzymującej placebo (p < 0,001), zmniejszenie średniej aktywności aminotransferazy asparaginowej (AST) o 8% w stosunku do wartości wyjściowych vs wzrost o 9% w grupie placebo oraz zmniejszenie aktywności GGTP o 51% w stosunku do wartości wyjściowej vs wzrost o 19% w grupie placebo (ryc. 1). Również redukcja mediany ALT była znamienna (–43,5%) w porównaniu z placebo (–0,4%), p < 0,001. Zmniejszenie mediany aktywności ALT po 12 miesiącach leczenia wynosiło w stosunku do wartości wyjściowych 33,9% w grupie HD-UDCA vs 3,1% w grupie placebo (p < 0,001). Pod koniec badania normalizację poziomu ALT (≤ 35 IU/l) uzyskano u 24,5% pacjentów leczonych HD-UDCA i u 4,8% pacjentów, którzy otrzymywali placebo (p = 0,003).
Przyjmowanie HD-UDCA znamiennie obniżało poziom markerów włóknienia mierzonych FibroTestem w porównaniu z placebo (p < 0,001). Spadek wynosił 18,0% po 6 miesiącach i 10,5% po 12 miesiącach u pacjentów leczonych HD-UDCA, podczas gdy w grupie placebo odnotowano wzrost odpowiednio o 3,8% i 9,6% (p < 0,006 w obu punktach czasowych). Wydaje się, że pacjenci bez zaawansowanego włóknienia odnieśli większą korzyść z leczenia HD-UDCA. W tej grupie średnie wartości FibroTestu spadły o 15% w porównaniu ze wzrostem o 11,2% w grupie placebo (p = 0,001) (ryc. 2). Zmiana mediany wyników FibroTestu w grupie osób z zaawansowanym włóknieniem wyniosła: –19,7% po 3 miesiącach, –19,2% po 6 miesiącach, –18,6% po 9 miesiącach i –18,9% w 12. miesiącu w grupie leczonych HD-UDCA, w porównaniu z odpowiednio 0%, +7,3%, –2,5% i 0% w grupie placebo. Poprawa tych wartości nie była zależna od zmian masy ciała.
Leczenie za pomocą HD-UDCA powodowało znamienny spadek poziomu GGTP (zmiana mediany –62% vs +15% w ramieniu z placebo). Nie obserwowano istotnych różnic w aktywności fosfatazy alkalicznej (ALP), bilirubiny całkowitej i stężeniu kwasu hialuronowego pomiędzy grupami. Również w zakresie cholesterolu HDL, cholesterolu LDL, cholesterolu całkowitego i trójglicerydów nie zauważono istotnych różnic między grupami.
Wysokie dawki UDCA znacząco poprawiły kontrolę glikemii oraz wskaźniki oporności na insulinę. Zaobserwowano istotne zmniejszenie osoczowego stężenia glukozy, hemoglobiny glikozylowanej i osoczowego stężenia insuliny oraz wartości HOMA (homeostatic model assessment scores) w porównaniu z grupą placebo.

Większość pacjentów włączonych do badania nie zgłaszała żadnych objawów ubocznych ani przed, ani w trakcie terapii HD-UDCA, a liczba tych, u których występowały jakieś objawy, była porównywalna w grupie HD-UDCA i placebo. Zaobserwowano natomiast trend do zmniejszenia astenii i bólu w prawym kwadrancie brzucha oraz wzdęcia u pacjentów leczonych HD-UDCA.
Podsumowanie i wnioski
Wcześniejsze badania wykazały, że zmiany aktywności ALT podczas leczenia UDCA wskazują na zmiany stopnia zapalenia, ale nie stłuszczenia czy włóknienia. Omawiane badanie Ratziu i wsp. poprzez szczegółowe badanie parametrów laboratoryjnych, zwłaszcza aktywności ALT, wskazało, że leczenie HD-UDCA zmniejsza nasilenie zmian martwiczo-zapalnych w wątrobie i może mieć działanie hepatoprotekcyjne. Autorzy sugerują ponadto, że wyższe dawki UDCA mogą powodować istotniejsze efekty biologiczne u pacjentów z NASH, widoczne bardziej niż w przypadku pacjentów z innymi chorobami. Standardowe dawki UDCA nie są silnym modulatorem receptorów TGR-5, receptorów farnezoidowych X typu lub małego partnera heterodimerowego, podczas gdy wyższe dawki UDCA mogą powodować znamienną modulację tych receptorów jądrowych i komórkowych. Co więcej, UDCA skoniugowane z tauryną redukują stres retikulum endoplazmatycznego występujący w otyłości i poprawiają działanie insuliny w wątrobie, co pozwala odzyskiwać insulinowrażliwość i zmniejszać stopień stłuszczenia, przynajmniej w badaniach eksperymentalnych.
Stwierdzony w badaniu Ratziu i wsp. fakt lepszego działania HD-UDCA w przypadku pacjentów z mniej zaawansowanym włóknieniem jest zrozumiały, ponieważ wiadomo, że bardziej zaawansowane włóknienie jest niemal nieodwracalne. Dlatego korzyści można uzyskać głównie w mniej zaawansowanych stadiach choroby. Z drugiej strony ze względów statystyczno-epidemiologicznych jest to korzystne, ponieważ większość pacjentów z NASH ma zmiany mniej zaawansowane. Dlatego leczenie przy użyciu HD-UDCA może potencjalnie przynieść efekty w większej grupie pacjentów.
Badanie Ratziu i wsp. jest bardzo ważne w hepatologii, wskazuje na korzystny wpływ zastosowania HD-UDCA na parametry wątrobowe i metaboliczne, a także na zmniejszenie włóknienia u pacjentów z NASH, szczególnie w mniej zaawansowanym stadium. Jednocześnie wykazało, że stosowanie HD-UDCA jest bezpieczne i nie wiąże się ze zwiększeniem ilości objawów ubocznych.
Piśmiennictwo:
1. Lomonaco R, Chen J, Cusi K. An endocrine perspective of nonalcoholic fatty liver disease (NAFLD). Ther Adv Endocrinol Metab 2011; 2: 211-225.
2. Adams LA, Lymp JF, St. Sauver J i wsp. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology 2005; 129: 113-121.
3. Ekstedt M, Franzen LE, Mathiesen UL i wsp. Long-term follow-up of patients with NAFLD and elevated liver enzymes. Hepatology 2006; 44: 865-873.
4. Jepsen P, Vilstrup H, Mellemkjaer L i wsp. Prognosis of patients with a diagnosis of fatty liver – a registry-based cohort study. Hepatogastroenterology 2003; 50: 2101-2104.
5. Soderberg C, Stal P, Askling J i wsp. Decreased survival of subjects with elevated liver function tests during a 28-year follow-up. Hepatology 2010; 51: 595-602.
6. de Ledinghen V, Oberti F i wsp. A randomized controlled trial of high-dose ursodesoxycholic acid for nonalcoholic steatohepatitis. J Hepatol 2011; 54: 1011–1019.
1. Lomonaco R, Chen J, Cusi K. An endocrine perspective of nonalcoholic fatty liver disease (NAFLD). Ther Adv Endocrinol Metab 2011; 2: 211-225.
2. Adams LA, Lymp JF, St. Sauver J i wsp. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology 2005; 129: 113-121.
3. Ekstedt M, Franzen LE, Mathiesen UL i wsp. Long-term follow-up of patients with NAFLD and elevated liver enzymes. Hepatology 2006; 44: 865-873.
4. Jepsen P, Vilstrup H, Mellemkjaer L i wsp. Prognosis of patients with a diagnosis of fatty liver – a registry-based cohort study. Hepatogastroenterology 2003; 50: 2101-2104.
5. Soderberg C, Stal P, Askling J i wsp. Decreased survival of subjects with elevated liver function tests during a 28-year follow-up. Hepatology 2010; 51: 595-602.
6. de Ledinghen V, Oberti F i wsp. A randomized controlled trial of high-dose ursodesoxycholic acid for nonalcoholic steatohepatitis. J Hepatol 2011; 54: 1011–1019.
Źródło:
Lekarz POZ 2/2020 vol. 6
Lekarz POZ 2/2020 vol. 6