Zakażenie dróg moczowych u kobiet

Zakażenie układu moczowego jest jedną z najczęstszych infekcji u kobiet. Może wystąpić w każdym wieku, ale częściej dotyka kobiet ciężarnych i w okresie pomenopauzalnym. Nierzadko towarzyszy zakażeniom pochwy i najczęściej jest wywoływane przez patogeny pochodzące z końcowych odcinków przewodu pokarmowego. Leczenie antybiotykami powinno być prowadzone przez możliwie najkrótszy okres, a dawkowanie i czas trwania terapii zależą od rodzaju zakażenia.
Autorzy: Krzysztof Czajkowski II Katedra i Klinika Położnictwa i Ginekologii, Warszawski Uniwersytet Medyczny, Magdalena Broś-Konopielko II Katedra i Klinika Położnictwa i Ginekologii, Warszawski Uniwersytet Medyczny, Justyna Teliga-Czajkowska Zakład Dydaktyki Ginekologiczno-Położniczej, Wydział Nauk o Zdrowiu, Warszawski Uniwersytet Medyczny
Wstęp
Zakażenie układu moczowego (ZUM) u kobiet jest jedną z najczęstszych infekcji pojawiających się w różnych okresach życia. Zakażenia u kobiet występują znacznie częściej niż u mężczyzn. Czynnikiem sprzyjającym jest przede wszystkim budowa anatomiczna końcowego odcinka układu moczowego i sąsiedztwo narządu rodnego. Cewka moczowa u kobiet jest stosunkowo krótka, a więc droga, jaką muszą przebyć bakterie, też jest mniejsza. Cewka u kobiety uchodzi do przedsionka pochwy. Zakażenia przedsionka pochwy i pochwy u kobiet zdarzają się często. W tym przypadku czynnikami sprzyjającymi są kontakty seksualne i nierzadko nadmierne stosowanie środków do higieny intymnej zaburzających właściwą florę bakteryjną. Bliskość odbytu ułatwia kolonizację zarówno narządu rodnego, jak i dystalnych odcinków układu moczowego przez bakterie Escherichia coli, Enterococcus fecalis i Streptococcus species. Specyficznym okresem, w którym częściej dochodzi do zakażenia dróg moczowych, jest ciąża i okres okołoporodowy. Duża liczba przeprowadzanych współcześnie cięć cesarskich i cewnikowanie okołooperacyjne również sprzyjają zakażeniom. W okresie po menopauzie spadek poziomu estrogenów wtórnie zaburza funkcje nabłonka przedsionka pochwy i pochwy, prowadzi do zmian zanikowych, a niedobory glikogenu sprzyjają zmniejszeniu populacji pałeczek kwasu mlekowego. W efekcie u kobiet po menopauzie nierzadko pochwa zostaje skolonizowana przez inne bakterie, głównie Escherichia coli. Stan ten sprzyja rozprzestrzenieniu się zakażenia na układ moczowy. Dodatkowym czynnikiem sprzyjającym zakażeniom układu moczowego jest obniżenie narządu rodnego i nietrzymanie moczu. Uważa się, że problem ten dotyka ok. 30–50% kobiet po 50. roku życia. Ocenia się, że co druga kobieta przynajmniej raz w życiu przechodzi zakażenie układu moczowego [1, 2]. Uważa się, że objawowe zakażenie dróg moczowych przynajmniej raz w życiu przechodzi 10–60% wszystkich kobiet [3, 4]. Ryzyko zakażenia rośnie wraz z wiekiem [5].
Nawrotowe zakażenie układu moczowego u kobiet jest definiowane jako przebycie przynajmniej 2 zakażeń układu moczowego w ciągu 6 miesięcy lub przynajmniej 3 zakażeń układu moczowego w ciągu 12 miesięcy. Częstość występowania nawracających zakażeń układu moczowego u kobiet jest oceniana na 25–50% [6–9].
Diagnostyka
Zakażenia układu moczowego można ogólnie podzielić na bezobjawowe lub objawowe. Rozpoznanie zakażenia bezobjawowego opiera się na wynikach badań moczu. Ze względu na umiejscowienie ujścia zewnętrznego cewki moczowej u kobiet istotne znaczenie ma właściwe pobranie próbki do badania. Podstawowe znaczenie dla podejrzenia ZUM ma liczba leukocytów – w przypadku powyżej 10/mm3 można podejrzewać zakażenie. Wydaje się, że w ciąży liczba leukocytów stanowiąca podstawę do podejrzenia ZUM powinna być wyższa niż 20/mm3. Zanieczyszczenie wydzieliną z przedsionka pochwy zawierającą śluz i pałeczki kwasu mlekowego może się objawić w postaci opisu w osadzie moczu licznych pasm śluzu i obfitej flory bakteryjnej. Niekiedy większa ilość śluzu jest fałszywie interpretowana jako białkomocz. W okresie miesiączki, połogu lub w przypadku krwawień z macicy próbka moczu może zostać zanieczyszczona krwinkami czerwonymi. W takiej sytuacji niezbędne jest zebranie dokładnego wywiadu i powtórne wykonanie badania moczu po odpowiednim przygotowaniu się pacjentki. Sam wynik ogólnego badania moczu bez towarzyszących objawów klinicznych nie może stanowić podstawy do rozpoczęcia terapii. Badaniem potwierdzającym lub wykluczającym ZUM jest posiew moczu. Ze względu na ryzyko kontaminacji próbka powinna zostać pobrana do sterylnego pojemnika, najlepiej z moczu porannego. Obecność ≥ 105 bakterii w mililitrze (colony forming units per milliliter – CFU/ml) potwierdza zakażenie, a antybiogram pozwala na weryfikację, czy zastosowane leczenie może być skuteczne.
W przypadku podwyższonej liczby leukocytów w osadzie i objawów klinicznych należy rozpocząć leczenie. U kobiet ciężarnych warto pobrać posiew na początku terapii ze względu na zwiększone ryzyko porodów przedwczesnych towarzyszące zakażeniom układu moczowego i ograniczoną liczbę antybiotyków dopuszczonych do stosowania w ciąży. Wskazaniem do leczenia są oczywiście typowe objawy kliniczne. W przypadku braku upławów z pochwy i pieczenia w przedsionku pochwy typowe objawy zapalenia pęcherza moczowego u młodych kobiet są potwierdzalne w 90% [10, 11]. W ok. 15% przypadków posiewy moczu są dodatnie pomimo braku podwyższonej liczby leukocytów w badaniu ogólnym moczu [3].
Specyficzne grupy pacjentek
Menopauza
Podstawowymi przyczynami zwiększonej częstości występowania ZUM w okresie około- i pomenopauzalnym są zmiany hormonalne (niedobór estrogenów) i starzenie się tkanki łącznej (nietrzymanie moczu, obniżenie narządu rodnego). Czynnikami sprzyjającymi zakażeniom dróg moczowych w okresie menopauzalnym są: nietrzymanie moczu (utrudnia właściwą higienę), zmiany zanikowe w błonie śluzowej pochwy (większe ryzyko zakażeń w pochwie i przenoszenia ich do układu moczowego), obniżenie przedniej ściany pochwy (brak pełnego opróżniania pęcherza moczowego). W okresie okołomenopauzalnym i w dalszych latach życia kobiet wzrasta częstość bezobjawowego bakteriomoczu – 4–19% w porównaniu z 1,5% kobiet w okresie przed menopauzą [12]. W okresie około- i pomenopauzalnym niedobory estrogenów mogą sprzyjać nietrzymaniu moczu i zakażeniom układu moczowego. Wykazano, że podawanie estrogenów miejscowo do pochwy (ale nie ogólnie) znamiennie zmniejsza ryzyko bakteriurii (OR = 0,3, 95% CI: 0,13–0,68) [13]. Celowość stosowania miejscowego estrogenów u kobiet w okresie około- i pomenopauzalnym w celu przeciwdziałania zakażeniom układu moczowego potwierdzają zalecenia towarzystw naukowych [14].
Istotnym czynnikiem ryzyka zakażenia dróg moczowych u kobiet po menopauzie jest cukrzyca [15, 16]. W badaniach łącznie 256 725 kobiet z cukrzycą typu 2 ZUM rozpoznawano znacznie częściej od wieku 45–49 lat, przy czym w porównaniu z młodszymi kobietami był to wzrost o ok. 100%, a w wieku 50–54 lat o kolejne ok. 80% [16]. Porównano dwie grupy kobiet w wieku 55–75 lat z ostrym zakażeniem układu moczowego – 901 pacjentek z cukrzycą i 913 pacjentek z grupy kontrolnej [15]. Obecność cukrzycy u kobiet po menopauzie zwiększała ryzyko ZUM dwukrotnie (OR = 2,2, 95% CI: 1,5–3,1). Czynnikami o istotnym znaczeniu były konieczność leczenia lekami doustnymi lub insuliną (OR odpowiednio 2,8 i 2,7) i typ 2 cukrzycy (OR = 2,2). Bez znaczenia pozostawały czas trwania cukrzycy i stopień wyrównania glikemii oceniany poprzez oznaczanie hemoglobiny glikowanej (HbA1c). U osób po 57. roku życia rośnie też ryzyko infekcji dróg moczowych w przebiegu pooperacyjnym [17].
Cukrzyca
Cukrzyca, szczególnie nieprawidłowo wyrównana, to czynnik ryzyka zakażeń zarówno układu moczowego, jak i rozrodczego (srom, przedsionek pochwy, pochwa). Zakażenia dróg moczowych stwierdzano u 14% kobiet z cukrzycą typu 1 i u 23% z cukrzycą typu 2 [18]. Czynnikiem o podstawowym znaczeniu jest stopień wyrównania glikemii i obecność cukromoczu. Poza tym częściej zakażenia są obserwowane u kobiet w wieku okołomenopauzalnym z dłużej trwającą cukrzycą. W dobrze udokumentowanych badaniach 1357 kobiet z cukrzycą typu 1 stwierdzono częstsze występowanie ostrego zapalenia: pęcherza moczowego (OR = 1,46, 95% CI: 1,10–1,95, p = 0,001), pochwy (OR = 1,20, 95% CI: 1,01–1,42, p = 0,044) i sromu (OR = 2,12, 95% CI: 1,56–2,90, p < 0,001) [10]. W grupie 241 kobiet z cukrzycą typu 1 podstawowymi czynnikami ryzyka zakażenia objawowego były stosunek seksualny, stosowanie doustnej antykoncepcji i obecność mikroangiopatii [18]. Dodatkowym czynnikiem sprzyjającym mogło być częściej występujące u kobiet z cukrzycą typu 1 nietrzymanie moczu (OR = 1,64, 95% CI: 1,19–2,26, p = 0,001) [10]. U chorych na cukrzycę typu 2 bezobjawowa bakteriuria występuje częściej niż u zdrowych osób (17,5% vs 10%, p = 0,015). W ciągu 6 miesięcy u 20% osób bezobjawowa bakteriuria może się przerodzić w objawowe ZUM [19, 20]. Również w innych badaniach obejmujących 348 kobiet z cukrzycą typu 2 bezobjawowa bakteriuria była podstawowym czynnikiem ryzyka zakażenia objawowego [18]. Może również prowadzić do pogorszenia czynności nerek [21]. Zaprezentowane dane wskazują na konieczność okresowej kontroli posiewu moczu u chorych na cukrzycę, szczególnie typu 2.
Padaczka
Zauważono, że pacjenci chorzy na padaczkę częściej wymagają leczenia zakażeń dróg moczowych [22]. Problem dotyczy ok. 58% kobiet i 42% mężczyzn z padaczką (p < 0,0001). Poszukiwania przyczyn takiego stanu rzeczy wskazały, że czynnikiem mającym istotne znaczenie dla zwiększonej częstości zakażeń dróg moczowych u chorych na padaczkę są zalecane leki. Częściej infekcje obserwowano u pacjentów, u których stosowano: fenytoinę (OR = 1,78, 95% CI: 1,24–2,55, p = 0,001), prymidon (OR = 1,73, 95% CI: 1,21–2,49, p = 0,002), karbamazepinę (OR = 1,61, 95% CI: 1,33–1,96, p < 0,0001), kwas walproinowy (OR = 1,52, 95% CI: 1,28–1,82, p < 0,0001). Prawdopodobną przyczyną jest działanie wymienionych leków na układ immunologiczny. Cytowane badania wskazują na konieczność uważnego planowania terapii u osób z padaczką z nawrotowymi zakażeniami układu moczowego.
Cewnikowanie
Grupą o wysokim ryzyku ZUM są osoby samocewnikujące się lub wymagające pozostawienia cewnika na stałe [23]. U wymienionych pacjentów zakażenia częściej niż raz w roku zdarzają się z częstością od 15,4% do 86,6%. Zastosowanie antyseptyków prawdopodobnie zmniejsza ryzyko.
Okres okołooperacyjny
Okres okołooperacyjny również jest czynnikiem sprzyjającym zakażeniom układu moczowego [17]. Istotne znaczenie w tym przypadku mają: wiek pacjentek powyżej 57–60 lat, obecność cukrzycy, stosowanie leków o działaniu immunosupresyjnym, otyłość i konieczność przetoczenia krwi wynikająca z nadmiernej utraty okołooperacyjnej. Podawanie profilaktyczne antybiotyków u pacjentów cewnikowanych okołooperacyjnie z bezobjawową bakteriurią istotnie zmniejsza ryzyko infekcji objawowej (RR = 0,20, 95% CI: 0,13–0,31) [24]. Ze względu na anatomiczną lokalizację narządu rodnego w przebiegu większości zabiegów pacjentki są cewnikowane. W przypadku cięć cesarskich wystarczające jest pozostawienie cewnika na kilka godzin, do chwili ustąpienia znieczulenia przewodowego. W operacjach ginekologicznych cewnik zazwyczaj jest utrzymywany ok. 24 godzin. Wyjątek stanowią zabiegi korygujące statykę narządu rodnego, po których cewnik niekiedy jest pozostawiany na 2–3 doby.
Ciąża
Szereg czynników sprzyja ZUM w ciąży – mocz jest bardziej zasadowy, dochodzi (szczególnie pod koniec ciąży) do zastoju moczu w moczowodach, częściej pojawiają się białkomocz, cukrzyca i niedokrwistość. Pobranie próbki do badania moczu jest trudniejsze, szczególnie w III trymestrze ciąży. W próbkach moczu częściej stwierdzane jest białko i bakterie. Nie zawsze świadczy to o infekcji układu moczowego – najczęściej stanowi zanieczyszczenie pochodzące z przedsionka pochwy. Białko może być efektem niewielkiej domieszki śluzu, ale u kobiet z nadciśnieniem będzie wyrazem białkomoczu jako elementu stanu przedrzucawkowego. Liczne bakterie w polu widzenia w osadzie moczu bez podwyższonej leukocyturii najczęściej są pałeczkami kwasu mlekowego. Kluczowe znaczenie w różnicowaniu z zakażeniem układu moczowego w ciąży ma liczba leukocytów. Bezobjawowe zakażenia dróg moczowych dotykają 2–8% kobiet w ciąży [25]. Według innych opracowań zakażenie układu moczowego jest najczęściej rozpoznawaną infekcją w ciąży, dotyka 50–60% wszystkich ciężarnych [26]. Istnieją doniesienia sugerujące, że u kobiet nawet z nieznamiennym bakteriomoczem częściej występowały porody przedwczesne [27]. Zakażenie dróg moczowych w ciąży jest częściej rozpoznawane u kobiet z nadciśnieniem indukowanym ciążą. W rezultacie jest związane ze zwiększonym ryzykiem zaburzenia wzrastania wewnątrzmacicznego dziecka, porodami przedwczesnymi i cięciami cesarskimi [28]. Warto jednak pamiętać, że ZUM nie jest w tym przypadku czynnikiem decydującym o postępowaniu położniczym. Nawrotowe zakażenie dróg moczowych w ciąży dotyka co czwartej pacjentki i w 4–5% kończy się odmiedniczkowym zapaleniem nerek [25]. Stwierdzono, że wystąpienie ZUM u kobiety ciężarnej jest istotnym czynnikiem ryzyka zakażenia dróg moczowych u dziecka – 30% vs 6,8% (OR = 5,9, 95% CI: 1,9–18,3, p = 0,001) [29].
Jakie bakterie, czyli klucz do wyboru terapii
W badaniach analizujących rodzaje patogenów powodujących zakażenia układu moczowego u osób bez cukrzycy najczęściej stwierdzana jest obecność Escherichia coli (69%), Enterococcus sp. (10%), Klebsiella sp. (4%), Pseudomonas aeruginosa (4%), Proteus sp. (4%) i Staphylococcus sp. (2%) [30, 31]. Patogenami obserwowanymi u pacjentów z cukrzycą były kolejno: E. coli (71%), Klebsiella spp. (6%), Staphylococcus spp. (5%) i Enterococcus spp. (4%) [31]. U kobiet ciężarnych ZUM najczęściej jest powodowane obecnością Escherichia coli (30,8–90%), bakterii z grupy Staphylococcus (4,3–32%), Proteus mirabilis (10,2%), Enterococcus faecalis (1–8,1%), Klebsiella pneumoniae (6,1–9,1%) [25, 26, 32]. W grupie niemowląt najczęstszymi patogenami były kolejno: Escherichia coli (65,9%), Klebsiella (14,6%) i Staphylococci (9,8%) [29].
Antybiotykoterapia
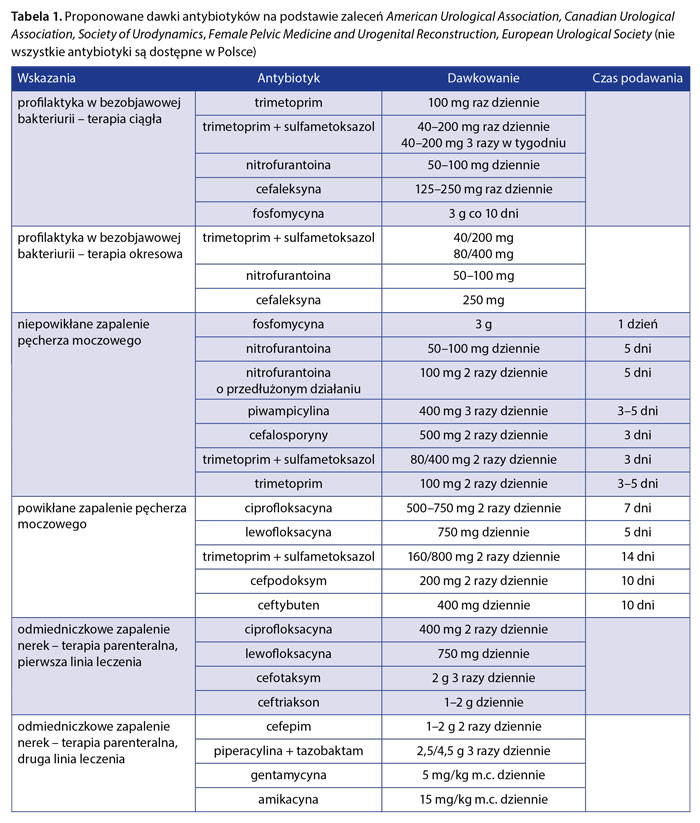
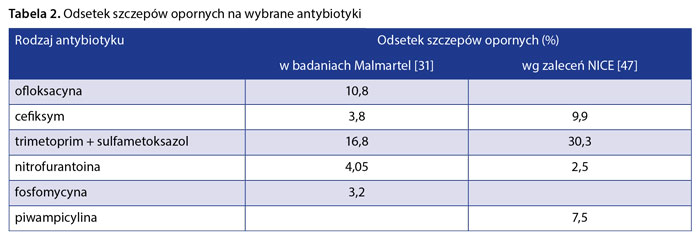
Zalecenia francuskie wydane przez French Language Infectious Pathology Society (fr. Société de Pathologie Infectieuse de Langue Française – SPILF) rekomendują stosowanie kolejno fosfomycyny, nitrofurantoiny i chinolonów w terapii zapalenia pęcherza moczowego i trzeciej generacji cefalosporyn w odmiedniczkowym zapaleniu nerek [33]. Rekomendacje American Urological Association, Canadian Urological Association, Society of Urodynamics, Female Pelvic Medicine and Urogenital Reconstruction, European Urological Society dotyczące antybiotykoterapii zebrano w tabeli 1. U kobiet ciężarnych z bezobjawową bakteriurią za każdym razem leczenie powinno być ukierunkowane, co oznacza konieczność wykonania posiewu moczu z antybiogramem. W przypadku stanów ostrych należy pobrać posiew moczu i w oczekiwaniu na wynik rozpocząć leczenie. Pierwszym wyborem w ciąży jest podanie cefalosporyn. Zgodnie z danymi, które przedstawili Kashif i wsp. [25], należy zachować ostrożność w zalecaniu ciężarnym nitrofurantoiny (może powodować hemolizę u płodu), amoksycyliny z kwasem klawulanowym (w III trymestrze obserwowano u dzieci martwicze zapalenie jelit) i trimetoprimu (antagonista kwasu foliowego). Około 7–10 dni po zakończeniu leczenia zasadne jest powtórne wykonanie posiewu w celu upewnienia się, czy było ono skuteczne. Doskonałą alternatywą jest podanie jednej dawki fosfomycyny. Zgodnie z opublikowaną w 2020 r. metaanalizą lek jest równie skuteczny jak inne antybiotyki i bezpieczny zarówno u kobiet ciężarnych, jak i u niebędących w ciąży [34]. W badaniach Malmartel i wsp. [31] sprawdzono częstość pojawiania się antybiotykooporności bakterii wywołujących ZUM (tab. 2). Nieco częściej oporność na ofloksacynę i cefiksym stwierdzano u osób chorych na cukrzycę.
Profilaktyka nieantybiotykowa – immunomodulacja
Lekiem o działaniu immunomodulacyjnym jest OM-89 [11, 35]. Preparat ten jest skuteczny w przypadku zakażenia Escherichia coli, a więc w 70–80% ZUM. Po zastosowaniu OM-89 u kobiet z zakażeniami nawrotowymi w ciągu 6-miesięcznej terapii ponad 2-krotnie rzadziej (67,3% vs 32,7%) obserwowano nawrotowe ZUM [36]. Czynnikiem, który wyraźnie obniżał skuteczność terapii, była źle kontrolowana cukrzyca. W wieloośrodkowym badaniu przeprowadzonym metodą podwójnie ślepej próby wśród 453 kobiet stwierdzono 34-procentową redukcję ZUM po 3-miesięcznej terapii i 10-dniowym kursie przypominającym preparatem OM-89 [30]. Przy identycznym schemacie leczenia w badaniach retrospektywnych 79 osób głównym patogenem (u 49% badanych) była Escherichia coli [11]. Na terapię pozytywnie odpowiedziało 63% zakażonych Escherichia coli i 53% wszystkich badanych. Skuteczność OM-89 została również potwierdzona w badaniu kobiet w okresie menopauzy. Przeprowadzono badanie kliniczne na grupie chorych w średnim wieku 66 lat, u których po immunostymulacji liczba nawrotów spadła z 3,4 do 1,8 (redukcja na poziomie 65%) [37].
Doustna immunomodulacja OM-89 (OM-89) w profilaktyce nawracających ZUM jest rekomendowana zarówno przez Europejskie Towarzystwo Urologiczne (European Association of Urology – EAU) w niepowikłanych ZUM u kobiet (siła dowodów – strong, najwyższy poziom rekomendacji – 1a) [12], jak i Polskie Towarzystwo Urologiczne w profilaktyce nawracających ZUM. Pozwala na zmniejszenie częstości nawrotów, zmniejszenie dolegliwości, liczby przepisywanych antybiotyków oraz ryzyka pojawienia się antybiotykooporności [38]. W zapobieganiu nawracającym ZUM OM-89 podaje się raz dziennie na czczo (30 minut przed posiłkiem) przez 90 dni. Lek może być stosowany razem z antybiotykiem w ostrej fazie zakażenia bez konieczności wcześniejszego uzyskania wyniku posiewu. Spowodowane jest to faktem, że preparat ten indukuje silną odpowiedź immunologiczną wpływającą nie tylko na E. coli, lecz także na inne patogeny, które mogą powodować ZUM. OM-89 ma najwyższy poziom dowodów naukowych pośród wszystkich nieantybiotykowych metod profilaktyki ZUM [12].
Pozostałe metody profilaktyki nieantybiotykowej
Zgodnie z przedstawioną w 2017 r. analizą bazy Cochrane [39] działanie probiotyków w ograniczaniu zakażeń dróg moczowych u osób z zaburzoną funkcją pęcherza wymaga dalszych badań. W badaniach in vitro wykazano, że sok z żurawiny powoduje zmniejszenie przylegania bakterii Escherichia coli do nabłonka wyścielającego drogi moczowe i pochwę [40, 41]. W efekcie pacjentki powinny odczuwać zmniejszenie dolegliwości wynikających z podrażnienia przez bakterie. Redukcja objawów nie musi być równoznaczna z eradykacją zakażenia. W prospektywnych randomizowanych badaniach kobiet w wieku 18–45 lat nie wykazano istotnej statystycznie różnicy w częstości ZUM ocenianych na podstawie posiewów moczu między kobietami pijącymi sok z żurawiny a kobietami przyjmującymi placebo [42]. Podobne konkluzje przedstawiono w analizie bazy Cochrane opublikowanej w 2012 r. [43]. Odrębny problem stanowi leczenie przewlekłych zakażeń układu moczowego i zapobieganie nawrotom. W profilaktyce nawrotów ZUM znalazła zastosowanie D-mannoza. Środek ten zapobiega przyleganiu bakterii do nabłonka układu moczowego. Opublikowana w 2020 r. metaanaliza objęła łącznie 8 prac, ale ostateczne wyniki przedstawiają dane jedynie 163 pacjentek [44]. Wyniki są obiecujące, ale należy zaczekać na kolejne badania, aby ustalić optymalną dawkę leku i czas trwania terapii.
Profilaktyka antybiotykowa
Część lekarzy zaleca kobietom z nawracającymi ZUM profilaktyczne przewlekłe stosowanie antybiotyków. Metaanaliza opublikowana w Cochrane wskazuje, że profilaktyczne zastosowanie antybiotyków u młodych kobiet z nawracającymi zakażeniami dróg moczowych przynosi pozytywne efekty [45]. Zgodnie z wynikami przedstawionymi przez Ahmeda i wsp. [46] przewlekła profilaktyka antybiotykowa u kobiet po 65. roku życia przynosiła zauważalne efekty dopiero przy stosowaniu dłuższym niż 2 lata. Podawano nitrofurantoinę, cefaleksynę lub trimetoprim. Terapia skutkowała zmniejszeniem częstości nawrotów objawowego zakażenia dróg moczowych (OR = 0,57, 95% CI: 0,55–0,59), konieczności dodatkowego wypisywania antybiotyków (OR = 0,61, 95% CI: 0,59–0,62). Równocześnie zaobserwowano niewielkie, ale istotne statystycznie zwiększenie liczby hospitalizacji związanych z infekcją dróg moczowych (OR = 1,16, 95% CI: 1,05–1,28). Według zaleceń EAU profilaktykę antybiotykową należy stosować wtedy, kiedy metody behawioralne (zmiana zachowań zdrowotnych) oraz profilaktyka nieantybiotykowa nie przyniosły oczekiwanego rezultatu.
Zalecenia międzynarodowe i krajowe
Zgodnie z zaleceniami American Urological Association (AUA), Canadian Urological Association (CUA), Society of Urodynamics, Female Pelvic Medicine and Urogenital Reconstruction (SUFU) większość zaleceń ma poziom B lub C [14]. Nawrotowe zapalenie układu moczowego powinno zawsze być potwierdzone wykonaniem posiewu moczu. Przed podjęciem leczenia lekarz powinien uzyskać wynik badania ogólnego moczu oraz posiewu moczu, ale w przypadku bardzo nasilonych objawów może w oczekiwaniu na wyniki zalecić antybiotykoterapię. Bezobjawowa bakteriuria nie powinna być leczona i nie należy w jej przypadku w ogóle wykonywać badań moczu i posiewu moczu. Leczenie antybiotykami w objawowym zakażeniu układu moczowego (w pierwszej linii nitrofurantoiną, trimetoprimem–sulfametoksazolem, fosfomycyną) powinno być prowadzone zgodnie z antybiogramem. Terapia antybiotykiem nie powinna trwać dłużej niż 7 dni, w razie potrzeby lek może być podawany parenteralnie. Jeśli objawy ustąpiły, nie ma wskazań do przeprowadzania badania bakteriologicznego po leczeniu. W razie braku poprawy zasadne jest ponowne wykonanie posiewu i zlecenie leczenia zgodnie z jego wynikiem. U kobiet w okresie około- i pomenopauzalnym celowe jest podawanie dopochwowe estrogenów (przy braku przeciwwskazań). Zgodnie z planem Światowej Organizacji Zdrowia (World Health Organization – WHO) przeciwdziałania indukowaniu nadmiernej antybiotykooporności wymienione towarzystwa dopuszczają profilaktyczne stosowanie żurawiny i innych terapii alternatywnych. Zalecenia EAU zostały opatrzone komentarzem zawierającym przegląd dostępnego piśmiennictwa [12]. Określono siłę przedstawianych rekomendacji. Autorzy zalecają, aby nie prowadzić diagnostyki i terapii bezobjawowej bakteriurii z wyjątkiem kobiet w ciąży (rekomendacja słaba) i pacjentów, u których doszło do naruszenia ciągłości błony śluzowej pęcherza moczowego (rekomendacja silna).
W przypadku diagnostyki niepowikłanego zapalenia dróg moczowych zalecono oparcie rozpoznania na objawach klinicznych przy braku stanów zapalnych pochwy. Wykonanie posiewu moczu zalecono jedynie w przypadku: podejrzenia ostrego odmiedniczkowego zapalenia nerek, kobiet w ciąży, kobiet z nietypowymi objawami, braku ustąpienia objawów 4 tygodnie po zakończeniu leczenia. Pierwsza linia leczenia powinna obejmować podawanie: fosfomycyny, piwampicyliny lub nitrofurantoiny. Terapia aminopenicylinami i fluorochinolonami w niepowikłanym zapaleniu pęcherza moczowego nie jest zalecana (zalecenia silne). Autorzy wskazali, że diagnostyka niepowikłanego zapalenia pęcherza za pomocą pasków testowych ma niską siłę dowodów. W przypadku nawrotowego zapalenia dróg moczowych konieczne jest potwierdzenie diagnozy poprzez wykonanie posiewu moczu z antybiogramem. W ramach profilaktyki nieantybiotykowej nawracających zakażeń powinno się w pierwszej kolejności wdrożyć metody związane z profilaktyką behawioralną oraz zastosować immunostymulację OM-89.
Profilaktyka antybiotykowa jest rekomendowana jedynie w przypadku nawrotu ZUM pomimo zastosowania profilaktyki nieantybiotykowej, profilaktyka przeciwbakteryjna – po stosunkach seksualnych, okresowe krótkotrwałe podawanie leków antybakteryjnych – u kobiet, u których leczenie okazało się skuteczne (zalecenia silne). Jednocześnie jako słabo udowodnione przedstawiono zalecenia podawania estrogenów u kobiet po menopauzie, modyfikacji zachowania i prowadzenia szerokiej diagnostyki obrazowej u kobiet z nawrotowym niepowikłanym zapaleniem pęcherza moczowego. Badanie ogólne moczu (laboratoryjne i paskowe), posiew moczu i badania obrazowe są zalecanie we wszystkich przypadkach odmiedniczkowego zapalenia nerek. Autorzy rekomendacji zalecają leczenie niepowikłanego odmiedniczkowego zapalenia nerek krótkimi kursami fluorochinolonów, hospitalizację jedynie w przypadku konieczności podania antybiotyków drogą parenteralną do czasu przejścia na terapię doustną. Jednocześnie odradzają podawanie nitrofurantoiny, fosfomycyny lub piwampicyliny (zalecenia silne). W przypadku powikłanego nawrotowego zapalenia dróg moczowych zalecane jest podawanie aminoglikozydów z amoksycyliną lub cefalosporyną drugiej generacji, ewentualnie dożylne leczenie cefalosporyną trzeciej generacji przy pojawieniu się objawów ogólnoustrojowych. Ciprofloksacyna jest zalecana jedynie przy leczeniu doustnym, w przypadkach niewymagających hospitalizacji lub przy znanym uczuleniu na wcześniej wymienione antybiotyki. Ciprofloksacyna i inne fluorochinolony są przeciwwskazane, jeśli były stosowane w ciągu poprzednich 6 miesięcy (zalecenie silne). Autorzy nie zalecają rutynowego podawania antybiotyków pacjentom po usunięciu cewnika.
Opublikowane w 2020 r. zalecenia brytyjskiego National Institute for Health and Care Excellence (NICE) dotyczą leczenia zapalenia dolnych dróg moczowych [47]. Poza ciążą leczenie antybiotykiem przez 3 dni jest równie efektywne jak podawanie przez 5 lub 10 dni. U starszych kobiet kuracja może trwać 3–6 dni. Rekomendowanymi lekami pierwszego rzutu są nitrofurantoina lub trimetoprim. Lekami drugiego rzutu są fosfomycyna lub piwampicylina. W ciąży stosowanie antybiotyku powinno trwać 7 dni, przed podaniem należy się upewnić, czy wcześniej nie obserwowano oporności na ten lek. Rekomendowanymi lekami w bezobjawowej bakteriurii są nitrofurantoina, amoksycylina lub cefaleksyna, a w zakażeniu objawowym amoksycylina lub cefaleksyna.
Polskie rekomendacje dotyczące diagnostyki, terapii i profilaktyki ZUM u dorosłych zostały opracowane w 2015 r. w ramach Narodowego Programu Ochrony Antybiotyków [48]. Bezobjawowy bakteriomocz wymaga antybiotykoterapii tylko przed planowanymi zabiegami urologicznymi. W przypadku ostrego niepowikłanego zapalenia pęcherza u młodych kobiet leczenie można podjąć na podstawie objawów klinicznych. Do rozpoznania nie jest konieczne wykonanie badań laboratoryjnych, w tym badania osadu moczowego i posiewu. Większość pacjentek może być leczona ambulatoryjnie. Zgodnie z zaleceniami w leczeniu empirycznym niepowikłanego zapalenia pęcherza moczowego nie należy stosować fluorochinolonów, które powinny być zarezerwowane dla zakażeń powikłanych lub stanów ciężkich. W przypadku nawrotu należy wykonać posiew moczu i do czasu uzyskania wyniku podawać antybiotyk empirycznie. W przypadku powikłanego zakażenia układu moczowego zawsze należy wykonać badanie ogólne moczu, morfologię krwi obwodowej, badanie stężenia CRP, kreatyniny, GFR i posiew moczu.
Terapię należy zmodyfikować zgodnie z wynikiem antybiogramu. Ostre odmiedniczkowe zapalenie nerek zdiagnozowane na podstawie objawów klinicznych zawsze wymaga pobrania posiewu moczu, a w cięższym przebiegu także posiewu krwi. Rozpoczęte leczenie empiryczne powinno być zawsze zweryfikowane na podstawie wyników posiewów. U kobiet ciężarnych autorzy zalecają wykonanie posiewu moczu w I trymestrze ciąży jako profilaktyki odmiedniczkowego zapalenia nerek i porodów przedwczesnych. W przypadku przebytego zapalenia pęcherza moczowego w ciąży kontrolne posiewy powinny być wykonywane co 1–2 miesiące. W ciąży przeciwwskazane są fluorochinolony, a w I trymestrze kotrimoksazol.
Podsumowanie
Zakażenie układu moczowego jest jedną z najczęstszych infekcji u kobiet. Może wystąpić w każdym wieku, ale częściej dotyka kobiet ciężarnych i w okresie pomenopauzalnym. Nierzadko towarzyszy zakażeniom pochwy i najczęściej jest wywoływane przez patogeny pochodzące z końcowych odcinków przewodu pokarmowego. Leczenie antybiotykami powinno być prowadzone przez możliwie najkrótszy okres, a dawkowanie i czas trwania terapii zależą od rodzaju zakażenia.
Obecność bakteriurii bezobjawowej nie zawsze wymaga stosowania antybiotyków, a ich nadużywanie może prowadzić do oporności szczepów bakteryjnych. W zakażeniach przewlekłych i bezobjawowej bakteriurii zawsze warto rozważyć alternatywne terapie zmniejszające ryzyko nawrotów. W przypadku nawracających ZUM w pierwszej kolejności zalecana jest profilaktyka nieantybiotykowa oparta na modyfikacji zachowań zdrowotnych oraz zastosowaniu immunomodulacji układu odpornościowego.
Piśmiennictwo
1. Fihn SD. Clinical practice. Acute uncomplicated urinary tract infection in women. N Engl J Med 2003; 349: 259-266.
2. Griebling TL. Urologic diseases in America project: trends in resource use for urinary tract infections in women. J Urol 2005; 173: 1281-1287.
3. Curtiss N, Meththananda I, Duckett J. Urinary tract infection in obstetrics and gynaecology. Obstet Gynaecol Reprod Med 2017; 27: 261-265.
4. Foxman B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden. Infect Dis Clin North Am 2014; 28: 1-13.
5. Ikäheimo R, Siitonen A, Heiskanen T i wsp. Recurrence of urinary tract infection in a primary care setting: analysis of a 1-year follow-up of 179 women. Clin Infect Dis 1996; 22: 91-99.
6. Foxman B. Recurring urinary tract infection: incidence and risk factors. Am J Public Health 1990; 80: 331-333.
7. Geerlings SE. Clinical presentations and epidemiology of urinary tract infections. Microbiol Spectr 2016; doi: 10.1128/microbiolspec.UTI-0002-2012.
8. Gupta K, Trautner BW. Diagnosis and management of recurrent urinary tract infections in nonpregnant women. BMJ 2013; 346: f3140.
9. Scholes D, Hooton TM, Roberts PL i wsp. Risk factors for recurrent urinary tract infection in young women.
10. J Infect Dis 2000; 182: 1177-1182.
11. van den Boom L, Kalder M, Kostev K. Prevalence of urinary system, pelvic organ, and genital tract disorders among women with type 1 diabetes in Germany. Prim Care Diabetes 2021; 15: 257-261.
12. Brodie A, El-Taji O, Jour I i wsp. A Retrospective study of immunotherapy treatment with Uro-Vaxom (OM-89®) for prophylaxis of recurrent urinary tract infections. Curr Urol 2020; 14: 130-134.
13. Bonkat G, Bartoletti R, Bruyère F i wsp. EAU Guidelines on Urological Infections European As sociation of Urology 2020. https://uroweb.org/guideline/urological-infections/
14. Cody JD, Jacobs ML, Richardson K i wsp. Oestrogen therapy for urinary incontinence in post-menopausal women. Cochrane Database Syst Rev 2012; 10: CD001405.
15. Anger J, Lee U, Ackerman AL i wsp. Recurrent Uncomplicated Urinary Tract Infections in Women: AUA/CUA/SUFU Guideline. J Urol 2019; 202: 282-289.
16. Boyko EJ, Fihn SD, Scholes D i wsp. Diabetes and the risk of acute urinary tract infection among postmenopausal women. Diabetes Care 2002; 25: 1778-1783.
17. Wilke T, Boettger B, Berg B i wsp. Epidemiology of urinary tract infections in type 2 diabetes mellitus patients: an analysis based on a large sample of 456,586 German T2DM patients. J Diabetes Complications 2015; 29: 1015-1023.
18. Nguyen AQ, Foy MP, Sood A, Gonzalez MH. Preoperative risk factors for postoperative urinary tract infection after primary total hip and knee arthroplasties. J Arthroplasty 2021; 36: 734-738.
19. Geerlings SE, Stolk RP, Camps MJL i wsp. Risk factors for symptomatic urinary tract infectionin women with diabetes. Diabetes Care 2000; 23: 1737-1741.
20. Kelestimur F, Pasaoglu H, Basar E i wsp. Asymptomatic bacteriuria in patients with diabetes mellitus. Mikrobiol Bull 1990; 24: 126-132.
21. Laway BA, Nabi T, Bhat MH, Fomda BA. Prevalence, clinical profile and follow up of asymptomatic bacteriuria in patients with type 2 diabetes-prospective case control study in Srinagar, India. Diabetes Metab Syndr 2021; 15: 455-459.
22. Meiland R, Geerlings SE, Stolk RP i wsp. Asymptomatic bacteriuria in women with diabetes mellitus: effect on renal function after 6 years of follow-up. Arch Intern Med 2006; 166: 2222-2227
23. Heidemann J, Schmitz B, Kostev K. Association between antiseizure medication use and risk of urinary tract infection: a case-control study. Epilepsy Behav 2021; 115: 107502.
24. Mitchell BG, Prael G, Curryer C. The frequency of urinary tract infections and the value of antiseptics in community-dwelling people who undertake intermittent urinary catheterization: a systematic review. Am J Infect Cont 2021; doi: 10.1016/j.ajic.2021.01.009
25. Lusardi G, Lipp A, Shaw C. Antibiotic prophylaxis for short-term catheter bladder drainage in adults. Cochrane Database Syst Rev 2013; 7: CD005428.
26. Kashif U, Riaz N, Ramasubramanian SP, Iles D. Urogynaecological complications in pregnancy. Obstet Gynaecol Reprod Med 2021; 31: 42-47.
27. Baraka MA, AlLehaibi LH, AlSuwaidan HN i wsp. Patterns of infections and antimicrobial drugs’ prescribing among pregnant women in Saudi Arabia: a cross sectional study. J Pharm Policy Pract 2021; 14: 9.
28. Sheiner E, Mazor-Drey E, Levy A. Asymptomatic bacteriuria during pregnancy. J Matern Fetal Neonatal Med 2009; 22: 423-427.
29. Mazor-Dray E, Levy A, Schlaeffer F, Sheiner E. Maternal urinary tract infection: is it independently associated with adverse pregnancy outcome? J Matern Fetal Neonatal Med 2009; 22: 124-128.
30. Emamghorashi F, Mahmoodi N, Tagarod Z, Heydari ST. Maternal urinary tract infection as a risk factor for neonatal urinary tract infection. Iran J Kidney Dis 2012; 6: 178-180.
31. Bauer HW, Alloussi S, Egger G. A long-term, multicenter, double-blind study of an escherichia coli extract (OM-89) in female patients with recurrent urinary tract infections. Eur Urol 2005; 47: 542-548.
32. Malmartel A, Ghasarossian C. Bacterial resistance in urinary tract infections in patients with diabetes matched with patients without diabetes. J Diabetes Complications 2016; 30: 705-709.
33. Ali SB, Perdawood D, Abdulrahman RM i wsp. Vitamin D deficiency as a risk factor for urinary tract infection in women at reproductive age. Saudi J Biol Sci 2020; 27: 2942-2947.
34. Société de Pathologie Infectieusede Langue Française. Diagnostic et antibiothérapie des infections urinaires bactériennes communautaires del’adulte. 2014.
35. Wang T, Wu G, Wang J i wsp. Comparison of single-dose fosfomycin tromethamine and other antibiotics for lower uncomplicated urinary tract infection in women and asymptomatic bacteriuria in pregnant women: a systematic review and meta-analysis. Int J Antimicrob Agents 2020; 56: 106018.
36. Wade D, Cooper J, Derry F, Taylor J. Uro-Vaxom® versus placebo for the prevention of recurrent symptomatic urinary tract infections in participants with chronic neurogenic bladder dysfunction: a randomised controlled feasibility study. Trials 2019; 20: 223
37. Han L-Y, Lee Y-S. Risk factor affecting recurrence of cystitis after Uro-vaxom treatment for female patients with recurrent cystitis. Poster #NM81. Neurourol Urodyn 2017; 36: S104.
38. Popa G, Lauber KD, Rothe H, Rugendorff E. Rezidivierende Harnwegsinfektionen in der Postmenopause. Wirksamkeit einer oralen Immuntherapie mit E. coli-Fraktionen. Muenchn Med Wschr 1996; 138: 713-716.
39. Gołąbek T, Lipiński M, Drewa T i wsp. Zalecenia zespołu ekspertów dotyczące leczenia i profilaktyki zakażeń układu moczowego immunostymulatorem Uro-Vaxom (OM-89). Prz Urol 2017; 102: 24-29.
40. Toh SL, Boswell-Ruys CL, Lee BSB i wsp. Probiotics for preventing urinary tract infection in people with neuropathic bladder. Cochrane Database Syst Rev 2017; 9: CD010723.
41. Gupta K, Chou MY, Howell A i wsp. Cranberry products inhibit adherence of p-fimbriated Escherichie coli to primary cultured bladder and vaginal epithelium cells. J Urol 2007; 177: 2357-2360.
42. Lavigne JP, Bourg G, Combescure B i wsp. In vitro and in vivo evidence of dose dependent decrease of uropathogenic Escherichia coli virulence after consumption of commercial Vaccinium macrocarpon (cranberry) capsules. Clin Microbiol Infect 2008; 14: 350-355.
43. Stapleton AE, Dziura J, Hooton TM i wsp. Recurrent urinary tract infection and urinary Escherichia coli in women ingestingCranberry juicedaily: a randomized controlled trial. Mayo Clinic Proceedings 2012; 87: 143-150.
44. Jepson RG, Williams G, Craig JC. Cranberries for preventing urinary tract infections. Cochrane Database Syst Rev 2012; 10: CD001321.
45. Lenger SM, Bradley MS, Thomas DA i wsp. D-mannose vs other agents for recurrent urinary tract infection prevention in adult women: a systematic review and meta-analysis. Am J Obstet Gynecol 2020; 223: 265.e1-265.e13.
46. Albert X, Huertas I, Pereiro II i wsp. Antibiotics for preventing recurrent urinary tract infection in non-pregnant women. Cochrane Database Syst Rev 2004; 3: Cd001209.
47. Ahmed H, Farewell D, Jones HM i wsp. Antibiotic prophylaxis and clinical outcomes among older adults with recurrent urinary tract infection: cohort study. Age Ageing 2019; 48: 228-234.
48. NICE guideline [NG109]. Urinary tract infection (lower): antimicrobial prescribing. Published: 31 October 2018. www.nice.org.uk/guidance/ng109.
49. Hryniewicz W, Holecki M (red.). Rekomendacje diagnostyki, terapii i profilaktyki zakażeń układu moczowego u dorosłych. Wydawnictwo sfinansowane ze środków będących w dyspozycji Ministra Zdrowia w ramach programu zdrowotnego pn.: „Narodowy Program Ochrony Antybiotyków na lata 2011–2015”. Warszawa 2015.
Wstęp
Zakażenie układu moczowego (ZUM) u kobiet jest jedną z najczęstszych infekcji pojawiających się w różnych okresach życia. Zakażenia u kobiet występują znacznie częściej niż u mężczyzn. Czynnikiem sprzyjającym jest przede wszystkim budowa anatomiczna końcowego odcinka układu moczowego i sąsiedztwo narządu rodnego. Cewka moczowa u kobiet jest stosunkowo krótka, a więc droga, jaką muszą przebyć bakterie, też jest mniejsza. Cewka u kobiety uchodzi do przedsionka pochwy. Zakażenia przedsionka pochwy i pochwy u kobiet zdarzają się często. W tym przypadku czynnikami sprzyjającymi są kontakty seksualne i nierzadko nadmierne stosowanie środków do higieny intymnej zaburzających właściwą florę bakteryjną. Bliskość odbytu ułatwia kolonizację zarówno narządu rodnego, jak i dystalnych odcinków układu moczowego przez bakterie Escherichia coli, Enterococcus fecalis i Streptococcus species. Specyficznym okresem, w którym częściej dochodzi do zakażenia dróg moczowych, jest ciąża i okres okołoporodowy. Duża liczba przeprowadzanych współcześnie cięć cesarskich i cewnikowanie okołooperacyjne również sprzyjają zakażeniom. W okresie po menopauzie spadek poziomu estrogenów wtórnie zaburza funkcje nabłonka przedsionka pochwy i pochwy, prowadzi do zmian zanikowych, a niedobory glikogenu sprzyjają zmniejszeniu populacji pałeczek kwasu mlekowego. W efekcie u kobiet po menopauzie nierzadko pochwa zostaje skolonizowana przez inne bakterie, głównie Escherichia coli. Stan ten sprzyja rozprzestrzenieniu się zakażenia na układ moczowy. Dodatkowym czynnikiem sprzyjającym zakażeniom układu moczowego jest obniżenie narządu rodnego i nietrzymanie moczu. Uważa się, że problem ten dotyka ok. 30–50% kobiet po 50. roku życia. Ocenia się, że co druga kobieta przynajmniej raz w życiu przechodzi zakażenie układu moczowego [1, 2]. Uważa się, że objawowe zakażenie dróg moczowych przynajmniej raz w życiu przechodzi 10–60% wszystkich kobiet [3, 4]. Ryzyko zakażenia rośnie wraz z wiekiem [5].
Nawrotowe zakażenie układu moczowego u kobiet jest definiowane jako przebycie przynajmniej 2 zakażeń układu moczowego w ciągu 6 miesięcy lub przynajmniej 3 zakażeń układu moczowego w ciągu 12 miesięcy. Częstość występowania nawracających zakażeń układu moczowego u kobiet jest oceniana na 25–50% [6–9].
Diagnostyka
Zakażenia układu moczowego można ogólnie podzielić na bezobjawowe lub objawowe. Rozpoznanie zakażenia bezobjawowego opiera się na wynikach badań moczu. Ze względu na umiejscowienie ujścia zewnętrznego cewki moczowej u kobiet istotne znaczenie ma właściwe pobranie próbki do badania. Podstawowe znaczenie dla podejrzenia ZUM ma liczba leukocytów – w przypadku powyżej 10/mm3 można podejrzewać zakażenie. Wydaje się, że w ciąży liczba leukocytów stanowiąca podstawę do podejrzenia ZUM powinna być wyższa niż 20/mm3. Zanieczyszczenie wydzieliną z przedsionka pochwy zawierającą śluz i pałeczki kwasu mlekowego może się objawić w postaci opisu w osadzie moczu licznych pasm śluzu i obfitej flory bakteryjnej. Niekiedy większa ilość śluzu jest fałszywie interpretowana jako białkomocz. W okresie miesiączki, połogu lub w przypadku krwawień z macicy próbka moczu może zostać zanieczyszczona krwinkami czerwonymi. W takiej sytuacji niezbędne jest zebranie dokładnego wywiadu i powtórne wykonanie badania moczu po odpowiednim przygotowaniu się pacjentki. Sam wynik ogólnego badania moczu bez towarzyszących objawów klinicznych nie może stanowić podstawy do rozpoczęcia terapii. Badaniem potwierdzającym lub wykluczającym ZUM jest posiew moczu. Ze względu na ryzyko kontaminacji próbka powinna zostać pobrana do sterylnego pojemnika, najlepiej z moczu porannego. Obecność ≥ 105 bakterii w mililitrze (colony forming units per milliliter – CFU/ml) potwierdza zakażenie, a antybiogram pozwala na weryfikację, czy zastosowane leczenie może być skuteczne.
W przypadku podwyższonej liczby leukocytów w osadzie i objawów klinicznych należy rozpocząć leczenie. U kobiet ciężarnych warto pobrać posiew na początku terapii ze względu na zwiększone ryzyko porodów przedwczesnych towarzyszące zakażeniom układu moczowego i ograniczoną liczbę antybiotyków dopuszczonych do stosowania w ciąży. Wskazaniem do leczenia są oczywiście typowe objawy kliniczne. W przypadku braku upławów z pochwy i pieczenia w przedsionku pochwy typowe objawy zapalenia pęcherza moczowego u młodych kobiet są potwierdzalne w 90% [10, 11]. W ok. 15% przypadków posiewy moczu są dodatnie pomimo braku podwyższonej liczby leukocytów w badaniu ogólnym moczu [3].
Specyficzne grupy pacjentek
Menopauza
Podstawowymi przyczynami zwiększonej częstości występowania ZUM w okresie około- i pomenopauzalnym są zmiany hormonalne (niedobór estrogenów) i starzenie się tkanki łącznej (nietrzymanie moczu, obniżenie narządu rodnego). Czynnikami sprzyjającymi zakażeniom dróg moczowych w okresie menopauzalnym są: nietrzymanie moczu (utrudnia właściwą higienę), zmiany zanikowe w błonie śluzowej pochwy (większe ryzyko zakażeń w pochwie i przenoszenia ich do układu moczowego), obniżenie przedniej ściany pochwy (brak pełnego opróżniania pęcherza moczowego). W okresie okołomenopauzalnym i w dalszych latach życia kobiet wzrasta częstość bezobjawowego bakteriomoczu – 4–19% w porównaniu z 1,5% kobiet w okresie przed menopauzą [12]. W okresie około- i pomenopauzalnym niedobory estrogenów mogą sprzyjać nietrzymaniu moczu i zakażeniom układu moczowego. Wykazano, że podawanie estrogenów miejscowo do pochwy (ale nie ogólnie) znamiennie zmniejsza ryzyko bakteriurii (OR = 0,3, 95% CI: 0,13–0,68) [13]. Celowość stosowania miejscowego estrogenów u kobiet w okresie około- i pomenopauzalnym w celu przeciwdziałania zakażeniom układu moczowego potwierdzają zalecenia towarzystw naukowych [14].
Istotnym czynnikiem ryzyka zakażenia dróg moczowych u kobiet po menopauzie jest cukrzyca [15, 16]. W badaniach łącznie 256 725 kobiet z cukrzycą typu 2 ZUM rozpoznawano znacznie częściej od wieku 45–49 lat, przy czym w porównaniu z młodszymi kobietami był to wzrost o ok. 100%, a w wieku 50–54 lat o kolejne ok. 80% [16]. Porównano dwie grupy kobiet w wieku 55–75 lat z ostrym zakażeniem układu moczowego – 901 pacjentek z cukrzycą i 913 pacjentek z grupy kontrolnej [15]. Obecność cukrzycy u kobiet po menopauzie zwiększała ryzyko ZUM dwukrotnie (OR = 2,2, 95% CI: 1,5–3,1). Czynnikami o istotnym znaczeniu były konieczność leczenia lekami doustnymi lub insuliną (OR odpowiednio 2,8 i 2,7) i typ 2 cukrzycy (OR = 2,2). Bez znaczenia pozostawały czas trwania cukrzycy i stopień wyrównania glikemii oceniany poprzez oznaczanie hemoglobiny glikowanej (HbA1c). U osób po 57. roku życia rośnie też ryzyko infekcji dróg moczowych w przebiegu pooperacyjnym [17].
Cukrzyca
Cukrzyca, szczególnie nieprawidłowo wyrównana, to czynnik ryzyka zakażeń zarówno układu moczowego, jak i rozrodczego (srom, przedsionek pochwy, pochwa). Zakażenia dróg moczowych stwierdzano u 14% kobiet z cukrzycą typu 1 i u 23% z cukrzycą typu 2 [18]. Czynnikiem o podstawowym znaczeniu jest stopień wyrównania glikemii i obecność cukromoczu. Poza tym częściej zakażenia są obserwowane u kobiet w wieku okołomenopauzalnym z dłużej trwającą cukrzycą. W dobrze udokumentowanych badaniach 1357 kobiet z cukrzycą typu 1 stwierdzono częstsze występowanie ostrego zapalenia: pęcherza moczowego (OR = 1,46, 95% CI: 1,10–1,95, p = 0,001), pochwy (OR = 1,20, 95% CI: 1,01–1,42, p = 0,044) i sromu (OR = 2,12, 95% CI: 1,56–2,90, p < 0,001) [10]. W grupie 241 kobiet z cukrzycą typu 1 podstawowymi czynnikami ryzyka zakażenia objawowego były stosunek seksualny, stosowanie doustnej antykoncepcji i obecność mikroangiopatii [18]. Dodatkowym czynnikiem sprzyjającym mogło być częściej występujące u kobiet z cukrzycą typu 1 nietrzymanie moczu (OR = 1,64, 95% CI: 1,19–2,26, p = 0,001) [10]. U chorych na cukrzycę typu 2 bezobjawowa bakteriuria występuje częściej niż u zdrowych osób (17,5% vs 10%, p = 0,015). W ciągu 6 miesięcy u 20% osób bezobjawowa bakteriuria może się przerodzić w objawowe ZUM [19, 20]. Również w innych badaniach obejmujących 348 kobiet z cukrzycą typu 2 bezobjawowa bakteriuria była podstawowym czynnikiem ryzyka zakażenia objawowego [18]. Może również prowadzić do pogorszenia czynności nerek [21]. Zaprezentowane dane wskazują na konieczność okresowej kontroli posiewu moczu u chorych na cukrzycę, szczególnie typu 2.
Padaczka
Zauważono, że pacjenci chorzy na padaczkę częściej wymagają leczenia zakażeń dróg moczowych [22]. Problem dotyczy ok. 58% kobiet i 42% mężczyzn z padaczką (p < 0,0001). Poszukiwania przyczyn takiego stanu rzeczy wskazały, że czynnikiem mającym istotne znaczenie dla zwiększonej częstości zakażeń dróg moczowych u chorych na padaczkę są zalecane leki. Częściej infekcje obserwowano u pacjentów, u których stosowano: fenytoinę (OR = 1,78, 95% CI: 1,24–2,55, p = 0,001), prymidon (OR = 1,73, 95% CI: 1,21–2,49, p = 0,002), karbamazepinę (OR = 1,61, 95% CI: 1,33–1,96, p < 0,0001), kwas walproinowy (OR = 1,52, 95% CI: 1,28–1,82, p < 0,0001). Prawdopodobną przyczyną jest działanie wymienionych leków na układ immunologiczny. Cytowane badania wskazują na konieczność uważnego planowania terapii u osób z padaczką z nawrotowymi zakażeniami układu moczowego.
Cewnikowanie
Grupą o wysokim ryzyku ZUM są osoby samocewnikujące się lub wymagające pozostawienia cewnika na stałe [23]. U wymienionych pacjentów zakażenia częściej niż raz w roku zdarzają się z częstością od 15,4% do 86,6%. Zastosowanie antyseptyków prawdopodobnie zmniejsza ryzyko.
Okres okołooperacyjny
Okres okołooperacyjny również jest czynnikiem sprzyjającym zakażeniom układu moczowego [17]. Istotne znaczenie w tym przypadku mają: wiek pacjentek powyżej 57–60 lat, obecność cukrzycy, stosowanie leków o działaniu immunosupresyjnym, otyłość i konieczność przetoczenia krwi wynikająca z nadmiernej utraty okołooperacyjnej. Podawanie profilaktyczne antybiotyków u pacjentów cewnikowanych okołooperacyjnie z bezobjawową bakteriurią istotnie zmniejsza ryzyko infekcji objawowej (RR = 0,20, 95% CI: 0,13–0,31) [24]. Ze względu na anatomiczną lokalizację narządu rodnego w przebiegu większości zabiegów pacjentki są cewnikowane. W przypadku cięć cesarskich wystarczające jest pozostawienie cewnika na kilka godzin, do chwili ustąpienia znieczulenia przewodowego. W operacjach ginekologicznych cewnik zazwyczaj jest utrzymywany ok. 24 godzin. Wyjątek stanowią zabiegi korygujące statykę narządu rodnego, po których cewnik niekiedy jest pozostawiany na 2–3 doby.
Ciąża
Szereg czynników sprzyja ZUM w ciąży – mocz jest bardziej zasadowy, dochodzi (szczególnie pod koniec ciąży) do zastoju moczu w moczowodach, częściej pojawiają się białkomocz, cukrzyca i niedokrwistość. Pobranie próbki do badania moczu jest trudniejsze, szczególnie w III trymestrze ciąży. W próbkach moczu częściej stwierdzane jest białko i bakterie. Nie zawsze świadczy to o infekcji układu moczowego – najczęściej stanowi zanieczyszczenie pochodzące z przedsionka pochwy. Białko może być efektem niewielkiej domieszki śluzu, ale u kobiet z nadciśnieniem będzie wyrazem białkomoczu jako elementu stanu przedrzucawkowego. Liczne bakterie w polu widzenia w osadzie moczu bez podwyższonej leukocyturii najczęściej są pałeczkami kwasu mlekowego. Kluczowe znaczenie w różnicowaniu z zakażeniem układu moczowego w ciąży ma liczba leukocytów. Bezobjawowe zakażenia dróg moczowych dotykają 2–8% kobiet w ciąży [25]. Według innych opracowań zakażenie układu moczowego jest najczęściej rozpoznawaną infekcją w ciąży, dotyka 50–60% wszystkich ciężarnych [26]. Istnieją doniesienia sugerujące, że u kobiet nawet z nieznamiennym bakteriomoczem częściej występowały porody przedwczesne [27]. Zakażenie dróg moczowych w ciąży jest częściej rozpoznawane u kobiet z nadciśnieniem indukowanym ciążą. W rezultacie jest związane ze zwiększonym ryzykiem zaburzenia wzrastania wewnątrzmacicznego dziecka, porodami przedwczesnymi i cięciami cesarskimi [28]. Warto jednak pamiętać, że ZUM nie jest w tym przypadku czynnikiem decydującym o postępowaniu położniczym. Nawrotowe zakażenie dróg moczowych w ciąży dotyka co czwartej pacjentki i w 4–5% kończy się odmiedniczkowym zapaleniem nerek [25]. Stwierdzono, że wystąpienie ZUM u kobiety ciężarnej jest istotnym czynnikiem ryzyka zakażenia dróg moczowych u dziecka – 30% vs 6,8% (OR = 5,9, 95% CI: 1,9–18,3, p = 0,001) [29].
Jakie bakterie, czyli klucz do wyboru terapii
W badaniach analizujących rodzaje patogenów powodujących zakażenia układu moczowego u osób bez cukrzycy najczęściej stwierdzana jest obecność Escherichia coli (69%), Enterococcus sp. (10%), Klebsiella sp. (4%), Pseudomonas aeruginosa (4%), Proteus sp. (4%) i Staphylococcus sp. (2%) [30, 31]. Patogenami obserwowanymi u pacjentów z cukrzycą były kolejno: E. coli (71%), Klebsiella spp. (6%), Staphylococcus spp. (5%) i Enterococcus spp. (4%) [31]. U kobiet ciężarnych ZUM najczęściej jest powodowane obecnością Escherichia coli (30,8–90%), bakterii z grupy Staphylococcus (4,3–32%), Proteus mirabilis (10,2%), Enterococcus faecalis (1–8,1%), Klebsiella pneumoniae (6,1–9,1%) [25, 26, 32]. W grupie niemowląt najczęstszymi patogenami były kolejno: Escherichia coli (65,9%), Klebsiella (14,6%) i Staphylococci (9,8%) [29].
Antybiotykoterapia
Zalecenia francuskie wydane przez French Language Infectious Pathology Society (fr. Société de Pathologie Infectieuse de Langue Française – SPILF) rekomendują stosowanie kolejno fosfomycyny, nitrofurantoiny i chinolonów w terapii zapalenia pęcherza moczowego i trzeciej generacji cefalosporyn w odmiedniczkowym zapaleniu nerek [33]. Rekomendacje American Urological Association, Canadian Urological Association, Society of Urodynamics, Female Pelvic Medicine and Urogenital Reconstruction, European Urological Society dotyczące antybiotykoterapii zebrano w tabeli 1. U kobiet ciężarnych z bezobjawową bakteriurią za każdym razem leczenie powinno być ukierunkowane, co oznacza konieczność wykonania posiewu moczu z antybiogramem. W przypadku stanów ostrych należy pobrać posiew moczu i w oczekiwaniu na wynik rozpocząć leczenie. Pierwszym wyborem w ciąży jest podanie cefalosporyn. Zgodnie z danymi, które przedstawili Kashif i wsp. [25], należy zachować ostrożność w zalecaniu ciężarnym nitrofurantoiny (może powodować hemolizę u płodu), amoksycyliny z kwasem klawulanowym (w III trymestrze obserwowano u dzieci martwicze zapalenie jelit) i trimetoprimu (antagonista kwasu foliowego). Około 7–10 dni po zakończeniu leczenia zasadne jest powtórne wykonanie posiewu w celu upewnienia się, czy było ono skuteczne. Doskonałą alternatywą jest podanie jednej dawki fosfomycyny. Zgodnie z opublikowaną w 2020 r. metaanalizą lek jest równie skuteczny jak inne antybiotyki i bezpieczny zarówno u kobiet ciężarnych, jak i u niebędących w ciąży [34]. W badaniach Malmartel i wsp. [31] sprawdzono częstość pojawiania się antybiotykooporności bakterii wywołujących ZUM (tab. 2). Nieco częściej oporność na ofloksacynę i cefiksym stwierdzano u osób chorych na cukrzycę.


Profilaktyka nieantybiotykowa – immunomodulacja
Lekiem o działaniu immunomodulacyjnym jest OM-89 [11, 35]. Preparat ten jest skuteczny w przypadku zakażenia Escherichia coli, a więc w 70–80% ZUM. Po zastosowaniu OM-89 u kobiet z zakażeniami nawrotowymi w ciągu 6-miesięcznej terapii ponad 2-krotnie rzadziej (67,3% vs 32,7%) obserwowano nawrotowe ZUM [36]. Czynnikiem, który wyraźnie obniżał skuteczność terapii, była źle kontrolowana cukrzyca. W wieloośrodkowym badaniu przeprowadzonym metodą podwójnie ślepej próby wśród 453 kobiet stwierdzono 34-procentową redukcję ZUM po 3-miesięcznej terapii i 10-dniowym kursie przypominającym preparatem OM-89 [30]. Przy identycznym schemacie leczenia w badaniach retrospektywnych 79 osób głównym patogenem (u 49% badanych) była Escherichia coli [11]. Na terapię pozytywnie odpowiedziało 63% zakażonych Escherichia coli i 53% wszystkich badanych. Skuteczność OM-89 została również potwierdzona w badaniu kobiet w okresie menopauzy. Przeprowadzono badanie kliniczne na grupie chorych w średnim wieku 66 lat, u których po immunostymulacji liczba nawrotów spadła z 3,4 do 1,8 (redukcja na poziomie 65%) [37].
Doustna immunomodulacja OM-89 (OM-89) w profilaktyce nawracających ZUM jest rekomendowana zarówno przez Europejskie Towarzystwo Urologiczne (European Association of Urology – EAU) w niepowikłanych ZUM u kobiet (siła dowodów – strong, najwyższy poziom rekomendacji – 1a) [12], jak i Polskie Towarzystwo Urologiczne w profilaktyce nawracających ZUM. Pozwala na zmniejszenie częstości nawrotów, zmniejszenie dolegliwości, liczby przepisywanych antybiotyków oraz ryzyka pojawienia się antybiotykooporności [38]. W zapobieganiu nawracającym ZUM OM-89 podaje się raz dziennie na czczo (30 minut przed posiłkiem) przez 90 dni. Lek może być stosowany razem z antybiotykiem w ostrej fazie zakażenia bez konieczności wcześniejszego uzyskania wyniku posiewu. Spowodowane jest to faktem, że preparat ten indukuje silną odpowiedź immunologiczną wpływającą nie tylko na E. coli, lecz także na inne patogeny, które mogą powodować ZUM. OM-89 ma najwyższy poziom dowodów naukowych pośród wszystkich nieantybiotykowych metod profilaktyki ZUM [12].
Pozostałe metody profilaktyki nieantybiotykowej
Zgodnie z przedstawioną w 2017 r. analizą bazy Cochrane [39] działanie probiotyków w ograniczaniu zakażeń dróg moczowych u osób z zaburzoną funkcją pęcherza wymaga dalszych badań. W badaniach in vitro wykazano, że sok z żurawiny powoduje zmniejszenie przylegania bakterii Escherichia coli do nabłonka wyścielającego drogi moczowe i pochwę [40, 41]. W efekcie pacjentki powinny odczuwać zmniejszenie dolegliwości wynikających z podrażnienia przez bakterie. Redukcja objawów nie musi być równoznaczna z eradykacją zakażenia. W prospektywnych randomizowanych badaniach kobiet w wieku 18–45 lat nie wykazano istotnej statystycznie różnicy w częstości ZUM ocenianych na podstawie posiewów moczu między kobietami pijącymi sok z żurawiny a kobietami przyjmującymi placebo [42]. Podobne konkluzje przedstawiono w analizie bazy Cochrane opublikowanej w 2012 r. [43]. Odrębny problem stanowi leczenie przewlekłych zakażeń układu moczowego i zapobieganie nawrotom. W profilaktyce nawrotów ZUM znalazła zastosowanie D-mannoza. Środek ten zapobiega przyleganiu bakterii do nabłonka układu moczowego. Opublikowana w 2020 r. metaanaliza objęła łącznie 8 prac, ale ostateczne wyniki przedstawiają dane jedynie 163 pacjentek [44]. Wyniki są obiecujące, ale należy zaczekać na kolejne badania, aby ustalić optymalną dawkę leku i czas trwania terapii.
Profilaktyka antybiotykowa
Część lekarzy zaleca kobietom z nawracającymi ZUM profilaktyczne przewlekłe stosowanie antybiotyków. Metaanaliza opublikowana w Cochrane wskazuje, że profilaktyczne zastosowanie antybiotyków u młodych kobiet z nawracającymi zakażeniami dróg moczowych przynosi pozytywne efekty [45]. Zgodnie z wynikami przedstawionymi przez Ahmeda i wsp. [46] przewlekła profilaktyka antybiotykowa u kobiet po 65. roku życia przynosiła zauważalne efekty dopiero przy stosowaniu dłuższym niż 2 lata. Podawano nitrofurantoinę, cefaleksynę lub trimetoprim. Terapia skutkowała zmniejszeniem częstości nawrotów objawowego zakażenia dróg moczowych (OR = 0,57, 95% CI: 0,55–0,59), konieczności dodatkowego wypisywania antybiotyków (OR = 0,61, 95% CI: 0,59–0,62). Równocześnie zaobserwowano niewielkie, ale istotne statystycznie zwiększenie liczby hospitalizacji związanych z infekcją dróg moczowych (OR = 1,16, 95% CI: 1,05–1,28). Według zaleceń EAU profilaktykę antybiotykową należy stosować wtedy, kiedy metody behawioralne (zmiana zachowań zdrowotnych) oraz profilaktyka nieantybiotykowa nie przyniosły oczekiwanego rezultatu.
Zalecenia międzynarodowe i krajowe
Zgodnie z zaleceniami American Urological Association (AUA), Canadian Urological Association (CUA), Society of Urodynamics, Female Pelvic Medicine and Urogenital Reconstruction (SUFU) większość zaleceń ma poziom B lub C [14]. Nawrotowe zapalenie układu moczowego powinno zawsze być potwierdzone wykonaniem posiewu moczu. Przed podjęciem leczenia lekarz powinien uzyskać wynik badania ogólnego moczu oraz posiewu moczu, ale w przypadku bardzo nasilonych objawów może w oczekiwaniu na wyniki zalecić antybiotykoterapię. Bezobjawowa bakteriuria nie powinna być leczona i nie należy w jej przypadku w ogóle wykonywać badań moczu i posiewu moczu. Leczenie antybiotykami w objawowym zakażeniu układu moczowego (w pierwszej linii nitrofurantoiną, trimetoprimem–sulfametoksazolem, fosfomycyną) powinno być prowadzone zgodnie z antybiogramem. Terapia antybiotykiem nie powinna trwać dłużej niż 7 dni, w razie potrzeby lek może być podawany parenteralnie. Jeśli objawy ustąpiły, nie ma wskazań do przeprowadzania badania bakteriologicznego po leczeniu. W razie braku poprawy zasadne jest ponowne wykonanie posiewu i zlecenie leczenia zgodnie z jego wynikiem. U kobiet w okresie około- i pomenopauzalnym celowe jest podawanie dopochwowe estrogenów (przy braku przeciwwskazań). Zgodnie z planem Światowej Organizacji Zdrowia (World Health Organization – WHO) przeciwdziałania indukowaniu nadmiernej antybiotykooporności wymienione towarzystwa dopuszczają profilaktyczne stosowanie żurawiny i innych terapii alternatywnych. Zalecenia EAU zostały opatrzone komentarzem zawierającym przegląd dostępnego piśmiennictwa [12]. Określono siłę przedstawianych rekomendacji. Autorzy zalecają, aby nie prowadzić diagnostyki i terapii bezobjawowej bakteriurii z wyjątkiem kobiet w ciąży (rekomendacja słaba) i pacjentów, u których doszło do naruszenia ciągłości błony śluzowej pęcherza moczowego (rekomendacja silna).
W przypadku diagnostyki niepowikłanego zapalenia dróg moczowych zalecono oparcie rozpoznania na objawach klinicznych przy braku stanów zapalnych pochwy. Wykonanie posiewu moczu zalecono jedynie w przypadku: podejrzenia ostrego odmiedniczkowego zapalenia nerek, kobiet w ciąży, kobiet z nietypowymi objawami, braku ustąpienia objawów 4 tygodnie po zakończeniu leczenia. Pierwsza linia leczenia powinna obejmować podawanie: fosfomycyny, piwampicyliny lub nitrofurantoiny. Terapia aminopenicylinami i fluorochinolonami w niepowikłanym zapaleniu pęcherza moczowego nie jest zalecana (zalecenia silne). Autorzy wskazali, że diagnostyka niepowikłanego zapalenia pęcherza za pomocą pasków testowych ma niską siłę dowodów. W przypadku nawrotowego zapalenia dróg moczowych konieczne jest potwierdzenie diagnozy poprzez wykonanie posiewu moczu z antybiogramem. W ramach profilaktyki nieantybiotykowej nawracających zakażeń powinno się w pierwszej kolejności wdrożyć metody związane z profilaktyką behawioralną oraz zastosować immunostymulację OM-89.
Profilaktyka antybiotykowa jest rekomendowana jedynie w przypadku nawrotu ZUM pomimo zastosowania profilaktyki nieantybiotykowej, profilaktyka przeciwbakteryjna – po stosunkach seksualnych, okresowe krótkotrwałe podawanie leków antybakteryjnych – u kobiet, u których leczenie okazało się skuteczne (zalecenia silne). Jednocześnie jako słabo udowodnione przedstawiono zalecenia podawania estrogenów u kobiet po menopauzie, modyfikacji zachowania i prowadzenia szerokiej diagnostyki obrazowej u kobiet z nawrotowym niepowikłanym zapaleniem pęcherza moczowego. Badanie ogólne moczu (laboratoryjne i paskowe), posiew moczu i badania obrazowe są zalecanie we wszystkich przypadkach odmiedniczkowego zapalenia nerek. Autorzy rekomendacji zalecają leczenie niepowikłanego odmiedniczkowego zapalenia nerek krótkimi kursami fluorochinolonów, hospitalizację jedynie w przypadku konieczności podania antybiotyków drogą parenteralną do czasu przejścia na terapię doustną. Jednocześnie odradzają podawanie nitrofurantoiny, fosfomycyny lub piwampicyliny (zalecenia silne). W przypadku powikłanego nawrotowego zapalenia dróg moczowych zalecane jest podawanie aminoglikozydów z amoksycyliną lub cefalosporyną drugiej generacji, ewentualnie dożylne leczenie cefalosporyną trzeciej generacji przy pojawieniu się objawów ogólnoustrojowych. Ciprofloksacyna jest zalecana jedynie przy leczeniu doustnym, w przypadkach niewymagających hospitalizacji lub przy znanym uczuleniu na wcześniej wymienione antybiotyki. Ciprofloksacyna i inne fluorochinolony są przeciwwskazane, jeśli były stosowane w ciągu poprzednich 6 miesięcy (zalecenie silne). Autorzy nie zalecają rutynowego podawania antybiotyków pacjentom po usunięciu cewnika.
Opublikowane w 2020 r. zalecenia brytyjskiego National Institute for Health and Care Excellence (NICE) dotyczą leczenia zapalenia dolnych dróg moczowych [47]. Poza ciążą leczenie antybiotykiem przez 3 dni jest równie efektywne jak podawanie przez 5 lub 10 dni. U starszych kobiet kuracja może trwać 3–6 dni. Rekomendowanymi lekami pierwszego rzutu są nitrofurantoina lub trimetoprim. Lekami drugiego rzutu są fosfomycyna lub piwampicylina. W ciąży stosowanie antybiotyku powinno trwać 7 dni, przed podaniem należy się upewnić, czy wcześniej nie obserwowano oporności na ten lek. Rekomendowanymi lekami w bezobjawowej bakteriurii są nitrofurantoina, amoksycylina lub cefaleksyna, a w zakażeniu objawowym amoksycylina lub cefaleksyna.
Polskie rekomendacje dotyczące diagnostyki, terapii i profilaktyki ZUM u dorosłych zostały opracowane w 2015 r. w ramach Narodowego Programu Ochrony Antybiotyków [48]. Bezobjawowy bakteriomocz wymaga antybiotykoterapii tylko przed planowanymi zabiegami urologicznymi. W przypadku ostrego niepowikłanego zapalenia pęcherza u młodych kobiet leczenie można podjąć na podstawie objawów klinicznych. Do rozpoznania nie jest konieczne wykonanie badań laboratoryjnych, w tym badania osadu moczowego i posiewu. Większość pacjentek może być leczona ambulatoryjnie. Zgodnie z zaleceniami w leczeniu empirycznym niepowikłanego zapalenia pęcherza moczowego nie należy stosować fluorochinolonów, które powinny być zarezerwowane dla zakażeń powikłanych lub stanów ciężkich. W przypadku nawrotu należy wykonać posiew moczu i do czasu uzyskania wyniku podawać antybiotyk empirycznie. W przypadku powikłanego zakażenia układu moczowego zawsze należy wykonać badanie ogólne moczu, morfologię krwi obwodowej, badanie stężenia CRP, kreatyniny, GFR i posiew moczu.
Terapię należy zmodyfikować zgodnie z wynikiem antybiogramu. Ostre odmiedniczkowe zapalenie nerek zdiagnozowane na podstawie objawów klinicznych zawsze wymaga pobrania posiewu moczu, a w cięższym przebiegu także posiewu krwi. Rozpoczęte leczenie empiryczne powinno być zawsze zweryfikowane na podstawie wyników posiewów. U kobiet ciężarnych autorzy zalecają wykonanie posiewu moczu w I trymestrze ciąży jako profilaktyki odmiedniczkowego zapalenia nerek i porodów przedwczesnych. W przypadku przebytego zapalenia pęcherza moczowego w ciąży kontrolne posiewy powinny być wykonywane co 1–2 miesiące. W ciąży przeciwwskazane są fluorochinolony, a w I trymestrze kotrimoksazol.
Podsumowanie
Zakażenie układu moczowego jest jedną z najczęstszych infekcji u kobiet. Może wystąpić w każdym wieku, ale częściej dotyka kobiet ciężarnych i w okresie pomenopauzalnym. Nierzadko towarzyszy zakażeniom pochwy i najczęściej jest wywoływane przez patogeny pochodzące z końcowych odcinków przewodu pokarmowego. Leczenie antybiotykami powinno być prowadzone przez możliwie najkrótszy okres, a dawkowanie i czas trwania terapii zależą od rodzaju zakażenia.
Obecność bakteriurii bezobjawowej nie zawsze wymaga stosowania antybiotyków, a ich nadużywanie może prowadzić do oporności szczepów bakteryjnych. W zakażeniach przewlekłych i bezobjawowej bakteriurii zawsze warto rozważyć alternatywne terapie zmniejszające ryzyko nawrotów. W przypadku nawracających ZUM w pierwszej kolejności zalecana jest profilaktyka nieantybiotykowa oparta na modyfikacji zachowań zdrowotnych oraz zastosowaniu immunomodulacji układu odpornościowego.
Piśmiennictwo
1. Fihn SD. Clinical practice. Acute uncomplicated urinary tract infection in women. N Engl J Med 2003; 349: 259-266.
2. Griebling TL. Urologic diseases in America project: trends in resource use for urinary tract infections in women. J Urol 2005; 173: 1281-1287.
3. Curtiss N, Meththananda I, Duckett J. Urinary tract infection in obstetrics and gynaecology. Obstet Gynaecol Reprod Med 2017; 27: 261-265.
4. Foxman B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden. Infect Dis Clin North Am 2014; 28: 1-13.
5. Ikäheimo R, Siitonen A, Heiskanen T i wsp. Recurrence of urinary tract infection in a primary care setting: analysis of a 1-year follow-up of 179 women. Clin Infect Dis 1996; 22: 91-99.
6. Foxman B. Recurring urinary tract infection: incidence and risk factors. Am J Public Health 1990; 80: 331-333.
7. Geerlings SE. Clinical presentations and epidemiology of urinary tract infections. Microbiol Spectr 2016; doi: 10.1128/microbiolspec.UTI-0002-2012.
8. Gupta K, Trautner BW. Diagnosis and management of recurrent urinary tract infections in nonpregnant women. BMJ 2013; 346: f3140.
9. Scholes D, Hooton TM, Roberts PL i wsp. Risk factors for recurrent urinary tract infection in young women.
10. J Infect Dis 2000; 182: 1177-1182.
11. van den Boom L, Kalder M, Kostev K. Prevalence of urinary system, pelvic organ, and genital tract disorders among women with type 1 diabetes in Germany. Prim Care Diabetes 2021; 15: 257-261.
12. Brodie A, El-Taji O, Jour I i wsp. A Retrospective study of immunotherapy treatment with Uro-Vaxom (OM-89®) for prophylaxis of recurrent urinary tract infections. Curr Urol 2020; 14: 130-134.
13. Bonkat G, Bartoletti R, Bruyère F i wsp. EAU Guidelines on Urological Infections European As sociation of Urology 2020. https://uroweb.org/guideline/urological-infections/
14. Cody JD, Jacobs ML, Richardson K i wsp. Oestrogen therapy for urinary incontinence in post-menopausal women. Cochrane Database Syst Rev 2012; 10: CD001405.
15. Anger J, Lee U, Ackerman AL i wsp. Recurrent Uncomplicated Urinary Tract Infections in Women: AUA/CUA/SUFU Guideline. J Urol 2019; 202: 282-289.
16. Boyko EJ, Fihn SD, Scholes D i wsp. Diabetes and the risk of acute urinary tract infection among postmenopausal women. Diabetes Care 2002; 25: 1778-1783.
17. Wilke T, Boettger B, Berg B i wsp. Epidemiology of urinary tract infections in type 2 diabetes mellitus patients: an analysis based on a large sample of 456,586 German T2DM patients. J Diabetes Complications 2015; 29: 1015-1023.
18. Nguyen AQ, Foy MP, Sood A, Gonzalez MH. Preoperative risk factors for postoperative urinary tract infection after primary total hip and knee arthroplasties. J Arthroplasty 2021; 36: 734-738.
19. Geerlings SE, Stolk RP, Camps MJL i wsp. Risk factors for symptomatic urinary tract infectionin women with diabetes. Diabetes Care 2000; 23: 1737-1741.
20. Kelestimur F, Pasaoglu H, Basar E i wsp. Asymptomatic bacteriuria in patients with diabetes mellitus. Mikrobiol Bull 1990; 24: 126-132.
21. Laway BA, Nabi T, Bhat MH, Fomda BA. Prevalence, clinical profile and follow up of asymptomatic bacteriuria in patients with type 2 diabetes-prospective case control study in Srinagar, India. Diabetes Metab Syndr 2021; 15: 455-459.
22. Meiland R, Geerlings SE, Stolk RP i wsp. Asymptomatic bacteriuria in women with diabetes mellitus: effect on renal function after 6 years of follow-up. Arch Intern Med 2006; 166: 2222-2227
23. Heidemann J, Schmitz B, Kostev K. Association between antiseizure medication use and risk of urinary tract infection: a case-control study. Epilepsy Behav 2021; 115: 107502.
24. Mitchell BG, Prael G, Curryer C. The frequency of urinary tract infections and the value of antiseptics in community-dwelling people who undertake intermittent urinary catheterization: a systematic review. Am J Infect Cont 2021; doi: 10.1016/j.ajic.2021.01.009
25. Lusardi G, Lipp A, Shaw C. Antibiotic prophylaxis for short-term catheter bladder drainage in adults. Cochrane Database Syst Rev 2013; 7: CD005428.
26. Kashif U, Riaz N, Ramasubramanian SP, Iles D. Urogynaecological complications in pregnancy. Obstet Gynaecol Reprod Med 2021; 31: 42-47.
27. Baraka MA, AlLehaibi LH, AlSuwaidan HN i wsp. Patterns of infections and antimicrobial drugs’ prescribing among pregnant women in Saudi Arabia: a cross sectional study. J Pharm Policy Pract 2021; 14: 9.
28. Sheiner E, Mazor-Drey E, Levy A. Asymptomatic bacteriuria during pregnancy. J Matern Fetal Neonatal Med 2009; 22: 423-427.
29. Mazor-Dray E, Levy A, Schlaeffer F, Sheiner E. Maternal urinary tract infection: is it independently associated with adverse pregnancy outcome? J Matern Fetal Neonatal Med 2009; 22: 124-128.
30. Emamghorashi F, Mahmoodi N, Tagarod Z, Heydari ST. Maternal urinary tract infection as a risk factor for neonatal urinary tract infection. Iran J Kidney Dis 2012; 6: 178-180.
31. Bauer HW, Alloussi S, Egger G. A long-term, multicenter, double-blind study of an escherichia coli extract (OM-89) in female patients with recurrent urinary tract infections. Eur Urol 2005; 47: 542-548.
32. Malmartel A, Ghasarossian C. Bacterial resistance in urinary tract infections in patients with diabetes matched with patients without diabetes. J Diabetes Complications 2016; 30: 705-709.
33. Ali SB, Perdawood D, Abdulrahman RM i wsp. Vitamin D deficiency as a risk factor for urinary tract infection in women at reproductive age. Saudi J Biol Sci 2020; 27: 2942-2947.
34. Société de Pathologie Infectieusede Langue Française. Diagnostic et antibiothérapie des infections urinaires bactériennes communautaires del’adulte. 2014.
35. Wang T, Wu G, Wang J i wsp. Comparison of single-dose fosfomycin tromethamine and other antibiotics for lower uncomplicated urinary tract infection in women and asymptomatic bacteriuria in pregnant women: a systematic review and meta-analysis. Int J Antimicrob Agents 2020; 56: 106018.
36. Wade D, Cooper J, Derry F, Taylor J. Uro-Vaxom® versus placebo for the prevention of recurrent symptomatic urinary tract infections in participants with chronic neurogenic bladder dysfunction: a randomised controlled feasibility study. Trials 2019; 20: 223
37. Han L-Y, Lee Y-S. Risk factor affecting recurrence of cystitis after Uro-vaxom treatment for female patients with recurrent cystitis. Poster #NM81. Neurourol Urodyn 2017; 36: S104.
38. Popa G, Lauber KD, Rothe H, Rugendorff E. Rezidivierende Harnwegsinfektionen in der Postmenopause. Wirksamkeit einer oralen Immuntherapie mit E. coli-Fraktionen. Muenchn Med Wschr 1996; 138: 713-716.
39. Gołąbek T, Lipiński M, Drewa T i wsp. Zalecenia zespołu ekspertów dotyczące leczenia i profilaktyki zakażeń układu moczowego immunostymulatorem Uro-Vaxom (OM-89). Prz Urol 2017; 102: 24-29.
40. Toh SL, Boswell-Ruys CL, Lee BSB i wsp. Probiotics for preventing urinary tract infection in people with neuropathic bladder. Cochrane Database Syst Rev 2017; 9: CD010723.
41. Gupta K, Chou MY, Howell A i wsp. Cranberry products inhibit adherence of p-fimbriated Escherichie coli to primary cultured bladder and vaginal epithelium cells. J Urol 2007; 177: 2357-2360.
42. Lavigne JP, Bourg G, Combescure B i wsp. In vitro and in vivo evidence of dose dependent decrease of uropathogenic Escherichia coli virulence after consumption of commercial Vaccinium macrocarpon (cranberry) capsules. Clin Microbiol Infect 2008; 14: 350-355.
43. Stapleton AE, Dziura J, Hooton TM i wsp. Recurrent urinary tract infection and urinary Escherichia coli in women ingestingCranberry juicedaily: a randomized controlled trial. Mayo Clinic Proceedings 2012; 87: 143-150.
44. Jepson RG, Williams G, Craig JC. Cranberries for preventing urinary tract infections. Cochrane Database Syst Rev 2012; 10: CD001321.
45. Lenger SM, Bradley MS, Thomas DA i wsp. D-mannose vs other agents for recurrent urinary tract infection prevention in adult women: a systematic review and meta-analysis. Am J Obstet Gynecol 2020; 223: 265.e1-265.e13.
46. Albert X, Huertas I, Pereiro II i wsp. Antibiotics for preventing recurrent urinary tract infection in non-pregnant women. Cochrane Database Syst Rev 2004; 3: Cd001209.
47. Ahmed H, Farewell D, Jones HM i wsp. Antibiotic prophylaxis and clinical outcomes among older adults with recurrent urinary tract infection: cohort study. Age Ageing 2019; 48: 228-234.
48. NICE guideline [NG109]. Urinary tract infection (lower): antimicrobial prescribing. Published: 31 October 2018. www.nice.org.uk/guidance/ng109.
49. Hryniewicz W, Holecki M (red.). Rekomendacje diagnostyki, terapii i profilaktyki zakażeń układu moczowego u dorosłych. Wydawnictwo sfinansowane ze środków będących w dyspozycji Ministra Zdrowia w ramach programu zdrowotnego pn.: „Narodowy Program Ochrony Antybiotyków na lata 2011–2015”. Warszawa 2015.
Źródło:
Lekarz POZ 2/2021 vol. 7
Lekarz POZ 2/2021 vol. 7