Stanowisko PTEiLChZ, PTHepat i PTMR w zakresie diagnostyki zakażeń HCV w ramach POZ

Wczesne zdiagnozowanie zakażenia HCV oraz wdrożenie terapii bezinterferonowej daje praktycznie u 100% pacjentów możliwość zahamowania procesu chorobowego i ograniczenia długofalowych następstw zakażenia. Celowe jest prowadzenie badań populacyjnych, w ramach których każdy pacjent POZ miałby przynajmniej raz w życiu wykonany test anty-HCV.
Autorzy: Agnieszka Mastalerz-Migas, Robert Flisiak, Jarosław Drobnik, Krzysztof Tomasiewicz, Małgorzata Pawłowska
Wstęp
Zakażenia wirusem zapalenia wątroby typu C (hepatitis C virus – HCV) występują we wszystkich regionach świata. Wirusowe zapalenie wątroby typu C (WZW C) jest zaliczane przez WHO do najważniejszych zagrożeń zdrowia publicznego. Szacuje się, że na świecie zakażonych jest tym wirusem ok. 71 mln ludzi [1]. Ze względu na brak szczepionki, a także długi okres bezobjawowego przebiegu infekcji najważniejszym elementem walki z zakażeniem HCV pozostają obecnie wczesna diagnostyka oraz jak najszybsze zapewnienie dostępu do wysoce skutecznego leczenia przeciwwirusowego z użyciem leków o bezpośrednim działaniu przeciwwirusowym (direct acting antivirals – DAAs), dzięki czemu możliwe jest wyeliminowanie zakażenia HCV u blisko 100% pacjentów.
Szacuje się, że najwięcej zakażeń HCV występuje we wschodnim regionie Morza Śródziemnego i w regionie europejskim – w każdym z nich jest zakażonych 12 mln osób. Na obszarze Azji Południowo-Wschodniej i Zachodniego Pacyfiku po ok. 10 mln ludzi jest przewlekle zakażonych HCV. Z kolei w Afryce przewlekle zakażonych jest 9 mln ludzi, a w obu Amerykach 5 mln [2]. Szacuje się, że w Polsce zakażone HCV jest ok. 0,4–0,5% populacji, co przekłada się na liczbę ok. 150 tys. osób, które najczęściej nie są świadome zakażenia [3].
W 2016 r. WHO opublikowała strategię eliminacji zakażeń HCV jako zagrożenia zdrowia publicznego, której podstawowymi założeniami są zmniejszenie liczby nowych zakażeń HCV o 90% i redukcja śmiertelności z powodu ich klinicznych następstw o 65% [4, 5].
Analiza przeprowadzona dla Polski w 2019 r. wskazała jednoznacznie, że aby osiągnąć cele WHO w zakresie eliminacji WZW C do 2030 r., konieczne jest leczenie ok. 12 tys. osób rocznie [6]. Założenie to wiąże się z koniecznością uruchomienia w trybie pilnym ogólnopolskiego programu powszechnych badań przesiewowych, które umożliwiłyby testowanie ok. 2–2,5 mln osób rocznie. Niestety w świetle aktualnych analiz, bez uruchomienia Narodowego Programu Eliminacji HCV, Polska osiągnie cele zakładane przez WHO dopiero po 2050 r. [7].
Zgodnie z wytycznymi CDC dotyczącymi testów w kierunku HCV opublikowanymi w 2020 r. testowanie każdej osoby przynajmniej raz w życiu bez względu na czynniki ryzyka jest zalecane w populacjach o częstości występowania zakażeń HCV na poziomie > 0,1% [8]. Polska jako kraj o szacowanym odsetku zakażeń HCV 0,4–0,5% spełnia więc kryterium implementacji strategii screeningu populacyjnego. Obecnie mamy jednak do czynienia z sytuacją, w której koszt wykonania takiego testu nie jest refundowany ze środków publicznych (poza grupą dawców krwi oraz kobiet w ciąży).
Poniższe rekomendacje mają na celu usystematyzowanie wiedzy na temat zakażenia HCV w sposób ułatwiający lekarzowi rodzinnemu wdrożenie działań zmierzających do szybkiego zidentyfikowania zakażenia w celu podjęcia leczenia pozwalającego ochronić pacjentów przed długofalowymi konsekwencjami, takimi jak marskość wątroby czy rak wątrobowokomórkowy.
Epidemiologia
Jak wynika z badań populacyjnych, częstość występowania zakażenia HCV w krajach Europy Zachodniej i Środkowej wynosi średnio 2,4%, a w krajach Europy Wschodniej 2,9%. Badania wykonywane w ramach programu Swiss Contribution (w grupie 21 875 osób) oraz akcji przesiewowych w różnych regionach Polski i w różnych populacjach (łącznie ponad 300 tys. osób) wskazały na częstość aktywnych zakażeń na poziomie odpowiednio 0,47% i ok. 0,4%, co oznacza, że ponad 150 tys. mieszkańców naszego kraju wymaga rozpoznania zakażenia oraz jego leczenia [6]. Infekcja HCV u większości osób przebiega bezobjawowo, dlatego większość zakażonych zarówno w Polsce, jak i na świecie nie jest tego świadoma. Szacuje się, że jedna trzecia zakażeń HCV w Unii Europejskiej została zdiagnozowana, przy czym istnieje duże zróżnicowanie tego odsetka. W takich krajach, jak Szwecja, Malta, Finlandia i Francja, zdiagnozowano już ponad 70% zakażeń, podczas gdy w Polsce, Bułgarii, Słowacji i Litwie wykryto mniej niż 20%. Polska znajduje się dodatkowo w grupie 9 krajów Europy (pozostałe to: Włochy, Rumunia, Hiszpania, Niemcy, Francja, Wielka Brytania, Grecja i Bułgaria), które odpowiadają za 80% wszystkich zakażeń HCV występujących w naszym regionie [9].
Dane Narodowego Instytutu Zdrowia Publicznego – Państwowego Zakładu Higieny wskazują, że w 2018 r. zakażenia HCV wykryte w placówkach POZ stanowiły ok. 30% wszystkich zarejestrowanych przypadków, co świadczy o bardzo ważnej roli POZ w diagnostyce HCV w Polsce. Warto zaznaczyć, że zakażenie HCV wykrywano w placówkach POZ głównie wśród pacjentów w wieku 50–69 lat, co stanowiło ok. 40% wszystkich zakażeń zdiagnozowanych w tej grupie wiekowej [10].
Według danych GUS w 2018 r. odnotowano 119 zgonów z powodu HCV i w tym samym roku 2100 osób zmarło z powodu raka wątrobowokomórkowego oraz 2061 osób z powodu zwłóknienia i marskości wątroby. W przypadku znacznego odsetka tych osób zakażenie HCV mogło stanowić przyczynę wyjściową zgonu [10]. Według szacunków Polaris Observatory Study (CDA Fundation) rocznie ok. 620 osób umiera w Polsce z powodu HCV [11]. Biorąc pod uwagę powszechną dostępność wysoce skutecznej i bezpiecznej terapii bezinterferonowej, liczba zgonów wskazuje na to, że kluczowym problemem jest wykrywanie osób zakażonych HCV i ich właściwe kierowanie do dalszego leczenia.
Obraz kliniczny
Wirus zapalenia wątroby typu C powoduje zarówno ostrą, jak i przewlekłą infekcję. W pierwszym etapie następuje progresja ostrego zapalenia wątroby z szybko rozwijającymi się zmianami martwiczo-zapalnymi w wątrobie. W ok. 70–80% przypadków ostre zapalenie wątroby typu C przebiega jednak bezobjawowo. Spontaniczna eliminacja HCV występuje u 14–46% pacjentów. Jeśli wirus nie zostanie wyeliminowany spontanicznie w ostrej fazie choroby, to przechodzi ona w przewlekłe zapalenie wątroby. Charakteryzuje się ono licznymi zmianami martwiczymi i zapalnymi, a także zaburzeniami czynnościowymi i architektonicznymi struktury wątroby. Trwająca przez wiele lat bezobjawowa choroba ma poważne konsekwencje, które powodują skrócenie życie i pogorszenie jego jakości. Rozwijającej się z czasem niewydolności wątroby może towarzyszyć marskość i/lub rak wątrobowokomórkowy. Szacuje się, że ok. 85% pacjentów z HCV jest nieświadomych swojej choroby [12].
Przewlekłe zakażenie HCV może powodować istotne objawy pozawątrobowe i powinno być traktowane jako choroba ogólnoustrojowa, a nie tylko choroba wątroby. Należy podkreślić, że nasilenie tych zaburzeń niekoniecznie koreluje z nasileniem choroby wątroby, ponieważ nawet w przypadku przewlekłego zapalenia wątroby o nieznacznej aktywności manifestacje pozawątrobowe mogą znacznie pogorszyć stan zdrowia i jakość życia. Badania wykazały, że u znacznego odsetka pacjentów terapia przewlekłego zakażenia HCV może skutkować ustąpieniem pozawątrobowych objawów lub poprawą funkcji dotkniętych narządów, zmniejszając ryzyko zachorowania i zgonu [13, 14].
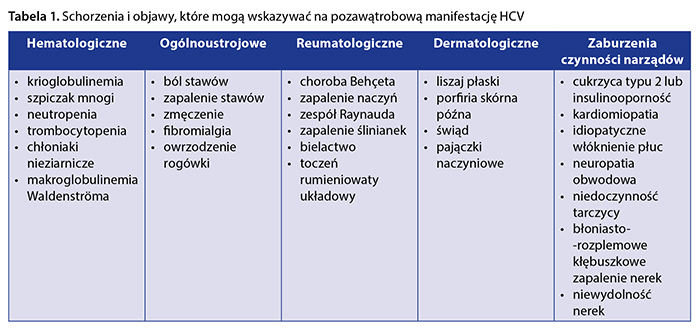
Zestawienie schorzeń i objawów mogących wskazywać na pozawątrobową manifestację zakażenia HCV, które należy rozważyć w trakcie diagnostyki różnicowej, przedstawiono w tabeli 1.
Diagnostyka i rozpoznanie zakażenia HCV
Standard postępowania diagnostycznego w kierunku HCV obejmuje dwa badania: oznaczanie obecności przeciwciał anty-HCV oraz HCV RNA. W niektórych krajach stosuje się również badanie ukierunkowane na wykrycie antygenu rdzeniowego wirusa (HCV core antigen), które w procesie diagnostyki może zastąpić badanie HCV RNA, jednak w Polsce nie zyskało ono dotychczas szerokiego uznania w codziennej praktyce klinicznej. Materiał genetyczny wirusa (HCV RNA) wykrywa się we krwi po ok. 1–3 tygodniach od momentu zakażenia, podczas gdy przeciwciała anty-HCV są wykrywalne we krwi dopiero po ok. 4–10 tygodniach od zakażenia [3].
Badanie w kierunku obecności przeciwciał anty-HCV wykonuje się jako badanie przesiewowe, określające, czy dany pacjent miał kiedykolwiek kontakt z HCV. Uzyskanie wyniku reaktywnego powinno zainicjować diagnostykę uzupełniającą polegającą na badaniu PCR w kierunku obecności we krwi HCV RNA. Jego obecność jednoznacznie potwierdza aktywne zakażenie HCV. HCV RNA jest wykrywane u 30–70% osób z obecnymi przeciwciałami
anty-HCV. Od ścieżki dwuetapowego testowania: anty-HCV HCV RNA, odstępuje się i bada wyłącznie HCV RNA, w przypadku:
• podejrzenia powtórnego zakażenia HCV u osób, które wyeliminowały wirusa samoistnie lub na skutek terapii,
• osób po ekspozycji na zakażenie HCV, u których spodziewamy się, że są jeszcze w okienku serologicznym i mogą nie mieć wystarczającej ilości przeciwciał pomimo aktywnego zakażenia,
• osób z upośledzeniem odporności, w tym poddanych terapii immunosupresyjnej, u których spodziewamy się niewystarczającej odpowiedzi immunologicznej na zakażenie HCV,
• dzieci urodzonych z matek zakażonych HCV, które przez ok. 18 miesięcy po porodzie będą miały we krwi przeciwciała przekazane przez matkę.
W tabeli 2 przedstawiono zasady interpretacji wyników badań laboratoryjnych stosowanych w diagnostyce HCV (przeciwciała anty-HCV i HCV RNA) [15].

W ostatnich latach pojawiło się wiele wiarygodnych testów diagnostycznych badających obecność przeciwciał anty-HCV (np. we krwi pełnej lub włośniczkowej, osoczu lub ślinie) umożliwiających odczytanie wyniku w ciągu 10–15 minut, czyli w czasie pojedynczej wizyty pacjenta. Dzięki temu możliwe jest wykorzystanie w badaniach przesiewowych szybkich testów, które mogą być alternatywą dla standardowych testów laboratoryjnych [16].
W diagnostyce HCV RNA zaleca się stosowanie czułych metod molekularnych [16, 17]. W ostatnim czasie pojawiły się możliwości wykonywania szybkich testów molekularnych, których wynik jest dostępny już po 45 minutach.
Wytyczne dotyczące testowania w kierunku HCV coraz częściej sugerują, że badanie na obecność przeciwciał anty-HCV powinna wykonać przynajmniej raz w życiu każda osoba dorosła. W opublikowanych w 2020 r. wytycznych CDC działanie takie jest zalecane w przypadku populacji, w których odsetek zakażeń HCV jest > 0,1% [8]. Podkreśla się również, że badanie takie powinno być wykonywane u każdej kobiety w ciąży, a w przypadku osób z grup wysokiego ryzyka (np. używających narkotyków dożylnie), które mogą częściej podlegać potencjalnej ekspozycji na HCV, powinny być wykonywane cyklicznie, np. co 12 miesięcy [8, 16].
W Polsce kwestię zasadności testowania w kierunku HCV oceniała w ostatnich latach Agencja Oceny Technologii Medycznych i Taryfikacji (AOTMiT). Agencja wydała dwie oceny w tej sprawie – w obu uznano testowanie za zasadne. Pierwsze zalecenie, wydane 13 listopada 2017 r., wskazywało na zasadność testowania w ramach POZ osób z określonych grup, mających w wywiadzie czynniki mogące wskazywać na zwiększone ryzyko zakażenia HCV [18]. Niestety do dziś nie znalazło to odzwierciedlenia ani w ustawie o świadczeniach gwarantowanych, ani w żadnym z programów profilaktyki zdrowotnej realizowanych w placówkach POZ, który umożliwiłby powszechne i szerokie testowanie w kierunku HCV. Druga z rekomendacji AOTMiT, wydana 30 listopada 2020 r., odnosi się do działań przeprowadzanych w ramach programów polityki zdrowotnej dotyczących profilaktyki przewlekłych zakażeń HCV i HBV [19].
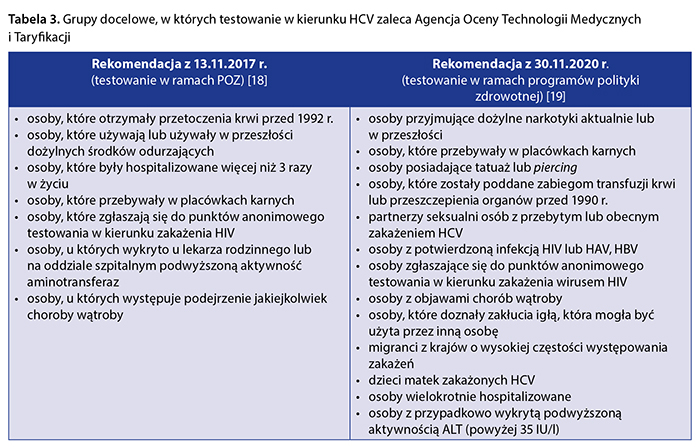
W tabeli 3 zestawiono grupy docelowe, w których testowanie w kierunku HCV AOTMiT uznała za zasadne w wydanych rekomendacjach.
Dodatkowo w opinii z 13 listopada 2017 r., poza grupami wymienionymi w zaleceniu Ministra Zdrowia, AOTMiT uznała za zasadne wykonywanie badań przesiewowych również u:
• osób przyjmujących narkotyki donosowo,
• dzieci matek zakażonych HCV,
• pacjentów dializowanych,
• pracowników systemu opieki zdrowotnej, służb mundurowych po ukłuciu igłą lub kontakcie z krwią zakażoną HCV,
• dzieci i młodzieży z placówek wychowawczych,
• osób poddanych zabiegom medycznym w Afryce, Azji, na Karaibach, w Ameryce Środkowej i Południowej, Europie Wschodniej i Południowej, na Bliskim Wschodzie i na wyspach Pacyfiku [18].
Rekomendacja AOTMiT z 30 listopada 2020 r. zaleca także, aby przeprowadzić dodatkowo działania informacyjno-edukacyjne i diagnostyczną wizytę lekarską u wszystkich osób, które będą objęte programami polityki zdrowotnej dotyczącymi profilaktyki przewlekłych zakażeń HCV. Wszystkie wymienione działania powinny być prowadzone przez odpowiednio przeszkolony, wykształcony personel [19].
Zalecana strategia postępowania w ograniczaniu liczby zakażeń HCV
W związku z brakiem szczepień przeciwko wirusowemu zapaleniu wątroby typu C konieczne jest podjęcie działań w celu powstrzymania rozprzestrzeniania się wirusa. Działania te obejmują:
• edukację i promocję zachowań zmniejszających ryzyko transmisji infekcji,
• przeprowadzanie ogólnokrajowego badania populacyjnego,
• zapewnienie szerszego dostępu do badań w kierunku HCV, umożliwiającego wczesne wykrywanie i diagnozowanie jak największej liczby osób zakażonych na poziomie lokalnym.
Takie działania w połączeniu z szeroką dostępnością krótkich, wysoce skutecznych i bezpiecznych terapii przeciwwirusowych znacznie zwiększą szanse realizacji strategii WHO eliminacji zakażeń HCV. Działania profilaktyczne i leczenie na wczesnym etapie zakażenia obniżyłyby również koszty terapii pacjentów z poważnymi powikłaniami zapalenia wątroby typu C, w tym z marskością i rakiem wątrobowokomórkowym, ponoszone przez NFZ [12].
Jak pokazały doświadczenia innych krajów, wprowadzenie aktywnych działań dla osiągnięcia celów WHO przynosi korzyść. W większości z nich podjęto decyzję o równoczesnym upowszechnieniu dostępu do testowania w kierunku HCV i terapii przeciwwirusowych. Niestety część krajów, w tym Polska, nie osiągnie tych celów do 2030 r., ponieważ nie inwestuje i nie angażuje się w pełni w programy umożliwiające eliminację zakażeń pomimo świadomości, że działanie takie jest wysoce opłacalne [20].
Lekarze rodzinni i placówki POZ są ważnym elementem akcji edukacyjnych i profilaktycznych. Często mają wieloletni kontakt ze swoimi pacjentami, są obdarzani zaufaniem i wiarygodni dla członków społeczności. Z łatwością docierają do dużych grup pacjentów, znają ich przeszłość medyczną. Wiedza lekarzy POZ na temat czynników ryzyka – demograficznych, behawioralnych czy zawodowych – oraz klinicznych objawów zapalenia wątroby może skutecznie poprawić identyfikację przypadków zakażeń, szczególnie przy realizacji programów profilaktycznych skierowanych do grup ryzyka, wskazanych w rekomendacji AOTMiT.
Zalecana ścieżka (algorytm) diagnostyki na poziomie POZ
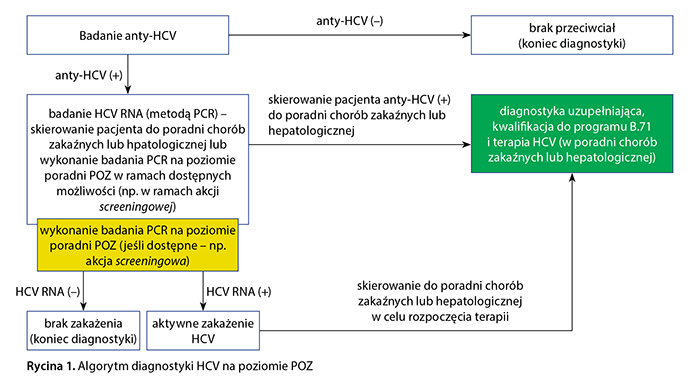
Zalecany algorytm diagnostyczny, który mógłby być rozważany do implementacji w placówkach POZ, przedstawiono na rycinie 1.
W przypadku uruchomienia śladem innych krajów Narodowego Programu Eliminacji HCV celowe byłoby przyjęcie strategii testowania przynajmniej raz w życiu każdej osoby dorosłej. Należałoby też uwzględnić dodatkowe testowanie wszystkich osób, u których wystąpiło realne i uprawdopodobnione ryzyko znalezienia się w sytuacji stwarzającej istotne zagrożenie zakażeniem HCV, a także cykliczne testowanie (np. co 12 miesięcy) osób z tzw. grup podwyższonego ryzyka nabycia zakażenia, np. uzależnionych od środków odurzających, mężczyzn utrzymujących niezabezpieczone kontakty seksualne z mężczyznami (tzw. MSM) czy świadczących usługi seksualne.
Podstawowy algorytm diagnostyczny powinien się opierać na 2 badaniach, czyli anty-HCV (wykonanym w laboratorium lub z użyciem szybkich testów diagnostycznych) i HCV RNA (wykonanym techniką PCR o czułości ≤ 25 IU/ml) [16].
Pierwszym i podstawowym powinno pozostać badanie na obecność przeciwciał anty-HCV, które może być wykonane zarówno z wykorzystaniem standardowej ścieżki laboratoryjnej, jak i z użyciem coraz popularniejszych szybkich testów diagnostycznych (rapid diagnostic tests – RDTs), które umożliwiają szybką (w ciągu 10–15 minut) ocenę statusu serologicznego pacjenta, w czasie jednej wizyty. Obecnie stosowane testy kasetkowe charakteryzują się zarówno bardzo wysoką czułością, jak i swoistością, a dzięki minimalnej ilości potrzebnej krwi oraz możliwości szybkiego odczytania wyniku mogą być powszechnie wykorzystywane w akcjach screeningowych skierowanych do osób sporadycznie odwiedzających placówki medyczne. W przypadku wykrycia obecności przeciwciał anty-HCV w surowicy pacjenta konieczne jest wykonanie badania na obecność materiału genetycznego wirusa, tzn. HCV RNA, w celu potwierdzenia aktywnego zakażenia.
Badanie HCV RNA może być wykonane w poradni specjalistycznej (chorób zakaźnych lub hepatologicznej) na podstawie skierowania wystawionego przez lekarza POZ.
Drugą z możliwych obecnie ścieżek skierowania na bezpłatne badanie HCV RNA jest skorzystanie z puli badań dostępnych w ramach akcji profilaktycznej realizowanej przez laboratoria diagnostyczne (np. ALAB i Diagnostyka).
Grupami szczególnymi, w których zaleca się wykonanie badania HCV RNA od razu na pierwszym etapie diagnostyki, są pacjenci w przeszłości poddani skutecznej terapii zakażenia i obecnie testowani np. ze względu na wystąpienie sytuacji mogącej powodować powtórne zakażenie HCV, a także dzieci urodzone przez matki zakażone HCV, które testuje się w pierwszych miesiącach po urodzeniu, aby ocenić, czy doszło do zakażenia wertykalnego.
Wykrycie materiału genetycznego wirusa (pozytywny wynik badania HCV RNA) w poradni lekarza POZ powinno skutkować jak najszybszym skierowaniem pacjenta do poradni specjalistycznej (chorób zakaźnych lub hepatologicznej) w celu jak najszybszego wykonania diagnostyki uzupełniającej – wymaganej w ramach programu lekowego (B.71), która pozwala na szybkie podjęcie leczenia, zapewnia skuteczne zahamowanie infekcji oraz umożliwia ograniczenie konsekwencji zdrowotnych wynikających z trwającego procesu zapalnego.
Podsumowanie – rekomendacje dla lekarzy POZ
Zakażenie HCV u zdecydowanej większości pacjentów przebiega bezobjawowo przez wiele lat (nawet ponad 20–30 lat), dlatego ważne jest aktywne poszukiwanie zakażenia, by jak najszybciej wykryć osoby zakażone i zahamować proces zapalny. Wczesne zdiagnozowanie zakażenia HCV oraz podjęcie skutecznego leczenia terapią bezinterferonową daje praktycznie u 100% pacjentów możliwość zahamowania procesu chorobowego i ograniczenia długofalowych następstw zakażenia.
Diagnostyka HCV jest realizowana dwuetapowo – w pierwszym etapie należy zbadać obecność przeciwciał anty-HCV, a po ich wykryciu skierować pacjenta na badanie HCV RNA, którego obecność potwierdza aktywne zakażenie.
Celowe jest prowadzenie badań populacyjnych, w ramach których każdy pacjent POZ miałby przynajmniej raz w życiu wykonany test anty-HCV.
Do czasu ewentualnego włączenia badań anty-HCV do koszyka świadczeń gwarantowanych na poziomie POZ warto korzystać z dostępnych akcji profilaktycznych.
Doskonałym narzędziem wstępnej diagnostyki HCV na poziomie POZ są szybkie testy diagnostyczne (RDT), które pod względem czułości i swoistości nie ustępują tradycyjnym metodom laboratoryjnym.
Piśmiennictwo
1. Dore GJ, Hatzakis A, Negro F, Waked I. Estimating HCV disease burden (editorial). J Viral Hepat 2017; 24 (Suppl. 2): 4-7.
2. https://www.who.int/news-room/fact-sheets/detail/hepatitis-c
3. The Polish Group of Experts for HCV. Recommendations of the Polish Group of Experts for HCV for the treatment of hepatitis C in 2020. Clin Exp HEPATOL 2020; 6:
163-169.
4. WHO. Global hepatitis report, 2017. World Health Organization, Geneva, Switzerland. http://apps.who.int/iris/bitstream/10665/255016/1/9789241565455-eng.pdf
5. WHO. Global health sector strategy on viral hepatitis 2016–2021. World Health Organization, Geneva, Switzerland. http://apps.who.int/iris/bitstream/10665/246177/1/WHO-HIV-2016.06-eng.pdf
6. Flisiak R. Perspektywy eliminacji wirusa zapalenia wątroby typu C w Polsce. Hepatologia 2019; 19: 47-51.
7. Razavi H, Sanchez Gonzalez Y, Yuen C, Cornberg M. Global timing of hepatitis C virus elimination in high-income countries. Liver Int 2020; 40: 522-529.
8. Havens PL, Anderson JR. Updated CDC recommendations for universal hepatitis c virus screening among adults and pregnant women: implications for clinical practice. JAMA 2020; 323: 2258-2259.
9. Cooke GS. Accelerating the elimination of viral hepatitis: a Lancet Gastroenterology & Hepatology Commission. Lancet Gastroenterol Hepatol 2019; 4: 135-184.
10. Zakrzewska K, Stępień M, Rosińska M. Wirusowe zapalenie wątroby typu C (WZW C) w Polsce w 2018 roku, Przegl Epidemiol 2020; 74: 209-222.
11. The Polaris Observatory, Country Dashboard [Poland], https://cdafound.org/polaris-countries-dashboard/ (dostęp: 05.09.2021).
12. Kobierski J, Hałdaś M, Władysiuk M. Hepatitis C – the implications and the need for change in the health care system in Poland. JHPOR 2014; 2: 6-34.
13. Gill K, Ghazinian H, Manch R, Gish R. Hepatitis C virus as a systemic disease: reaching beyond the liver. Hepatol Int 2016; 10: 415-423.
14. Cacoub P, Saadoun D. Extrahepatic manifestations of chronic HCV infection. N Engl J Med 2021; 384: 1038-1052.
15. Flisiak R, Małkowski P (red.). Recepta na HCV: przewodnik lekarza. PZWL Wydawnictwo Lekarskie, Warszawa 2019.
16. AASLD/IDSA HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. Published 2021 Jan 21. https://www.hcvguidelines.org/sites/default/files/full-guidance-pdf/AASLD-IDSA_HCVGuidance_January_21_2021.pdf
17. Madaliński K, Flisiak R, Halota W i wsp. Diagnostyka laboratoryjna zakażeń wirusem zapalenia wątroby typu C. Rekomendacje Polskiej Grupy Roboczej 2012/2013. J Lab Diag 2013; 49; 65-70.
18. Rekomendacja BP.434.26.2017.TN z 13 listopada 2017, AOTMiT. https://bipold.aotm.gov.pl/assets/files/zlecenia_mz/2017/120/REK/BP.434.26.2017_HCV.pdf
19. Rekomendacja nr 3/2020 z dnia 30 listopada 2020 Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie zalecanych technologii medycznych, działań przeprowadzanych w ramach programów polityki zdrowotnej oraz warunków realizacji tych programów, dotyczących profilaktyki przewlekłych zakażeń HCV i HBV. https://bipold.aotm.gov.pl/assets/files/ppz/2020/REK/3_2020.pdf
20. Pedrana A, Munari S, Stoové M i wsp. The phases of hepatitis C elimination: achieving WHO elimination targets. Lancet Gastroenterol Hepatol 2021; 6: 6-8.
Pełna treść artykułu:Agnieszka Mastalerz-Migas, Robert Flisiak, Jarosław Drobnik, Krzysztof Tomasiewicz, Małgorzata Pawłowska. Stanowisko Polskiego Towarzystwa Epidemiologów i Lekarzy Chorób Zakaźnych, Polskiego Towarzystwa Hepatologicznego i Polskiego Towarzystwa Medycyny Rodzinnej w zakresie diagnostyki zakażeń HCV w ramach podstawowej opieki zdrowotnej. Lekarz POZ 2021; 7(4): 243-249.
Wstęp
Zakażenia wirusem zapalenia wątroby typu C (hepatitis C virus – HCV) występują we wszystkich regionach świata. Wirusowe zapalenie wątroby typu C (WZW C) jest zaliczane przez WHO do najważniejszych zagrożeń zdrowia publicznego. Szacuje się, że na świecie zakażonych jest tym wirusem ok. 71 mln ludzi [1]. Ze względu na brak szczepionki, a także długi okres bezobjawowego przebiegu infekcji najważniejszym elementem walki z zakażeniem HCV pozostają obecnie wczesna diagnostyka oraz jak najszybsze zapewnienie dostępu do wysoce skutecznego leczenia przeciwwirusowego z użyciem leków o bezpośrednim działaniu przeciwwirusowym (direct acting antivirals – DAAs), dzięki czemu możliwe jest wyeliminowanie zakażenia HCV u blisko 100% pacjentów.
Szacuje się, że najwięcej zakażeń HCV występuje we wschodnim regionie Morza Śródziemnego i w regionie europejskim – w każdym z nich jest zakażonych 12 mln osób. Na obszarze Azji Południowo-Wschodniej i Zachodniego Pacyfiku po ok. 10 mln ludzi jest przewlekle zakażonych HCV. Z kolei w Afryce przewlekle zakażonych jest 9 mln ludzi, a w obu Amerykach 5 mln [2]. Szacuje się, że w Polsce zakażone HCV jest ok. 0,4–0,5% populacji, co przekłada się na liczbę ok. 150 tys. osób, które najczęściej nie są świadome zakażenia [3].
W 2016 r. WHO opublikowała strategię eliminacji zakażeń HCV jako zagrożenia zdrowia publicznego, której podstawowymi założeniami są zmniejszenie liczby nowych zakażeń HCV o 90% i redukcja śmiertelności z powodu ich klinicznych następstw o 65% [4, 5].
Analiza przeprowadzona dla Polski w 2019 r. wskazała jednoznacznie, że aby osiągnąć cele WHO w zakresie eliminacji WZW C do 2030 r., konieczne jest leczenie ok. 12 tys. osób rocznie [6]. Założenie to wiąże się z koniecznością uruchomienia w trybie pilnym ogólnopolskiego programu powszechnych badań przesiewowych, które umożliwiłyby testowanie ok. 2–2,5 mln osób rocznie. Niestety w świetle aktualnych analiz, bez uruchomienia Narodowego Programu Eliminacji HCV, Polska osiągnie cele zakładane przez WHO dopiero po 2050 r. [7].
Zgodnie z wytycznymi CDC dotyczącymi testów w kierunku HCV opublikowanymi w 2020 r. testowanie każdej osoby przynajmniej raz w życiu bez względu na czynniki ryzyka jest zalecane w populacjach o częstości występowania zakażeń HCV na poziomie > 0,1% [8]. Polska jako kraj o szacowanym odsetku zakażeń HCV 0,4–0,5% spełnia więc kryterium implementacji strategii screeningu populacyjnego. Obecnie mamy jednak do czynienia z sytuacją, w której koszt wykonania takiego testu nie jest refundowany ze środków publicznych (poza grupą dawców krwi oraz kobiet w ciąży).
Poniższe rekomendacje mają na celu usystematyzowanie wiedzy na temat zakażenia HCV w sposób ułatwiający lekarzowi rodzinnemu wdrożenie działań zmierzających do szybkiego zidentyfikowania zakażenia w celu podjęcia leczenia pozwalającego ochronić pacjentów przed długofalowymi konsekwencjami, takimi jak marskość wątroby czy rak wątrobowokomórkowy.
Epidemiologia
Jak wynika z badań populacyjnych, częstość występowania zakażenia HCV w krajach Europy Zachodniej i Środkowej wynosi średnio 2,4%, a w krajach Europy Wschodniej 2,9%. Badania wykonywane w ramach programu Swiss Contribution (w grupie 21 875 osób) oraz akcji przesiewowych w różnych regionach Polski i w różnych populacjach (łącznie ponad 300 tys. osób) wskazały na częstość aktywnych zakażeń na poziomie odpowiednio 0,47% i ok. 0,4%, co oznacza, że ponad 150 tys. mieszkańców naszego kraju wymaga rozpoznania zakażenia oraz jego leczenia [6]. Infekcja HCV u większości osób przebiega bezobjawowo, dlatego większość zakażonych zarówno w Polsce, jak i na świecie nie jest tego świadoma. Szacuje się, że jedna trzecia zakażeń HCV w Unii Europejskiej została zdiagnozowana, przy czym istnieje duże zróżnicowanie tego odsetka. W takich krajach, jak Szwecja, Malta, Finlandia i Francja, zdiagnozowano już ponad 70% zakażeń, podczas gdy w Polsce, Bułgarii, Słowacji i Litwie wykryto mniej niż 20%. Polska znajduje się dodatkowo w grupie 9 krajów Europy (pozostałe to: Włochy, Rumunia, Hiszpania, Niemcy, Francja, Wielka Brytania, Grecja i Bułgaria), które odpowiadają za 80% wszystkich zakażeń HCV występujących w naszym regionie [9].
Dane Narodowego Instytutu Zdrowia Publicznego – Państwowego Zakładu Higieny wskazują, że w 2018 r. zakażenia HCV wykryte w placówkach POZ stanowiły ok. 30% wszystkich zarejestrowanych przypadków, co świadczy o bardzo ważnej roli POZ w diagnostyce HCV w Polsce. Warto zaznaczyć, że zakażenie HCV wykrywano w placówkach POZ głównie wśród pacjentów w wieku 50–69 lat, co stanowiło ok. 40% wszystkich zakażeń zdiagnozowanych w tej grupie wiekowej [10].
Według danych GUS w 2018 r. odnotowano 119 zgonów z powodu HCV i w tym samym roku 2100 osób zmarło z powodu raka wątrobowokomórkowego oraz 2061 osób z powodu zwłóknienia i marskości wątroby. W przypadku znacznego odsetka tych osób zakażenie HCV mogło stanowić przyczynę wyjściową zgonu [10]. Według szacunków Polaris Observatory Study (CDA Fundation) rocznie ok. 620 osób umiera w Polsce z powodu HCV [11]. Biorąc pod uwagę powszechną dostępność wysoce skutecznej i bezpiecznej terapii bezinterferonowej, liczba zgonów wskazuje na to, że kluczowym problemem jest wykrywanie osób zakażonych HCV i ich właściwe kierowanie do dalszego leczenia.
Obraz kliniczny
Wirus zapalenia wątroby typu C powoduje zarówno ostrą, jak i przewlekłą infekcję. W pierwszym etapie następuje progresja ostrego zapalenia wątroby z szybko rozwijającymi się zmianami martwiczo-zapalnymi w wątrobie. W ok. 70–80% przypadków ostre zapalenie wątroby typu C przebiega jednak bezobjawowo. Spontaniczna eliminacja HCV występuje u 14–46% pacjentów. Jeśli wirus nie zostanie wyeliminowany spontanicznie w ostrej fazie choroby, to przechodzi ona w przewlekłe zapalenie wątroby. Charakteryzuje się ono licznymi zmianami martwiczymi i zapalnymi, a także zaburzeniami czynnościowymi i architektonicznymi struktury wątroby. Trwająca przez wiele lat bezobjawowa choroba ma poważne konsekwencje, które powodują skrócenie życie i pogorszenie jego jakości. Rozwijającej się z czasem niewydolności wątroby może towarzyszyć marskość i/lub rak wątrobowokomórkowy. Szacuje się, że ok. 85% pacjentów z HCV jest nieświadomych swojej choroby [12].
Przewlekłe zakażenie HCV może powodować istotne objawy pozawątrobowe i powinno być traktowane jako choroba ogólnoustrojowa, a nie tylko choroba wątroby. Należy podkreślić, że nasilenie tych zaburzeń niekoniecznie koreluje z nasileniem choroby wątroby, ponieważ nawet w przypadku przewlekłego zapalenia wątroby o nieznacznej aktywności manifestacje pozawątrobowe mogą znacznie pogorszyć stan zdrowia i jakość życia. Badania wykazały, że u znacznego odsetka pacjentów terapia przewlekłego zakażenia HCV może skutkować ustąpieniem pozawątrobowych objawów lub poprawą funkcji dotkniętych narządów, zmniejszając ryzyko zachorowania i zgonu [13, 14].
Zestawienie schorzeń i objawów mogących wskazywać na pozawątrobową manifestację zakażenia HCV, które należy rozważyć w trakcie diagnostyki różnicowej, przedstawiono w tabeli 1.

Diagnostyka i rozpoznanie zakażenia HCV
Standard postępowania diagnostycznego w kierunku HCV obejmuje dwa badania: oznaczanie obecności przeciwciał anty-HCV oraz HCV RNA. W niektórych krajach stosuje się również badanie ukierunkowane na wykrycie antygenu rdzeniowego wirusa (HCV core antigen), które w procesie diagnostyki może zastąpić badanie HCV RNA, jednak w Polsce nie zyskało ono dotychczas szerokiego uznania w codziennej praktyce klinicznej. Materiał genetyczny wirusa (HCV RNA) wykrywa się we krwi po ok. 1–3 tygodniach od momentu zakażenia, podczas gdy przeciwciała anty-HCV są wykrywalne we krwi dopiero po ok. 4–10 tygodniach od zakażenia [3].
Badanie w kierunku obecności przeciwciał anty-HCV wykonuje się jako badanie przesiewowe, określające, czy dany pacjent miał kiedykolwiek kontakt z HCV. Uzyskanie wyniku reaktywnego powinno zainicjować diagnostykę uzupełniającą polegającą na badaniu PCR w kierunku obecności we krwi HCV RNA. Jego obecność jednoznacznie potwierdza aktywne zakażenie HCV. HCV RNA jest wykrywane u 30–70% osób z obecnymi przeciwciałami
anty-HCV. Od ścieżki dwuetapowego testowania: anty-HCV HCV RNA, odstępuje się i bada wyłącznie HCV RNA, w przypadku:
• podejrzenia powtórnego zakażenia HCV u osób, które wyeliminowały wirusa samoistnie lub na skutek terapii,
• osób po ekspozycji na zakażenie HCV, u których spodziewamy się, że są jeszcze w okienku serologicznym i mogą nie mieć wystarczającej ilości przeciwciał pomimo aktywnego zakażenia,
• osób z upośledzeniem odporności, w tym poddanych terapii immunosupresyjnej, u których spodziewamy się niewystarczającej odpowiedzi immunologicznej na zakażenie HCV,
• dzieci urodzonych z matek zakażonych HCV, które przez ok. 18 miesięcy po porodzie będą miały we krwi przeciwciała przekazane przez matkę.
W tabeli 2 przedstawiono zasady interpretacji wyników badań laboratoryjnych stosowanych w diagnostyce HCV (przeciwciała anty-HCV i HCV RNA) [15].

W ostatnich latach pojawiło się wiele wiarygodnych testów diagnostycznych badających obecność przeciwciał anty-HCV (np. we krwi pełnej lub włośniczkowej, osoczu lub ślinie) umożliwiających odczytanie wyniku w ciągu 10–15 minut, czyli w czasie pojedynczej wizyty pacjenta. Dzięki temu możliwe jest wykorzystanie w badaniach przesiewowych szybkich testów, które mogą być alternatywą dla standardowych testów laboratoryjnych [16].
W diagnostyce HCV RNA zaleca się stosowanie czułych metod molekularnych [16, 17]. W ostatnim czasie pojawiły się możliwości wykonywania szybkich testów molekularnych, których wynik jest dostępny już po 45 minutach.
Wytyczne dotyczące testowania w kierunku HCV coraz częściej sugerują, że badanie na obecność przeciwciał anty-HCV powinna wykonać przynajmniej raz w życiu każda osoba dorosła. W opublikowanych w 2020 r. wytycznych CDC działanie takie jest zalecane w przypadku populacji, w których odsetek zakażeń HCV jest > 0,1% [8]. Podkreśla się również, że badanie takie powinno być wykonywane u każdej kobiety w ciąży, a w przypadku osób z grup wysokiego ryzyka (np. używających narkotyków dożylnie), które mogą częściej podlegać potencjalnej ekspozycji na HCV, powinny być wykonywane cyklicznie, np. co 12 miesięcy [8, 16].
W Polsce kwestię zasadności testowania w kierunku HCV oceniała w ostatnich latach Agencja Oceny Technologii Medycznych i Taryfikacji (AOTMiT). Agencja wydała dwie oceny w tej sprawie – w obu uznano testowanie za zasadne. Pierwsze zalecenie, wydane 13 listopada 2017 r., wskazywało na zasadność testowania w ramach POZ osób z określonych grup, mających w wywiadzie czynniki mogące wskazywać na zwiększone ryzyko zakażenia HCV [18]. Niestety do dziś nie znalazło to odzwierciedlenia ani w ustawie o świadczeniach gwarantowanych, ani w żadnym z programów profilaktyki zdrowotnej realizowanych w placówkach POZ, który umożliwiłby powszechne i szerokie testowanie w kierunku HCV. Druga z rekomendacji AOTMiT, wydana 30 listopada 2020 r., odnosi się do działań przeprowadzanych w ramach programów polityki zdrowotnej dotyczących profilaktyki przewlekłych zakażeń HCV i HBV [19].
W tabeli 3 zestawiono grupy docelowe, w których testowanie w kierunku HCV AOTMiT uznała za zasadne w wydanych rekomendacjach.

Dodatkowo w opinii z 13 listopada 2017 r., poza grupami wymienionymi w zaleceniu Ministra Zdrowia, AOTMiT uznała za zasadne wykonywanie badań przesiewowych również u:
• osób przyjmujących narkotyki donosowo,
• dzieci matek zakażonych HCV,
• pacjentów dializowanych,
• pracowników systemu opieki zdrowotnej, służb mundurowych po ukłuciu igłą lub kontakcie z krwią zakażoną HCV,
• dzieci i młodzieży z placówek wychowawczych,
• osób poddanych zabiegom medycznym w Afryce, Azji, na Karaibach, w Ameryce Środkowej i Południowej, Europie Wschodniej i Południowej, na Bliskim Wschodzie i na wyspach Pacyfiku [18].
Rekomendacja AOTMiT z 30 listopada 2020 r. zaleca także, aby przeprowadzić dodatkowo działania informacyjno-edukacyjne i diagnostyczną wizytę lekarską u wszystkich osób, które będą objęte programami polityki zdrowotnej dotyczącymi profilaktyki przewlekłych zakażeń HCV. Wszystkie wymienione działania powinny być prowadzone przez odpowiednio przeszkolony, wykształcony personel [19].
Zalecana strategia postępowania w ograniczaniu liczby zakażeń HCV
W związku z brakiem szczepień przeciwko wirusowemu zapaleniu wątroby typu C konieczne jest podjęcie działań w celu powstrzymania rozprzestrzeniania się wirusa. Działania te obejmują:
• edukację i promocję zachowań zmniejszających ryzyko transmisji infekcji,
• przeprowadzanie ogólnokrajowego badania populacyjnego,
• zapewnienie szerszego dostępu do badań w kierunku HCV, umożliwiającego wczesne wykrywanie i diagnozowanie jak największej liczby osób zakażonych na poziomie lokalnym.
Takie działania w połączeniu z szeroką dostępnością krótkich, wysoce skutecznych i bezpiecznych terapii przeciwwirusowych znacznie zwiększą szanse realizacji strategii WHO eliminacji zakażeń HCV. Działania profilaktyczne i leczenie na wczesnym etapie zakażenia obniżyłyby również koszty terapii pacjentów z poważnymi powikłaniami zapalenia wątroby typu C, w tym z marskością i rakiem wątrobowokomórkowym, ponoszone przez NFZ [12].
Jak pokazały doświadczenia innych krajów, wprowadzenie aktywnych działań dla osiągnięcia celów WHO przynosi korzyść. W większości z nich podjęto decyzję o równoczesnym upowszechnieniu dostępu do testowania w kierunku HCV i terapii przeciwwirusowych. Niestety część krajów, w tym Polska, nie osiągnie tych celów do 2030 r., ponieważ nie inwestuje i nie angażuje się w pełni w programy umożliwiające eliminację zakażeń pomimo świadomości, że działanie takie jest wysoce opłacalne [20].
Lekarze rodzinni i placówki POZ są ważnym elementem akcji edukacyjnych i profilaktycznych. Często mają wieloletni kontakt ze swoimi pacjentami, są obdarzani zaufaniem i wiarygodni dla członków społeczności. Z łatwością docierają do dużych grup pacjentów, znają ich przeszłość medyczną. Wiedza lekarzy POZ na temat czynników ryzyka – demograficznych, behawioralnych czy zawodowych – oraz klinicznych objawów zapalenia wątroby może skutecznie poprawić identyfikację przypadków zakażeń, szczególnie przy realizacji programów profilaktycznych skierowanych do grup ryzyka, wskazanych w rekomendacji AOTMiT.
Zalecana ścieżka (algorytm) diagnostyki na poziomie POZ
Zalecany algorytm diagnostyczny, który mógłby być rozważany do implementacji w placówkach POZ, przedstawiono na rycinie 1.

W przypadku uruchomienia śladem innych krajów Narodowego Programu Eliminacji HCV celowe byłoby przyjęcie strategii testowania przynajmniej raz w życiu każdej osoby dorosłej. Należałoby też uwzględnić dodatkowe testowanie wszystkich osób, u których wystąpiło realne i uprawdopodobnione ryzyko znalezienia się w sytuacji stwarzającej istotne zagrożenie zakażeniem HCV, a także cykliczne testowanie (np. co 12 miesięcy) osób z tzw. grup podwyższonego ryzyka nabycia zakażenia, np. uzależnionych od środków odurzających, mężczyzn utrzymujących niezabezpieczone kontakty seksualne z mężczyznami (tzw. MSM) czy świadczących usługi seksualne.
Podstawowy algorytm diagnostyczny powinien się opierać na 2 badaniach, czyli anty-HCV (wykonanym w laboratorium lub z użyciem szybkich testów diagnostycznych) i HCV RNA (wykonanym techniką PCR o czułości ≤ 25 IU/ml) [16].
Pierwszym i podstawowym powinno pozostać badanie na obecność przeciwciał anty-HCV, które może być wykonane zarówno z wykorzystaniem standardowej ścieżki laboratoryjnej, jak i z użyciem coraz popularniejszych szybkich testów diagnostycznych (rapid diagnostic tests – RDTs), które umożliwiają szybką (w ciągu 10–15 minut) ocenę statusu serologicznego pacjenta, w czasie jednej wizyty. Obecnie stosowane testy kasetkowe charakteryzują się zarówno bardzo wysoką czułością, jak i swoistością, a dzięki minimalnej ilości potrzebnej krwi oraz możliwości szybkiego odczytania wyniku mogą być powszechnie wykorzystywane w akcjach screeningowych skierowanych do osób sporadycznie odwiedzających placówki medyczne. W przypadku wykrycia obecności przeciwciał anty-HCV w surowicy pacjenta konieczne jest wykonanie badania na obecność materiału genetycznego wirusa, tzn. HCV RNA, w celu potwierdzenia aktywnego zakażenia.
Badanie HCV RNA może być wykonane w poradni specjalistycznej (chorób zakaźnych lub hepatologicznej) na podstawie skierowania wystawionego przez lekarza POZ.
Drugą z możliwych obecnie ścieżek skierowania na bezpłatne badanie HCV RNA jest skorzystanie z puli badań dostępnych w ramach akcji profilaktycznej realizowanej przez laboratoria diagnostyczne (np. ALAB i Diagnostyka).
Grupami szczególnymi, w których zaleca się wykonanie badania HCV RNA od razu na pierwszym etapie diagnostyki, są pacjenci w przeszłości poddani skutecznej terapii zakażenia i obecnie testowani np. ze względu na wystąpienie sytuacji mogącej powodować powtórne zakażenie HCV, a także dzieci urodzone przez matki zakażone HCV, które testuje się w pierwszych miesiącach po urodzeniu, aby ocenić, czy doszło do zakażenia wertykalnego.
Wykrycie materiału genetycznego wirusa (pozytywny wynik badania HCV RNA) w poradni lekarza POZ powinno skutkować jak najszybszym skierowaniem pacjenta do poradni specjalistycznej (chorób zakaźnych lub hepatologicznej) w celu jak najszybszego wykonania diagnostyki uzupełniającej – wymaganej w ramach programu lekowego (B.71), która pozwala na szybkie podjęcie leczenia, zapewnia skuteczne zahamowanie infekcji oraz umożliwia ograniczenie konsekwencji zdrowotnych wynikających z trwającego procesu zapalnego.
Podsumowanie – rekomendacje dla lekarzy POZ
Zakażenie HCV u zdecydowanej większości pacjentów przebiega bezobjawowo przez wiele lat (nawet ponad 20–30 lat), dlatego ważne jest aktywne poszukiwanie zakażenia, by jak najszybciej wykryć osoby zakażone i zahamować proces zapalny. Wczesne zdiagnozowanie zakażenia HCV oraz podjęcie skutecznego leczenia terapią bezinterferonową daje praktycznie u 100% pacjentów możliwość zahamowania procesu chorobowego i ograniczenia długofalowych następstw zakażenia.
Diagnostyka HCV jest realizowana dwuetapowo – w pierwszym etapie należy zbadać obecność przeciwciał anty-HCV, a po ich wykryciu skierować pacjenta na badanie HCV RNA, którego obecność potwierdza aktywne zakażenie.
Celowe jest prowadzenie badań populacyjnych, w ramach których każdy pacjent POZ miałby przynajmniej raz w życiu wykonany test anty-HCV.
Do czasu ewentualnego włączenia badań anty-HCV do koszyka świadczeń gwarantowanych na poziomie POZ warto korzystać z dostępnych akcji profilaktycznych.
Doskonałym narzędziem wstępnej diagnostyki HCV na poziomie POZ są szybkie testy diagnostyczne (RDT), które pod względem czułości i swoistości nie ustępują tradycyjnym metodom laboratoryjnym.
Piśmiennictwo
1. Dore GJ, Hatzakis A, Negro F, Waked I. Estimating HCV disease burden (editorial). J Viral Hepat 2017; 24 (Suppl. 2): 4-7.
2. https://www.who.int/news-room/fact-sheets/detail/hepatitis-c
3. The Polish Group of Experts for HCV. Recommendations of the Polish Group of Experts for HCV for the treatment of hepatitis C in 2020. Clin Exp HEPATOL 2020; 6:
163-169.
4. WHO. Global hepatitis report, 2017. World Health Organization, Geneva, Switzerland. http://apps.who.int/iris/bitstream/10665/255016/1/9789241565455-eng.pdf
5. WHO. Global health sector strategy on viral hepatitis 2016–2021. World Health Organization, Geneva, Switzerland. http://apps.who.int/iris/bitstream/10665/246177/1/WHO-HIV-2016.06-eng.pdf
6. Flisiak R. Perspektywy eliminacji wirusa zapalenia wątroby typu C w Polsce. Hepatologia 2019; 19: 47-51.
7. Razavi H, Sanchez Gonzalez Y, Yuen C, Cornberg M. Global timing of hepatitis C virus elimination in high-income countries. Liver Int 2020; 40: 522-529.
8. Havens PL, Anderson JR. Updated CDC recommendations for universal hepatitis c virus screening among adults and pregnant women: implications for clinical practice. JAMA 2020; 323: 2258-2259.
9. Cooke GS. Accelerating the elimination of viral hepatitis: a Lancet Gastroenterology & Hepatology Commission. Lancet Gastroenterol Hepatol 2019; 4: 135-184.
10. Zakrzewska K, Stępień M, Rosińska M. Wirusowe zapalenie wątroby typu C (WZW C) w Polsce w 2018 roku, Przegl Epidemiol 2020; 74: 209-222.
11. The Polaris Observatory, Country Dashboard [Poland], https://cdafound.org/polaris-countries-dashboard/ (dostęp: 05.09.2021).
12. Kobierski J, Hałdaś M, Władysiuk M. Hepatitis C – the implications and the need for change in the health care system in Poland. JHPOR 2014; 2: 6-34.
13. Gill K, Ghazinian H, Manch R, Gish R. Hepatitis C virus as a systemic disease: reaching beyond the liver. Hepatol Int 2016; 10: 415-423.
14. Cacoub P, Saadoun D. Extrahepatic manifestations of chronic HCV infection. N Engl J Med 2021; 384: 1038-1052.
15. Flisiak R, Małkowski P (red.). Recepta na HCV: przewodnik lekarza. PZWL Wydawnictwo Lekarskie, Warszawa 2019.
16. AASLD/IDSA HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. Published 2021 Jan 21. https://www.hcvguidelines.org/sites/default/files/full-guidance-pdf/AASLD-IDSA_HCVGuidance_January_21_2021.pdf
17. Madaliński K, Flisiak R, Halota W i wsp. Diagnostyka laboratoryjna zakażeń wirusem zapalenia wątroby typu C. Rekomendacje Polskiej Grupy Roboczej 2012/2013. J Lab Diag 2013; 49; 65-70.
18. Rekomendacja BP.434.26.2017.TN z 13 listopada 2017, AOTMiT. https://bipold.aotm.gov.pl/assets/files/zlecenia_mz/2017/120/REK/BP.434.26.2017_HCV.pdf
19. Rekomendacja nr 3/2020 z dnia 30 listopada 2020 Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie zalecanych technologii medycznych, działań przeprowadzanych w ramach programów polityki zdrowotnej oraz warunków realizacji tych programów, dotyczących profilaktyki przewlekłych zakażeń HCV i HBV. https://bipold.aotm.gov.pl/assets/files/ppz/2020/REK/3_2020.pdf
20. Pedrana A, Munari S, Stoové M i wsp. The phases of hepatitis C elimination: achieving WHO elimination targets. Lancet Gastroenterol Hepatol 2021; 6: 6-8.
Pełna treść artykułu:Agnieszka Mastalerz-Migas, Robert Flisiak, Jarosław Drobnik, Krzysztof Tomasiewicz, Małgorzata Pawłowska. Stanowisko Polskiego Towarzystwa Epidemiologów i Lekarzy Chorób Zakaźnych, Polskiego Towarzystwa Hepatologicznego i Polskiego Towarzystwa Medycyny Rodzinnej w zakresie diagnostyki zakażeń HCV w ramach podstawowej opieki zdrowotnej. Lekarz POZ 2021; 7(4): 243-249.
Źródło:
Lekarz POZ 2021; 7(4): 243-249.
Lekarz POZ 2021; 7(4): 243-249.
Działy:
Aktualności w Lekarz specjalista
Artykuły z prasy medycznej
Zalecenia i rekomendacje
Wytyczne, zalecenia i rekomendacje
Aktualności
