Żywienie pacjentów po operacji głowy trzustki z powodu nowotworu

Wsparcie żywieniowe po pankreatoduodenektomii zmniejsza ryzyko powikłań pooperacyjnych i poprawia rokowanie chorych. Po zabiegu rekomenduje się wczesne żywienie doustne, a żywienie pozajelitowe tylko w przypadku niedożywienia lub niemożności przyjmowania pokarmu dojelitowo przez 7–10 dni po operacji. Zalecenia dietetyczne powinny być zindywidualizowane i uwzględniać zmiany w stanie chorego.
Autorki: Natalia Ksepka, Aneta Jachnis
Wstęp
Rak trzustki znajduje się na czwartym miejscu wśród najczęstszych przyczyn śmierci wywołanych chorobą nowotworową. Stanowi 6% wszystkich zgonów pacjentów onkologicznych [1]. W 2018 roku zdiagnozowano 458 918 nowych przypadków zachorowań na raka trzustki, co daje mu 12 miejsce na liście najczęściej występujących nowotworów złośliwych na świecie. Nieco wyższa zachorowalność jest widoczna u mężczyzn niż u kobiet [2]. W Polsce rak trzustki stanowi ok. 3% wszystkich nowotworów złośliwych. W większości przypadków (95%), stwierdzany jest gruczolakorak (nowotwór egzokrynny), wywodzący się z nabłonka przewodów trzustkowych [3].
Chirurgiczne wycięcie guza wciąż pozostaje jedyną formą wyleczenia pacjenta, średnia przeżywalność chorych po pankreatoduodenektomii wynosi ok. 95% w ciągu 90 dni [4]. Pacjenci z guzem uznanym za operacyjny, po usunięciu wymagają zastosowania chemioterapii adjuwantowej. W przypadku typów guzów granicznie resekcyjnych i miejscowo zaawansowanych stosuje się przedoperacyjną terapię neoadjuwantową, a w przypadku zmniejszenia guza leczenie chirurgiczne [5]. Neoadjuwant oznacza terapię przedoperacyjną w raku resekcyjnym oraz terapię umożliwiającą wtórną resekcyjność w przypadku nowotworu miejscowo zaawansowanego [6].
W ciągu ostatnich lat terapia neoadjuwantowa (np. (na przykład) przed leczeniem operacyjnym) stała się popularną formą wspierającą leczenie raka trzustki. W badaniach wykazano, że może ona być lepiej tolerowana przez chorych niż terapia adjuwantowa (np. po operacji) oraz może zmniejszyć ilość powikłań pooperacyjnych. Zaletą leczenia neoadjuwantowego jest zwalczanie komórek nowotworowych oraz mikroprzerzutów przed operacją [6]. W przypadku występowania przerzutów stosowane jest leczenie paliatywne [5]. W każdym z tych przypadków rola prawidłowego żywienia jest znacząca, a zalecenia winny być dostosowane indywidualnie do pacjenta oraz zmieniać się wraz z progresją choroby i towarzyszącymi dolegliwościami.
Występowanie komórek nowotworowych w trzustce, stosowane leczenie oraz błędy w żywieniu pacjenta mogą powodować wiele dolegliwości i wpływać na zaburzenia stanu odżywienia oraz obniżenie jakości życia chorego [7]. Po resekcji tego narządu pacjenci narażeni są na powstanie wielu chorób współistniejących, w których wymagane jest specjalne wsparcie żywieniowe [5,8]. Jako niezależny czynnik ryzyka negatywnych skutków pooperacyjnych uważa się niedożywienie [9]. Dokładna ocena stanu odżywienia przed operacją jest koniecznością [10]. Szybko wprowadzona interwencja żywieniowa może zminimalizować niepożądane efekty leczenia chirurgicznego oraz skrócić hospitalizację [9]. Istotna jest również współpraca chirurga, onkologa oraz dietetyka w celu zoptymalizowania terapii onkologicznej. W wyniku takiego działania możliwe jest zmniejszenie ilości powikłań pooperacyjnych, co związane jest z poprawą rokowania chorych [7].
Celem niniejszego przeglądu było zebranie aktualnych informacji na temat żywienia po pankreatoduodenektomii z powodu choroby nowotworowej trzustki.
Podstawy anatomii i fizjologii trzustki
Trzustka to gruczoł położony zewnątrzotrzewnowo. W jej budowie anatomicznej wyróżnia się głowę, trzon i ogon. Trzustkę można również podzielić ze względu na pełnioną funkcję na część zewnątrzwydzielniczą oraz wewnątrzwydzielniczą. Część zewnątrzwydzielnicza odpowiada za produkcję soku trzustkowego w ilości 1-4 l na dobę. W skład soku trzustkowego wchodzą enzymy trzustkowe, odpowiedzialne za trawienie białek, tłuszczów i węglowodanów. Część wewnątrzwydzielnicza odpowiada za produkcję insuliny, glukagonu, polipeptydu trzustkowego oraz somatostatyny [11,12]. Znajomość anatomii i fizjologii trzustki, a także uwzględnienie lokalizacji guza nowotworowego są podstawowymi elementami umożliwiającymi stworzenie indywidualnego planu żywieniowego. Występowanie zmian nowotworowych w komórkach trzustki powoduje zaburzenia funkcji zewnątrzwydzielniczej oraz może skutkować biegunkami tłuszczowymi, dolegliwościami gastrycznymi, bólem po spożyciu pokarmu i niedoborami pokarmowymi. W przypadku guzów występujących w głowie trzustki częstym objawem może być żółtaczka mechaniczna wywołana uciskiem rozrastających się komórek rakowych na przewody żółciowe. Dysfunkcja wewnątrzwydzielnicza powoduje trudności w utrzymaniu prawidłowej glikemii i częste epizody hiperglikemii wśród chorych [3,13].
Czynniki ryzyka raka trzustki
Do czynników mających wpływ na wystąpienie raka trzustki należą: wiek, płeć, uwarunkowanie genetyczne, nadwaga lub otyłość, długotrwała cukrzyca, przewlekłe zapalenie trzustki, mukowiscydoza, nadużywanie alkoholu, palenie tytoniu, dieta bogata w czerwone i przetworzone mięso oraz nasycone kwasy tłuszczowe [5,14,15,16].
Objawy
Rak trzustki jest trudny do zdiagnozowania we wczesnym stadium ze względu na lokalizację oraz późne i niecharakterystyczne objawy. Zbyt późne zgłaszanie się przez pacjentów do lekarza lub też błędna pierwotna diagnoza są przyczyną, dla której znaczna część guzów trzustki jest wykrywana w zaawansowanym stadium. Jednymi z pierwszych objawów są: żółtaczka mechaniczna, ból brzucha, ból pleców, utrata apetytu, wczesna sytość, niezamierzona utrata masy ciała, powiększenie wątroby, wyczuwalny powiększony, niebolesny pęcherzyk żółciowy, biegunka tłuszczowa, wzdęcia, hipoglikemia (insulinoma), hiperglikemia [3,16].
Leczenie chirurgiczne
Leczenie chirurgiczne jest podstawowym sposobem w walce z nowotworami złośliwymi trzustki. Najczęściej wykonywanymi zabiegami w leczeniu chirurgicznym raka trzustki są: pankreatoduodenektomia, pankreatektomia dystalna, pankreatektomia całkowita. W przypadku guza zlokalizowanego w głowie trzustki leczeniem jest pankreatoduodenektomia, wykonywana sposobem Whipple’a. Charakteryzuje się ona resekcją: głowy trzustki, dwunastnicy, przewodu żółciowego wspólnego z pęcherzykiem żółciowym oraz dystalnej części żołądka [3,8]. Drugą wykonywaną formą leczenia raka głowy trzustki jest pankreatoduodenektomia z zaoszczędzeniem części odźwiernika (TraversoLongmire). Międzynarodowa Grupa Badawcza Chirurgii Trzustki (ISGPS) w swoim stanowisku z 2018 roku przytoczyła wyniki przeglądu Dienera i wsp., w którym wykazano lepsze wyniki pooperacyjne w przypadku metody Traverso-Longmire. Dotyczyły one poprawy przyrostu masy ciała oraz jakości życia pacjentów [17].
Dolegliwości i powikłania po pankreatoduodenektomii
Pankreatoduodenektomia relatywnie rzadko prowadzi do poważnych zaburzeń i trudności w żywieniu. Trzustka zachowuje zdolność do pełnionych funkcji nawet przy zostawionych 3 cm zdrowego miąższu [18]. Niepożądane konsekwencje wynikające w operacji, które mogą wystąpić do 30 dnia po zabiegu opisywane są jako „wczesne powikłania chirurgiczne” i obejmują [18]:
• gastroplegię, czyli opóźnione opróżnianie żołądka;
• przetokę trzustkową – jest przyczyną m.in.: utraty płynów i elektrolitów oraz zaburzenia wchłaniania z powodu niedoboru enzymów trzustkowych;
• przetokę żółciową – jest przyczyną utraty elektrolitów oraz cynku i miedzi;
• ostre zapalenie kikuta trzustki – jest przyczyną zaburzenia trawienia i wchłaniania, cukrzycy oraz kwasicy;
• zapalenie otrzewnej – może być przyczyną hiperkatabolizmu;
• obrzęk limfatyczny – może być przyczyną odwodnienia, zaburzeń elektrolitowych oraz utraty białka.
Cukrzyca
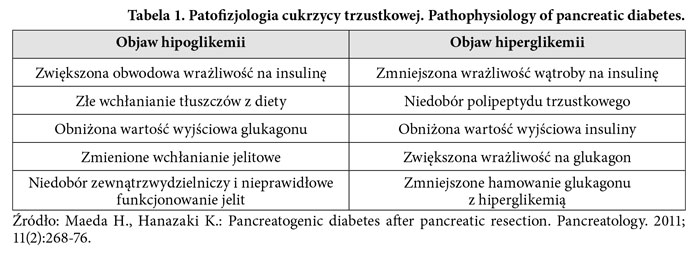
Po pankreatoduodenektomii mogą pojawić się zaburzenia glikemii. Według badanych 8-23% pacjentów po operacji rozwija cukrzycę typu 3 [8]. W porównaniu do cukrzycy typu 1, cukrzyca trzustkowa rzadko wywołuje stan kwasicy ketonowej czy ciężką hiperglikemię. W przeciwieństwie do cukrzycy typu 2 uznaje się, że w cukrzycy trzustkowej tkanki nadal są wrażliwe na insulinę [19].
Opóźnione opróżnianie żołądka
Według danych opóźnione opróżnianie żołądka może wystąpić u 15-57% pacjentów poddanych pankreatoduodenektomii. Gastroplegia przyczynia się do utrudnionego żywienia doustnego i w konsekwencji jest czynnikiem predysponującym do dłuższej hospitalizacji chorych [10,20,21]. W badaniach Tanaka i wsp. wykazano, że założenie nosowo-jelitowej lub przezskórnej sondy jako uzupełnienie doustnego przyjmowania pokarmu może poprawić pooperacyjne parametry chorego, takie jak zmniejszenie ilości powikłań infekcyjnych, a w rezultacie skrócenie pobytu w szpitalu [20].
Zewnątrzwydzielnicza niewydolność trzustki
Według badań u 68-93% chorych na raka trzustki występuje niewydolność zewnątrzwydzielnicza tego gruczołu. Zazwyczaj utrzymuje się ona również po operacji [21].
Enzymy trzustkowe są niezbędnym elementem składowym trawienia pokarmu. Konsekwencjami niewydolności trzustki jest biegunka tłuszczowa, spadek masy ciała oraz obniżona jakość życia. Może doprowadzić również do niedoboru witamin rozpuszczalnych w tłuszczach, czyli witaminy A, D, E oraz K [10].
Podstawową metodą leczenia tego powikłania jest terapia enzymami trzustkowymi [8,22]. Dawki enzymów zazwyczaj wynoszą 20 000 – 75 000 jednostek lipazy na posiłek lub 5 000 – 50 000 jednostek lipazy na przekąskę. Dawka nie powinna przekraczać 10 000 jednostek lipazy na kilogram masy ciała na dzień [8].
Według badań Decher i Berry u pacjentów mających problemy z trawieniem tłuszczu, odpowiednia terapia enzymatyczna może zmniejszyć dyskomfort w jamie brzusznej [22]. Petzel i Hoffman wskazują, że nie jest konieczne zmniejszenie ilości tłuszczu w diecie, jeśli dawka enzymów będzie prawidłowo dobrana [8]. Ponadto tłuszcz ma dużą wartość energetyczną, dlatego dieta niskotłuszczowa może doprowadzić do dodatkowego spadku masy ciała u chorych [22]. Jedynie u pacjentów z ciężką biegunką tłuszczową ograniczenie tłuszczu w diecie mogłoby być korzystne [8].
Wsparcie żywieniowe
Jakość życia pacjenta z rakiem trzustki zmniejsza się przez znaczne zaburzenia odżywiania, dlatego tak ważne jest wsparcie żywieniowe chorych [7]. Prawidłowy stan odżywienia pacjenta umożliwia odpowiednią reakcję organizmu na stosowaną terapię onkologiczną, zmniejsza ilość i nasilenie powikłań, poprawia jakość życia oraz polepsza ogólne rokowania chorych [23]. Główne cele interwencji żywieniowej u pacjentów onkologicznych obejmują [1]:
• poprawę stanu odżywienia, a także osiągnięcie i utrzymanie prawidłowej masy ciała,
• dostarczanie odpowiedniej ilości energii, białka, tłuszczu, witamin i składników mineralnych,
• uzupełnienie niedoborów składników pokarmowych wynikających z umiejscowienia nowotworu, ale także będących skutkiem leczenia onkologicznego,
• zmniejszenie katabolizmu oraz uzyskanie dodatniego bilansu azotowego,
• stabilizację równowagi wodno-elektrolitowej.
Energia i składniki odżywcze powinny być dostarczane w ilości, którą określa się indywidualnie dla każdego pacjenta onkologicznego na podstawie wieku, płci, aktywności fizycznej, stanu odżywienia, rodzaju, lokalizacji i zaawansowania nowotworu, rodzaju terapii przeciwnowotworowej oraz chorób współistniejących.
W nowotworach przewodu pokarmowego dieta powinna obejmować założenia diety łatwostrawnej. W zależności od rodzaju narządu zajętego złośliwą zmianą nowotworową, stopnia jej zaawansowania, bądź rodzaju leczenia wprowadza się indywidualne modyfikacje diety łatwostrawnej [1].
Shen i Jin [24] na podstawie przeprowadzonej metaanalizy sugerują, że wczesne żywienie dojelitowe jest bezpieczne dla pacjentów po pankreatoduodenektomii. Podobne wnioski wyciągnęli Buscemi i in. [25] w przeglądzie z 2015 roku. Ponadto może ono poprawić funkcję odpornościową, zmniejszyć liczbę infekcji oraz utrzymać integralność jelit [10].
Wytyczne Towarzystwa Enhanced Recovery After Surgery (ERAS), Europejskiego Towarzystwa Żywienia Klinicznego i Metabolizmu (ESPEN) oraz Międzynarodowego Stowarzyszenia na rzecz Metabolizmu i Żywienia Chirurgicznego (IASMEN) [26]:
• Przed operacją pacjenci powinni uzyskać wszystkie niezbędne informacje na temat zabiegu oraz wytyczne postępowania. Może to wpłynąć na poprawę żywienia okołooperacyjnego oraz wyników po operacji.
• Osoby palące oraz spożywające często alkohol powinny zaprzestać wymienionych czynności miesiąc przed operacją.
• Zastosowanie okołooperacyjnego immunożywienia przez okres 5-7 dni może zmniejszyć ilość powikłań infekcyjnych.
• Mechaniczne przygotowanie jelit przed pankreatoduodenektomią nie przynosi żadnych korzyści.
• Pokarmy stałe można przyjmować do 6 godzin przed zabiegiem natomiast klarowne płyny do 2 godzin. Ponadto pacjenci bez cukrzycy powinni przyjmować przed operacją napój węglowodanowy na bazie maltodekstryn, ponieważ zmniejsza on pooperacyjną insulinooporność tkanek.
• Należy bardzo dokładnie kontrolować glikemię u pacjenta po zabiegu.
• Zakładanie pacjentowi zgłębnika nosowo-żołądkowego przed operacją uważa się za nieuzasadnione, ponieważ nie wpływa na wynik leczenia.
• Podtrzymywanie bilansu płynów w granicy zera oraz zmniejszenie ilości przyjmowanej wody i soli wpływa na poprawę wyników leczenia, takich jak zmniejszenie ryzyka powikłań czy przyspieszenie powrotu przewodu pokarmowego do działania.
• Nie ma uzasadnienia stosowania somatostatyny i jej analogów po pankreatoduodenektomii.
• U pacjentów z długo utrzymującą się gastroplegią należy rozważyć sztuczne odżywianie.
• Przypuszcza się, że pooperacyjne podawanie pacjentowi gumy do żucia i doustnych środków przeczyszczających może wpłynąć na poprawę pasażu żołądkowo-jelitowego.
• Większość pacjentów wkrótce po przebytej pankreatoduodenektomii toleruje doustne przyjmowanie pokarmu. W przypadku diety doustnej pacjenci powinni ostrożnie i stopniowo zwiększać tolerowane spożycie pokarmu w ciągu 3-4 dni od operacji.
• Żywienie dojelitowe przez zgłębnik należy wdrożyć tylko przy określonych wskazaniach.
• Gdy pacjent nie może spożywać pokarmu doustnie ani nie toleruje żywienia dojelitowego, wówczas tylko w takim wypadku rekomendowane jest żywienie pozajelitowe.
Po pankreatoduodenektomii należy:
• Spożywać często małe posiłki (ok. 5-6) w regularnych odstępach czasu o określonych porach dnia [22].
• Przyjmować enzymy trzustkowe podczas posiłku, ponieważ wykazują wtedy lepsze wchłanianie niż, gdy są przyjmowane przed posiłkiem [21].
• Podczas żywienia przez sondę, enzymy należy przyjmować co kilka godzin [22].
• Ograniczyć ilość błonnika pokarmowego, ponieważ może on zmniejszać aktywność enzymów trzustkowych [21].
• Regularnie monitorować poziom żelaza, witaminy B12 oraz witamin rozpuszczalnych w tłuszczach, a w razie niedoborów należy je suplementować [10].
• Rozważyć suplementację średniołańcuchowych kwasów tłuszczowych - w przypadku trudności w trawieniu tłuszczów nie wymagają one reakcji enzymatycznych, ani soli kwasów żółciowych [8].
Zgodnie z zasadami diety łatwostrawnej należy [27,28]:
• Wykluczyć z diety produkty zawierające duże ilości błonnika pokarmowego, wywołujące wzdęcia, smażone, wędzone, ostre, tłuste, długo zalegające w żołądku, używki;
• Wykluczyć techniki kulinarne tj.: smażenie, duszenie i pieczenie w sposób tradycyjny, odgrzewanie, odsmażanie oraz przyrządzanie zasmażek;
• Stosować gotowanie w wodzie i na parze, pieczenie w folii, rękawie lub pergaminie;
• Dodawać tłuszcz na koniec - po przyrządzeniu potraw (wybierać oleje bogate w wielonienasycone kwasy tłuszczowe oraz w witaminę E);
• Dla lepszej tolerancji lub zmniejszenia ilości błonnika w diecie - rozdrabniać owoce i warzywa oraz usuwać z nich skórki i pestki, a także wybierać produkty zbożowe oczyszczone;
• Stosować spulchnianie potraw (dodając np. ubitą pianę z białka jaja lub namoczoną bułkę pszenną).
Wnioski
Odżywianie stanowi integralną część w leczeniu chirurgicznym nowotworów złośliwych trzustki [9]. Choroba, dolegliwości, leczenie i toczący się proces zapalny powodują, że u znacznej liczby pacjentów dochodzi do utraty masy ciała, licznych niedoborów pokarmowych i niedożywienia [5]. Z tego powodu przed operacją należy przeprowadzić dokładną ocenę odżywienia pacjenta, wprowadzić odpowiednie wsparcie żywieniowe z uwzględnieniem zarówno anatomii i fizjologii trzustki, stosowanej aktualnie terapii oraz oszacowania zapotrzebowania odżywczego i energetycznego chorego, pamiętając o dynamice zmian w związku z progresją choroby. Interwencja żywieniowa wprowadzona na początku leczenia poprawia wyniki i skraca pobyt chorych w szpitalu [9].
Żywienie dojelitowe przez sondę wkrótce po przebytej operacji nie jest rutynowo zalecane, ponieważ po pankreatoduodenektomii preferowane jest wczesne żywienie doustne [9].
Według ASPEN i ESPEN żywienie pozajelitowe jest odpowiednie po zabiegu u pacjentów niedożywionych. Ponadto powinno być zalecane w przypadku, gdy chorzy nie mogą być odżywiani dojelitowo w czasie 7-10 dni od operacji. Ten sposób żywienia nie powinien być jednak stosowany rutynowo po pankreatoduodenektomii ze względu na zwiększone ryzyko wystąpienia infekcji, co w konsekwencji może wpłynąć na wydłużenie hospitalizacji [9].
Piśmiennictwo
1. Lange E, Wilczak J. Zalecenia dotyczące żywienia w trakcie leczenia choroby nowotworowej. [w:] Szawłowski Andrzej Wiktor, Gromadzka-Ostrowska Joanna, Paluszkiewicz Piotr, Słodkowski Maciej, Sobocki Jacek (red.) Żywienie w chorobach nowotworowych. Warszawa: Wyd. Lekarskie PZWL; 2020.
2. World Cancer Research Fund International. Worldwide cancer data. Dostępny w Internecie: https://www.wcrf.org/dietandcancer/worldwide-cancer-data/ Dostęp 13.07.2021.
3. Piotrowski P. Nowotwory przewodu pokarmowego. [w:] Kułakowski Andrzej, SkowrońskaGardas Anna (red.) Onkologia. Warszawa: Wyd. Lekarskie PZWL; 2014.
4. Mihaljevic AL, Hackert T, Loos M, et al. Not all Whipple procedures are equal: Proposal for a classification of pancreatoduodenectomies. Surgery. 2021; 169(6): 1456-1462.
5. Loveday BPT, Lipton L, Thomson BN. Pancreatic cancer: An update on diagnosis and management. Aust J Gen Pract. 2019; 48(12): 826-831.
6. Heinrich S, Lang H. Neoadjuvant Therapy of Pancreatic Cancer: Definitions and Benefits. Int J Mol Sci. 2017; 18(8): 1622.
7. Gilliland TM, Villafane-Ferriol N, Shah KP, et al. Nutritional and Metabolic Derangements in Pancreatic Cancer and Pancreatic Resection. Nutrients. 2017; 9(3): 243.
8. Petzel MQB, Hoffman L. Nutrition Implications for Long-Term Survivors of Pancreatic Cancer Surgery. Nutr Clin Pract. 2017; 32(5): 588-598.
9. Afaneh C, Gerszberg D, Slattery E, Seres DS, Chabot JA, Kluger MD. Pancreatic cancer surgery and nutrition management: a review of the current literature. Hepatobiliary Surg Nutr. 2015; 4(1): 59-71.
10. Pappas S, Krzywda E, McDowell N. Nutrition and pancreaticoduodenectomy. Nutr Clin Pract. 2010; 25(3): 234-243.
11. Jurkowska G. Fizjologia przewodu pokarmowego. [w:] Górski Jan (red.) Fizjologia człowieka. Warszawa: Wyd. Lekarskie PZWL; 2016.
12. Konturek S. (red.) Fizjologia człowieka. Układ trawienny i wydzielanie wewnętrzne. Kraków: Wyd. Uniwersytetu Jagiellońskiego; 2000.
13. Tumas J, Tumiene B, Jurkeviciene J, Jasiunas E, Sileikis A. Nutritional and immune impairments and their effects on outcomes in early pancreatic cancer patients undergoing pancreatoduodenectomy. Clin Nutr. 2020; 39(11): 3385-3394.
14. Wojciechowska U, Didkowska J. Zachorowania i zgony na nowotwory złośliwe w Polsce. Krajowy Rejestr Nowotworów, Narodowy Instytut Onkologii im. Marii Skłodowskiej-Curie – Państwowy Instytut Badawczy. Dostępny w Internecie: http://onkologia.org.pl/raporty/ Dostęp 13.07.2021.
15. World Cancer Research Fund International. Pancreatic cancer. Dostępny w Internecie: https:// www.wcrf.org/dietandcancer/pancreatic-cancer/ Dostęp 13.07.2021.
16. Moore A, Donahue T. Pancreatic Cancer. JAMA. 2019; 322(14): 1426.
17. Gianotti L, Besselink MG, Sandini M, et al. Nutritional support and therapy in pancreatic surgery: A position paper of the International Study Group on Pancreatic Surgery (ISGPS). Surgery. 2018; 164(5): 1035-1048.
18. Szawłowski AW. Konsekwencje żywieniowe leczenia onkologicznego. [w:] Szawłowski Andrzej Wiktor, Gromadzka-Ostrowska Joanna, Paluszkiewicz Piotr, Słodkowski Maciej, Sobocki Jacek (red.) Żywienie w chorobach nowotworowych. Warszawa: Wyd. Lekarskie PZWL; 2020.
19. Maeda H, Hanazaki K. Pancreatogenic diabetes after pancreatic resection. Pancreatology. 2011; 11(2): 268-276.
20. Tanaka M, Heckler M, Mihaljevic AL, et al. Meta-analysis of effect of routine enteral nutrition on postoperative outcomes after pancreatoduodenectomy. Br J Surg. 2019; 106(9): 1138-1146.
21. Berry AJ. Pancreatic surgery: indications, complications, and implications for nutrition intervention. Nutr Clin Pract. 2013; 28(3): 330-357.
22. Decher N, Berry A. Post-Whipple: A practical approach to nutrition management. Pract Gastroenterol. 2012; 36(8): 30-42.
23. Jachnis A, Ławiński M, Słodkowski M. Wydatki energetyczne i zapotrzebowanie na składniki pokarmowe u chorych na nowotwory. [w:] Szawłowski Andrzej Wiktor, Gromadzka-Ostrowska Joanna, Paluszkiewicz Piotr, Słodkowski Maciej, Sobocki Jacek (red.) Żywienie w chorobach nowotworowych. Warszawa: Wyd. Lekarskie PZWL; 2020.
24. Shen Y, Jin W. Early enteral nutrition after pancreatoduodenectomy: a meta-analysis of randomized controlled trials. Langenbecks Arch Surg. 2013; 398(6): 817-823.
25. Buscemi S, Damiano G, Palumbo VD, et al. Enteral nutrition in pancreaticoduodenectomy: a literature review. Nutrients. 2015; 7(5): 3154-3165.
26. Lassen K, Coolsen MM, Slim K, et al. Guidelines for perioperative care for pancreaticoduodenectomy: Enhanced Recovery After Surgery (ERAS®) Society recommendations. Clin Nutr. 2012; 31(6): 817-830.
27. Włodarek D, Lange E. Klasyfikacja diet. [w:] Włodarek Dariusz, Lange Ewa, Kozłowska Lucyna, Głąbska Dominika (red.) Dietoterapia. Warszawa: Wyd. Lekarskie PZWL; 2014.
28. Ciborowska H. Klasyfikacja i charakterystyka diet. [w:] Ciborowska Helena, Rudnicka Anna (red.) Żywienie zdrowego i chorego człowieka. Warszawa: Wyd. Lekarskie PZWL; 2014.
Pełna treść artykułu: Natalia Ksepka, Aneta Jachnis. Żywienie pacjentów po operacji głowy trzustki z powodu choroby nowotworowej. Pielęgniarstwo w Opiece Długoterminowej / Long-Term Care Nursing 2021; 6 (4): 71-80.
Wstęp
Rak trzustki znajduje się na czwartym miejscu wśród najczęstszych przyczyn śmierci wywołanych chorobą nowotworową. Stanowi 6% wszystkich zgonów pacjentów onkologicznych [1]. W 2018 roku zdiagnozowano 458 918 nowych przypadków zachorowań na raka trzustki, co daje mu 12 miejsce na liście najczęściej występujących nowotworów złośliwych na świecie. Nieco wyższa zachorowalność jest widoczna u mężczyzn niż u kobiet [2]. W Polsce rak trzustki stanowi ok. 3% wszystkich nowotworów złośliwych. W większości przypadków (95%), stwierdzany jest gruczolakorak (nowotwór egzokrynny), wywodzący się z nabłonka przewodów trzustkowych [3].
Chirurgiczne wycięcie guza wciąż pozostaje jedyną formą wyleczenia pacjenta, średnia przeżywalność chorych po pankreatoduodenektomii wynosi ok. 95% w ciągu 90 dni [4]. Pacjenci z guzem uznanym za operacyjny, po usunięciu wymagają zastosowania chemioterapii adjuwantowej. W przypadku typów guzów granicznie resekcyjnych i miejscowo zaawansowanych stosuje się przedoperacyjną terapię neoadjuwantową, a w przypadku zmniejszenia guza leczenie chirurgiczne [5]. Neoadjuwant oznacza terapię przedoperacyjną w raku resekcyjnym oraz terapię umożliwiającą wtórną resekcyjność w przypadku nowotworu miejscowo zaawansowanego [6].
W ciągu ostatnich lat terapia neoadjuwantowa (np. (na przykład) przed leczeniem operacyjnym) stała się popularną formą wspierającą leczenie raka trzustki. W badaniach wykazano, że może ona być lepiej tolerowana przez chorych niż terapia adjuwantowa (np. po operacji) oraz może zmniejszyć ilość powikłań pooperacyjnych. Zaletą leczenia neoadjuwantowego jest zwalczanie komórek nowotworowych oraz mikroprzerzutów przed operacją [6]. W przypadku występowania przerzutów stosowane jest leczenie paliatywne [5]. W każdym z tych przypadków rola prawidłowego żywienia jest znacząca, a zalecenia winny być dostosowane indywidualnie do pacjenta oraz zmieniać się wraz z progresją choroby i towarzyszącymi dolegliwościami.
Występowanie komórek nowotworowych w trzustce, stosowane leczenie oraz błędy w żywieniu pacjenta mogą powodować wiele dolegliwości i wpływać na zaburzenia stanu odżywienia oraz obniżenie jakości życia chorego [7]. Po resekcji tego narządu pacjenci narażeni są na powstanie wielu chorób współistniejących, w których wymagane jest specjalne wsparcie żywieniowe [5,8]. Jako niezależny czynnik ryzyka negatywnych skutków pooperacyjnych uważa się niedożywienie [9]. Dokładna ocena stanu odżywienia przed operacją jest koniecznością [10]. Szybko wprowadzona interwencja żywieniowa może zminimalizować niepożądane efekty leczenia chirurgicznego oraz skrócić hospitalizację [9]. Istotna jest również współpraca chirurga, onkologa oraz dietetyka w celu zoptymalizowania terapii onkologicznej. W wyniku takiego działania możliwe jest zmniejszenie ilości powikłań pooperacyjnych, co związane jest z poprawą rokowania chorych [7].
Celem niniejszego przeglądu było zebranie aktualnych informacji na temat żywienia po pankreatoduodenektomii z powodu choroby nowotworowej trzustki.
Podstawy anatomii i fizjologii trzustki
Trzustka to gruczoł położony zewnątrzotrzewnowo. W jej budowie anatomicznej wyróżnia się głowę, trzon i ogon. Trzustkę można również podzielić ze względu na pełnioną funkcję na część zewnątrzwydzielniczą oraz wewnątrzwydzielniczą. Część zewnątrzwydzielnicza odpowiada za produkcję soku trzustkowego w ilości 1-4 l na dobę. W skład soku trzustkowego wchodzą enzymy trzustkowe, odpowiedzialne za trawienie białek, tłuszczów i węglowodanów. Część wewnątrzwydzielnicza odpowiada za produkcję insuliny, glukagonu, polipeptydu trzustkowego oraz somatostatyny [11,12]. Znajomość anatomii i fizjologii trzustki, a także uwzględnienie lokalizacji guza nowotworowego są podstawowymi elementami umożliwiającymi stworzenie indywidualnego planu żywieniowego. Występowanie zmian nowotworowych w komórkach trzustki powoduje zaburzenia funkcji zewnątrzwydzielniczej oraz może skutkować biegunkami tłuszczowymi, dolegliwościami gastrycznymi, bólem po spożyciu pokarmu i niedoborami pokarmowymi. W przypadku guzów występujących w głowie trzustki częstym objawem może być żółtaczka mechaniczna wywołana uciskiem rozrastających się komórek rakowych na przewody żółciowe. Dysfunkcja wewnątrzwydzielnicza powoduje trudności w utrzymaniu prawidłowej glikemii i częste epizody hiperglikemii wśród chorych [3,13].
Czynniki ryzyka raka trzustki
Do czynników mających wpływ na wystąpienie raka trzustki należą: wiek, płeć, uwarunkowanie genetyczne, nadwaga lub otyłość, długotrwała cukrzyca, przewlekłe zapalenie trzustki, mukowiscydoza, nadużywanie alkoholu, palenie tytoniu, dieta bogata w czerwone i przetworzone mięso oraz nasycone kwasy tłuszczowe [5,14,15,16].
Objawy
Rak trzustki jest trudny do zdiagnozowania we wczesnym stadium ze względu na lokalizację oraz późne i niecharakterystyczne objawy. Zbyt późne zgłaszanie się przez pacjentów do lekarza lub też błędna pierwotna diagnoza są przyczyną, dla której znaczna część guzów trzustki jest wykrywana w zaawansowanym stadium. Jednymi z pierwszych objawów są: żółtaczka mechaniczna, ból brzucha, ból pleców, utrata apetytu, wczesna sytość, niezamierzona utrata masy ciała, powiększenie wątroby, wyczuwalny powiększony, niebolesny pęcherzyk żółciowy, biegunka tłuszczowa, wzdęcia, hipoglikemia (insulinoma), hiperglikemia [3,16].
Leczenie chirurgiczne
Leczenie chirurgiczne jest podstawowym sposobem w walce z nowotworami złośliwymi trzustki. Najczęściej wykonywanymi zabiegami w leczeniu chirurgicznym raka trzustki są: pankreatoduodenektomia, pankreatektomia dystalna, pankreatektomia całkowita. W przypadku guza zlokalizowanego w głowie trzustki leczeniem jest pankreatoduodenektomia, wykonywana sposobem Whipple’a. Charakteryzuje się ona resekcją: głowy trzustki, dwunastnicy, przewodu żółciowego wspólnego z pęcherzykiem żółciowym oraz dystalnej części żołądka [3,8]. Drugą wykonywaną formą leczenia raka głowy trzustki jest pankreatoduodenektomia z zaoszczędzeniem części odźwiernika (TraversoLongmire). Międzynarodowa Grupa Badawcza Chirurgii Trzustki (ISGPS) w swoim stanowisku z 2018 roku przytoczyła wyniki przeglądu Dienera i wsp., w którym wykazano lepsze wyniki pooperacyjne w przypadku metody Traverso-Longmire. Dotyczyły one poprawy przyrostu masy ciała oraz jakości życia pacjentów [17].
Dolegliwości i powikłania po pankreatoduodenektomii
Pankreatoduodenektomia relatywnie rzadko prowadzi do poważnych zaburzeń i trudności w żywieniu. Trzustka zachowuje zdolność do pełnionych funkcji nawet przy zostawionych 3 cm zdrowego miąższu [18]. Niepożądane konsekwencje wynikające w operacji, które mogą wystąpić do 30 dnia po zabiegu opisywane są jako „wczesne powikłania chirurgiczne” i obejmują [18]:
• gastroplegię, czyli opóźnione opróżnianie żołądka;
• przetokę trzustkową – jest przyczyną m.in.: utraty płynów i elektrolitów oraz zaburzenia wchłaniania z powodu niedoboru enzymów trzustkowych;
• przetokę żółciową – jest przyczyną utraty elektrolitów oraz cynku i miedzi;
• ostre zapalenie kikuta trzustki – jest przyczyną zaburzenia trawienia i wchłaniania, cukrzycy oraz kwasicy;
• zapalenie otrzewnej – może być przyczyną hiperkatabolizmu;
• obrzęk limfatyczny – może być przyczyną odwodnienia, zaburzeń elektrolitowych oraz utraty białka.
Cukrzyca
Po pankreatoduodenektomii mogą pojawić się zaburzenia glikemii. Według badanych 8-23% pacjentów po operacji rozwija cukrzycę typu 3 [8]. W porównaniu do cukrzycy typu 1, cukrzyca trzustkowa rzadko wywołuje stan kwasicy ketonowej czy ciężką hiperglikemię. W przeciwieństwie do cukrzycy typu 2 uznaje się, że w cukrzycy trzustkowej tkanki nadal są wrażliwe na insulinę [19].

Opóźnione opróżnianie żołądka
Według danych opóźnione opróżnianie żołądka może wystąpić u 15-57% pacjentów poddanych pankreatoduodenektomii. Gastroplegia przyczynia się do utrudnionego żywienia doustnego i w konsekwencji jest czynnikiem predysponującym do dłuższej hospitalizacji chorych [10,20,21]. W badaniach Tanaka i wsp. wykazano, że założenie nosowo-jelitowej lub przezskórnej sondy jako uzupełnienie doustnego przyjmowania pokarmu może poprawić pooperacyjne parametry chorego, takie jak zmniejszenie ilości powikłań infekcyjnych, a w rezultacie skrócenie pobytu w szpitalu [20].
Zewnątrzwydzielnicza niewydolność trzustki
Według badań u 68-93% chorych na raka trzustki występuje niewydolność zewnątrzwydzielnicza tego gruczołu. Zazwyczaj utrzymuje się ona również po operacji [21].
Enzymy trzustkowe są niezbędnym elementem składowym trawienia pokarmu. Konsekwencjami niewydolności trzustki jest biegunka tłuszczowa, spadek masy ciała oraz obniżona jakość życia. Może doprowadzić również do niedoboru witamin rozpuszczalnych w tłuszczach, czyli witaminy A, D, E oraz K [10].
Podstawową metodą leczenia tego powikłania jest terapia enzymami trzustkowymi [8,22]. Dawki enzymów zazwyczaj wynoszą 20 000 – 75 000 jednostek lipazy na posiłek lub 5 000 – 50 000 jednostek lipazy na przekąskę. Dawka nie powinna przekraczać 10 000 jednostek lipazy na kilogram masy ciała na dzień [8].
Według badań Decher i Berry u pacjentów mających problemy z trawieniem tłuszczu, odpowiednia terapia enzymatyczna może zmniejszyć dyskomfort w jamie brzusznej [22]. Petzel i Hoffman wskazują, że nie jest konieczne zmniejszenie ilości tłuszczu w diecie, jeśli dawka enzymów będzie prawidłowo dobrana [8]. Ponadto tłuszcz ma dużą wartość energetyczną, dlatego dieta niskotłuszczowa może doprowadzić do dodatkowego spadku masy ciała u chorych [22]. Jedynie u pacjentów z ciężką biegunką tłuszczową ograniczenie tłuszczu w diecie mogłoby być korzystne [8].
Wsparcie żywieniowe
Jakość życia pacjenta z rakiem trzustki zmniejsza się przez znaczne zaburzenia odżywiania, dlatego tak ważne jest wsparcie żywieniowe chorych [7]. Prawidłowy stan odżywienia pacjenta umożliwia odpowiednią reakcję organizmu na stosowaną terapię onkologiczną, zmniejsza ilość i nasilenie powikłań, poprawia jakość życia oraz polepsza ogólne rokowania chorych [23]. Główne cele interwencji żywieniowej u pacjentów onkologicznych obejmują [1]:
• poprawę stanu odżywienia, a także osiągnięcie i utrzymanie prawidłowej masy ciała,
• dostarczanie odpowiedniej ilości energii, białka, tłuszczu, witamin i składników mineralnych,
• uzupełnienie niedoborów składników pokarmowych wynikających z umiejscowienia nowotworu, ale także będących skutkiem leczenia onkologicznego,
• zmniejszenie katabolizmu oraz uzyskanie dodatniego bilansu azotowego,
• stabilizację równowagi wodno-elektrolitowej.
Energia i składniki odżywcze powinny być dostarczane w ilości, którą określa się indywidualnie dla każdego pacjenta onkologicznego na podstawie wieku, płci, aktywności fizycznej, stanu odżywienia, rodzaju, lokalizacji i zaawansowania nowotworu, rodzaju terapii przeciwnowotworowej oraz chorób współistniejących.
W nowotworach przewodu pokarmowego dieta powinna obejmować założenia diety łatwostrawnej. W zależności od rodzaju narządu zajętego złośliwą zmianą nowotworową, stopnia jej zaawansowania, bądź rodzaju leczenia wprowadza się indywidualne modyfikacje diety łatwostrawnej [1].
Shen i Jin [24] na podstawie przeprowadzonej metaanalizy sugerują, że wczesne żywienie dojelitowe jest bezpieczne dla pacjentów po pankreatoduodenektomii. Podobne wnioski wyciągnęli Buscemi i in. [25] w przeglądzie z 2015 roku. Ponadto może ono poprawić funkcję odpornościową, zmniejszyć liczbę infekcji oraz utrzymać integralność jelit [10].
Wytyczne Towarzystwa Enhanced Recovery After Surgery (ERAS), Europejskiego Towarzystwa Żywienia Klinicznego i Metabolizmu (ESPEN) oraz Międzynarodowego Stowarzyszenia na rzecz Metabolizmu i Żywienia Chirurgicznego (IASMEN) [26]:
• Przed operacją pacjenci powinni uzyskać wszystkie niezbędne informacje na temat zabiegu oraz wytyczne postępowania. Może to wpłynąć na poprawę żywienia okołooperacyjnego oraz wyników po operacji.
• Osoby palące oraz spożywające często alkohol powinny zaprzestać wymienionych czynności miesiąc przed operacją.
• Zastosowanie okołooperacyjnego immunożywienia przez okres 5-7 dni może zmniejszyć ilość powikłań infekcyjnych.
• Mechaniczne przygotowanie jelit przed pankreatoduodenektomią nie przynosi żadnych korzyści.
• Pokarmy stałe można przyjmować do 6 godzin przed zabiegiem natomiast klarowne płyny do 2 godzin. Ponadto pacjenci bez cukrzycy powinni przyjmować przed operacją napój węglowodanowy na bazie maltodekstryn, ponieważ zmniejsza on pooperacyjną insulinooporność tkanek.
• Należy bardzo dokładnie kontrolować glikemię u pacjenta po zabiegu.
• Zakładanie pacjentowi zgłębnika nosowo-żołądkowego przed operacją uważa się za nieuzasadnione, ponieważ nie wpływa na wynik leczenia.
• Podtrzymywanie bilansu płynów w granicy zera oraz zmniejszenie ilości przyjmowanej wody i soli wpływa na poprawę wyników leczenia, takich jak zmniejszenie ryzyka powikłań czy przyspieszenie powrotu przewodu pokarmowego do działania.
• Nie ma uzasadnienia stosowania somatostatyny i jej analogów po pankreatoduodenektomii.
• U pacjentów z długo utrzymującą się gastroplegią należy rozważyć sztuczne odżywianie.
• Przypuszcza się, że pooperacyjne podawanie pacjentowi gumy do żucia i doustnych środków przeczyszczających może wpłynąć na poprawę pasażu żołądkowo-jelitowego.
• Większość pacjentów wkrótce po przebytej pankreatoduodenektomii toleruje doustne przyjmowanie pokarmu. W przypadku diety doustnej pacjenci powinni ostrożnie i stopniowo zwiększać tolerowane spożycie pokarmu w ciągu 3-4 dni od operacji.
• Żywienie dojelitowe przez zgłębnik należy wdrożyć tylko przy określonych wskazaniach.
• Gdy pacjent nie może spożywać pokarmu doustnie ani nie toleruje żywienia dojelitowego, wówczas tylko w takim wypadku rekomendowane jest żywienie pozajelitowe.
Po pankreatoduodenektomii należy:
• Spożywać często małe posiłki (ok. 5-6) w regularnych odstępach czasu o określonych porach dnia [22].
• Przyjmować enzymy trzustkowe podczas posiłku, ponieważ wykazują wtedy lepsze wchłanianie niż, gdy są przyjmowane przed posiłkiem [21].
• Podczas żywienia przez sondę, enzymy należy przyjmować co kilka godzin [22].
• Ograniczyć ilość błonnika pokarmowego, ponieważ może on zmniejszać aktywność enzymów trzustkowych [21].
• Regularnie monitorować poziom żelaza, witaminy B12 oraz witamin rozpuszczalnych w tłuszczach, a w razie niedoborów należy je suplementować [10].
• Rozważyć suplementację średniołańcuchowych kwasów tłuszczowych - w przypadku trudności w trawieniu tłuszczów nie wymagają one reakcji enzymatycznych, ani soli kwasów żółciowych [8].
Zgodnie z zasadami diety łatwostrawnej należy [27,28]:
• Wykluczyć z diety produkty zawierające duże ilości błonnika pokarmowego, wywołujące wzdęcia, smażone, wędzone, ostre, tłuste, długo zalegające w żołądku, używki;
• Wykluczyć techniki kulinarne tj.: smażenie, duszenie i pieczenie w sposób tradycyjny, odgrzewanie, odsmażanie oraz przyrządzanie zasmażek;
• Stosować gotowanie w wodzie i na parze, pieczenie w folii, rękawie lub pergaminie;
• Dodawać tłuszcz na koniec - po przyrządzeniu potraw (wybierać oleje bogate w wielonienasycone kwasy tłuszczowe oraz w witaminę E);
• Dla lepszej tolerancji lub zmniejszenia ilości błonnika w diecie - rozdrabniać owoce i warzywa oraz usuwać z nich skórki i pestki, a także wybierać produkty zbożowe oczyszczone;
• Stosować spulchnianie potraw (dodając np. ubitą pianę z białka jaja lub namoczoną bułkę pszenną).
Wnioski
Odżywianie stanowi integralną część w leczeniu chirurgicznym nowotworów złośliwych trzustki [9]. Choroba, dolegliwości, leczenie i toczący się proces zapalny powodują, że u znacznej liczby pacjentów dochodzi do utraty masy ciała, licznych niedoborów pokarmowych i niedożywienia [5]. Z tego powodu przed operacją należy przeprowadzić dokładną ocenę odżywienia pacjenta, wprowadzić odpowiednie wsparcie żywieniowe z uwzględnieniem zarówno anatomii i fizjologii trzustki, stosowanej aktualnie terapii oraz oszacowania zapotrzebowania odżywczego i energetycznego chorego, pamiętając o dynamice zmian w związku z progresją choroby. Interwencja żywieniowa wprowadzona na początku leczenia poprawia wyniki i skraca pobyt chorych w szpitalu [9].
Żywienie dojelitowe przez sondę wkrótce po przebytej operacji nie jest rutynowo zalecane, ponieważ po pankreatoduodenektomii preferowane jest wczesne żywienie doustne [9].
Według ASPEN i ESPEN żywienie pozajelitowe jest odpowiednie po zabiegu u pacjentów niedożywionych. Ponadto powinno być zalecane w przypadku, gdy chorzy nie mogą być odżywiani dojelitowo w czasie 7-10 dni od operacji. Ten sposób żywienia nie powinien być jednak stosowany rutynowo po pankreatoduodenektomii ze względu na zwiększone ryzyko wystąpienia infekcji, co w konsekwencji może wpłynąć na wydłużenie hospitalizacji [9].
Piśmiennictwo
1. Lange E, Wilczak J. Zalecenia dotyczące żywienia w trakcie leczenia choroby nowotworowej. [w:] Szawłowski Andrzej Wiktor, Gromadzka-Ostrowska Joanna, Paluszkiewicz Piotr, Słodkowski Maciej, Sobocki Jacek (red.) Żywienie w chorobach nowotworowych. Warszawa: Wyd. Lekarskie PZWL; 2020.
2. World Cancer Research Fund International. Worldwide cancer data. Dostępny w Internecie: https://www.wcrf.org/dietandcancer/worldwide-cancer-data/ Dostęp 13.07.2021.
3. Piotrowski P. Nowotwory przewodu pokarmowego. [w:] Kułakowski Andrzej, SkowrońskaGardas Anna (red.) Onkologia. Warszawa: Wyd. Lekarskie PZWL; 2014.
4. Mihaljevic AL, Hackert T, Loos M, et al. Not all Whipple procedures are equal: Proposal for a classification of pancreatoduodenectomies. Surgery. 2021; 169(6): 1456-1462.
5. Loveday BPT, Lipton L, Thomson BN. Pancreatic cancer: An update on diagnosis and management. Aust J Gen Pract. 2019; 48(12): 826-831.
6. Heinrich S, Lang H. Neoadjuvant Therapy of Pancreatic Cancer: Definitions and Benefits. Int J Mol Sci. 2017; 18(8): 1622.
7. Gilliland TM, Villafane-Ferriol N, Shah KP, et al. Nutritional and Metabolic Derangements in Pancreatic Cancer and Pancreatic Resection. Nutrients. 2017; 9(3): 243.
8. Petzel MQB, Hoffman L. Nutrition Implications for Long-Term Survivors of Pancreatic Cancer Surgery. Nutr Clin Pract. 2017; 32(5): 588-598.
9. Afaneh C, Gerszberg D, Slattery E, Seres DS, Chabot JA, Kluger MD. Pancreatic cancer surgery and nutrition management: a review of the current literature. Hepatobiliary Surg Nutr. 2015; 4(1): 59-71.
10. Pappas S, Krzywda E, McDowell N. Nutrition and pancreaticoduodenectomy. Nutr Clin Pract. 2010; 25(3): 234-243.
11. Jurkowska G. Fizjologia przewodu pokarmowego. [w:] Górski Jan (red.) Fizjologia człowieka. Warszawa: Wyd. Lekarskie PZWL; 2016.
12. Konturek S. (red.) Fizjologia człowieka. Układ trawienny i wydzielanie wewnętrzne. Kraków: Wyd. Uniwersytetu Jagiellońskiego; 2000.
13. Tumas J, Tumiene B, Jurkeviciene J, Jasiunas E, Sileikis A. Nutritional and immune impairments and their effects on outcomes in early pancreatic cancer patients undergoing pancreatoduodenectomy. Clin Nutr. 2020; 39(11): 3385-3394.
14. Wojciechowska U, Didkowska J. Zachorowania i zgony na nowotwory złośliwe w Polsce. Krajowy Rejestr Nowotworów, Narodowy Instytut Onkologii im. Marii Skłodowskiej-Curie – Państwowy Instytut Badawczy. Dostępny w Internecie: http://onkologia.org.pl/raporty/ Dostęp 13.07.2021.
15. World Cancer Research Fund International. Pancreatic cancer. Dostępny w Internecie: https:// www.wcrf.org/dietandcancer/pancreatic-cancer/ Dostęp 13.07.2021.
16. Moore A, Donahue T. Pancreatic Cancer. JAMA. 2019; 322(14): 1426.
17. Gianotti L, Besselink MG, Sandini M, et al. Nutritional support and therapy in pancreatic surgery: A position paper of the International Study Group on Pancreatic Surgery (ISGPS). Surgery. 2018; 164(5): 1035-1048.
18. Szawłowski AW. Konsekwencje żywieniowe leczenia onkologicznego. [w:] Szawłowski Andrzej Wiktor, Gromadzka-Ostrowska Joanna, Paluszkiewicz Piotr, Słodkowski Maciej, Sobocki Jacek (red.) Żywienie w chorobach nowotworowych. Warszawa: Wyd. Lekarskie PZWL; 2020.
19. Maeda H, Hanazaki K. Pancreatogenic diabetes after pancreatic resection. Pancreatology. 2011; 11(2): 268-276.
20. Tanaka M, Heckler M, Mihaljevic AL, et al. Meta-analysis of effect of routine enteral nutrition on postoperative outcomes after pancreatoduodenectomy. Br J Surg. 2019; 106(9): 1138-1146.
21. Berry AJ. Pancreatic surgery: indications, complications, and implications for nutrition intervention. Nutr Clin Pract. 2013; 28(3): 330-357.
22. Decher N, Berry A. Post-Whipple: A practical approach to nutrition management. Pract Gastroenterol. 2012; 36(8): 30-42.
23. Jachnis A, Ławiński M, Słodkowski M. Wydatki energetyczne i zapotrzebowanie na składniki pokarmowe u chorych na nowotwory. [w:] Szawłowski Andrzej Wiktor, Gromadzka-Ostrowska Joanna, Paluszkiewicz Piotr, Słodkowski Maciej, Sobocki Jacek (red.) Żywienie w chorobach nowotworowych. Warszawa: Wyd. Lekarskie PZWL; 2020.
24. Shen Y, Jin W. Early enteral nutrition after pancreatoduodenectomy: a meta-analysis of randomized controlled trials. Langenbecks Arch Surg. 2013; 398(6): 817-823.
25. Buscemi S, Damiano G, Palumbo VD, et al. Enteral nutrition in pancreaticoduodenectomy: a literature review. Nutrients. 2015; 7(5): 3154-3165.
26. Lassen K, Coolsen MM, Slim K, et al. Guidelines for perioperative care for pancreaticoduodenectomy: Enhanced Recovery After Surgery (ERAS®) Society recommendations. Clin Nutr. 2012; 31(6): 817-830.
27. Włodarek D, Lange E. Klasyfikacja diet. [w:] Włodarek Dariusz, Lange Ewa, Kozłowska Lucyna, Głąbska Dominika (red.) Dietoterapia. Warszawa: Wyd. Lekarskie PZWL; 2014.
28. Ciborowska H. Klasyfikacja i charakterystyka diet. [w:] Ciborowska Helena, Rudnicka Anna (red.) Żywienie zdrowego i chorego człowieka. Warszawa: Wyd. Lekarskie PZWL; 2014.
Pełna treść artykułu: Natalia Ksepka, Aneta Jachnis. Żywienie pacjentów po operacji głowy trzustki z powodu choroby nowotworowej. Pielęgniarstwo w Opiece Długoterminowej / Long-Term Care Nursing 2021; 6 (4): 71-80.



