OK FDA dla nowego inhalatora na POCHP
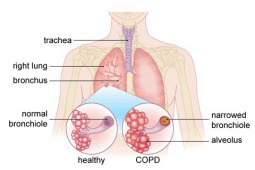
Amerykańska FDA zaaprobowała potrójną terapię fluticazonem, umeclidinium i vilanterolem w inhalatorze raz dziennie dla chorych na POCHP.
Zaakceptowane wskazania obejmują przewlekłe zapalenie oskrzeli i/lub rozedmę u chorych przyjmujących kombinacje fluticazolu i vilanterolu z powodu trudności oddechowych oraz w celu redukcji zaostrzeń u których dodatkowa terapia trudności oddechowych jest wskazana lub w przypadku pacjentów otrzymujących już umeclidinium i kombinacje fluticazolu i vilanterolu.
Wcześniej terapię zarekomendowała EMA. Inhaler jest przeznaczony dla osób z ostrym pogarszaniem się stanu zdrowia wskutek POCHP lub ostrymi objawami.
Wcześniej terapię zarekomendowała EMA. Inhaler jest przeznaczony dla osób z ostrym pogarszaniem się stanu zdrowia wskutek POCHP lub ostrymi objawami.
Źródło:
Medscape/MK
Medscape/MK



