Opis przypadku: Osteopoikilia skojarzona z powstawaniem bliznowców,reumatoidalnym zapaleniem stawów, miastenią, chorobą Gravesa i Basedowa oraz z niedokrwistością z niedoboru witaminy B12
Osteopoikilia jest rzadką, uwarunkowaną genetycznie dysplazją szkieletu, do której objawów należy powstawanie zagęszczeń kostnych – szczególnie w okolicach przystawowych – widocznych na radiogramach w postaci cieni plamistych lub pasmowatych. Występowa-nie osteopoikilii wiąże się z mutacją genu LEMD3 odpowiedzialnego za gęstość mineralną kości. Gen ten wpływa także na ekspresję transformującego czynnika wzrostu β1 (transforming growth factor β1 – TGF-β1), który ma kluczowe znaczenie w procesie włóknienia oraz działanie immunosupresyjne i przeciwzapalne. Chorzy z osteopoikilią wykazują skłonność do nadmiernego bliznowacenia tkanek (bliznowce), obserwuje się u nich również występowanie chorób towarzyszących o podłożu autoimmunologicznym.
Wstęp
Osteopoikilia (OPK) – opisana przez Albers-Schönberga w 1915 r. dysplazja szkieletu – polega na powstawaniu w tkance kostnej gąbczastej zagęszczeń widocznych w badaniach obrazowych w postaci cieni plamistych lub pasmowatych, umiejscowionych przede wszystkim w okolicach stawów [1–3]. Choroba jest uwarunkowana genetycznie, zależna od autosomalnego, dominującego typu dziedziczenia, w ogólnej populacji występuje z częstością ok. 1 : 50 000 [1]. W większości przypadków OPK jest bezobjawowa, ale u 15–20% chorych towarzyszy jej ból lub zapalenie stawów [3]. Zmiany w kościach najczęściej są wykrywane przypadkowo, gdy wykonuje się badania obrazowe z innych wskazań – przeważnie stanów pourazowych.
Przez wiele lat usiłowano wykryć przyczynę OPK, wysuwano wiele hipotez dotyczących zaburzeń w obrębie tkanki kostnej. W 2004 r. Hellemans i wsp. [4, 5] stwierdzili, że etiologia choroby związana jest z mutacją genu LEMD3 (locus 12q14). Mutacje tego genu w rodzinie chorych z OPK wykazali także później Baasanjav i wsp. [6]. Z uwagi na stwierdzenie, że LEMD3 jest antagonistą transformującego czynnika wzrostu (transforming growth factor β1 – TGF-β1), jego mutacja może się łączyć ze zwiększoną ekspresją tej cytokiny i przyczyniać się do nasilonego procesu włóknienia tkanek [2, 4, 7]. Zauważono, że u chorych z OPK dochodzi do powstawania bliznowców [2, 8].
W 1992 r. opisaliśmy przypadek młodej chorej na reumatoidalne zapalenie stawów (RZS), u której w badaniu radiograficznym widoczne były zmiany odpowiadające OPK [9]. Po wykonaniu u chorej aloplastyki stawów kolanowych wokół operowanych stawów doszło do wytworzenia się obfitej masy tkanki włóknistej powodującej przykurcze. Powtórna operacja spowodowała ponownie to powikłanie, przykurcze stopniowo narastały i były przyczyną ciężkiego kalectwa. Oprócz tendencji do włóknienia tkanek, u chorych z OPK zauważono występowanie wielu chorób współistniejących, przede wszystkim RZS [9–11].
W 2013 r. konsultowano chorą z OPK, u której doszło do powstania bliznowców po szczepieniu przeciwgruźliczym i zabiegu chirurgicznym, a ponadto wystąpiły objawy RZS, miastenii, choroby Gravesa i Basedowa oraz niedokrwistość z niedoboru witaminy B12.
Opis przypadku
Chora, lat 36, od 1995 r. (przez 19 lat) leczona z rozpoznaniem RZS. Zmiany zapalne obejmują głównie stawy międzypaliczkowe bliższe palców rąk, śródręczno-paliczkowe i nadgarstkowe, ból pojawia się okresowo w stawach barkowych i kolanowych. Zdjęcia RTG stawów wykazywały od początku choroby zmiany w kościach typowe dla plamistej postaci OPK. Chora była początkowo leczona metotreksatem, glikokortykosteroidami (GKS) i niesteroidowymi lekami przeciwzapalnymi (NLPZ). Metotreksat odstawiono jednak po kilku miesiącach z powodu złej tolerancji.
W 1999 r. oprócz objawów zapalenia stawów wystąpiło bardzo znaczne osłabienie siły mięśniowej, zaburzenia mowy i opadanie powiek. Chora przebywała wówczas na Oddziale Neurologii Szpitala im. J. Strusia w Poznaniu, gdzie metodą tomografii komputerowej wykazano obecność szczątkowej grasicy, a badaniem elektromiograficznym stwierdzono cechy miastenii. Z rozpoznaniem miastenii chora została następnie skierowana do Szpitala Specjalistycznego Chorób Płuc w Zakopanem i poddana tymektomii. Po zabiegu wytworzył się bliznowiec. W 2001 r. chora była leczona jodem 131 z powodu objawów nadczynności tarczycy, z rozpoznaniem choroby Gravesa i Basedowa, w Klinice Endokrynologii Akademii Medycznej w Poznaniu. Po leczeniu wystąpiła niedoczynność tarczycy wymagająca stosowania hormonów. W 2010 r. rozpoznano u chorej niedokrwistość związaną z niedoborem witaminy B12 (leczona na Oddziale Chorób Wewnętrznych Szpitala w Pleszewie).
Obecnie badaniem przedmiotowym stwierdzono nadwagę, w bliźnie pooperacyjnej po tymektomii i w bliźnie powstałej przed laty po wykonaniu szczepienia przeciw gruźlicy widoczne są bliznowce (ryc. 1a, b). W obrębie rąk stwierdzono zanik mięśni międzykostnych, obrzęk stawów śródręczno-paliczkowych i międzypaliczkowych bliższych palców od II do V obu rąk, znacznie ograniczoną ruchomość i bolesność obu stawów nadgarstkowych, bolesność ruchową stawu barkowego prawego.
W badaniach laboratoryjnych o znaczeniu diagnostycznym wykazano obecność czynnika reumatoidalnego w klasie IgM o stężeniu 167 RU/ml i przeciwciał przeciw cytrulinowanym peptydom – 79,2 RU/ml.
Badanie morfologii krwi (przed leczeniem witaminą B12) wykazało: WBC – 6,0 K/µl, RBC – 2,39 M/µl, HGB – 9,0 g/dl, HCT – 26,1%, MCV – 109,2 fl, MCH – 37,7 pg, MCHC – 34,5 g/dl, PLT – 114,0 K/µl, RDW – 17,7%, PDW – 13,9 fl, MPV – 11,5 fl, P-LCR – 34,8%. Po rozpoczęciu leczenia nastąpiła stopniowa normalizacja obrazu morfologicznego krwi.
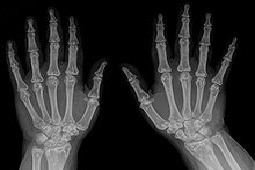
Zdjęcia rentgenowskie stawów rąk wykazały ostatnio zmiany odpowiadające III/IV okresowi RZS, szczególnie w stawach nadgarstkowych, i towarzyszące im zagęszczenia tkanki kostnej typowe dla plamistej postaci OPK (ryc. 2a, b). Zdjęcia stawów stóp i stawów skokowych uwidoczniły zmiany związane z OPK (ryc. 3a–d).
Chora otrzymuje podtrzymujące dawki GKS (metypred 6,0 mg/dobę), witaminę B12, eutyroks, okresowo NLPZ. W przebiegu RZS obserwuje się okresy nasilenia objawów zapalnych i okresy remisji wymagające odpowiedniej modyfikacji leczenia (m.in. lekami modyfikującymi przebieg choroby).
Dyskusja
Jak wspomniano wyżej, u chorych z OPK oprócz zwiększonej skłonności do włóknienia tkanek obserwuje się współistnienie wielu chorób towarzyszących. Nie ma do tej pory badań dotyczących częstości występowania tych skojarzeń ani wyjaśnienia ich przyczyny. Dysponujemy opisami pojedynczych przypadków, które wskazują jednak na celowość dalszego śledzenia tego zjawiska.
Osteopoikilii towarzyszą stany z nasilonym włóknieniem narządów (wątroba), nowotwory złośliwe oraz choroby autoimmunologiczne. Opisywano równoczesne występowanie OPK i RZS [9–11], a także RZS skojarzonego z objawami zespołu Sjögrena [12], tocznia rumieniowatego układowego [13] i tocznia rumieniowatego krążkowego [14]. Osteopoikilia łączyła się z objawami twardziny układowej [15, 16], powstawaniem bliznowców [7, 16] oraz ze spondyloartropatiami seronegatywnymi [17, 18]. Dotychczas nie obserwowano kojarzenia się OPK z chorobami autoimmunologicznymi rozpoznanymi w opisanym obecnie przypadku.
Transformujący czynnik wzrostu β1 może uczestniczyć w powstawaniu wymienionych wyżej skojarzeń OPK z innymi chorobami. Jak już wspomniano, mutacje genu LEMD3 mogą wpływać na ekspresję tej cytokiny.
Działanie TGF-β1 w ustroju jest wielokierunkowe. Cytokina ta jest głównym regulatorem fibrogenezy – zarówno w stanie prawidłowym, jak i w uszkodzeniach tkanek (proces gojenia), stymuluje syntezę macierzy pozakomórkowej, a hamuje produkcję metaloproteinaz [19–22]. Odgrywa ponadto rolę w angiogenezie, wpływa na przebudowę tkanki kostnej, a równocześnie wykazuje działanie przeciwzapalne i immunosupresyjne [23, 24]. Udowodniono m.in., że hamuje ona aktywność cytotoksyczną komórek NK oraz moduluje różnicowanie i proliferację limfocytów B i T [22, 25]. U myszy pozbawionych genu kodującego TGF-β1 dochodzi do wytwarzania przeciwciał przeciwjądrowych, powstawania kompleksów immunologicznych i do wielonarządowych zmian zapalnych [26]. W surowicy chorych na toczeń rumieniowaty układowy, a także w przebiegu choroby Hashimoto wykazano istotne zmniejszenie stężenia TGF-β1 [13].
Badania z zakresu genetyki i biologii molekularnej prowadzone w wielu ośrodkach pozwalają stopniowo poznawać etiopatogenezę wymienionych wyżej chorób i przyczyny ich kojarzenia się ze sobą.
Przypadek przedstawiony w niniejszym opracowaniu zasługuje na uwagę w związku z niezwykłym współistnieniem chorób autoimmunologicznych towarzyszących OPK z równoczesną skłonnością do tworzenia bliznowców. Opis ten jest ponadto kolejnym dowodem, że u osób z OPK mogą nastąpić powikłania zabiegów chirurgicznych związane z powstającą blizną. Zagrożenie to dotyczy przede wszystkim zabiegów wykonywanych w obrębie stawów, ponieważ – tak jak u poprzednio opisanej chorej – może dojść do ich unieruchomienia i do kalectwa [9].
Piśmiennictwo
1. Benli IT, Akalin S, Boysan E, et al. Epidemiological, clinical and radiological aspects of osteopoikilosis. J Bone Joint Surg 1991; 74: 504-506.
2. Sarralde A, Garcia-Cruz D, Nazara Z, Sanchez-Corona J. Osteopoikilosis: Report of a familial case. Genet Counsel 1994; 5: 373-375.
3. Borman P, Özoran K, Aydoğ Ş, Coşkun S. Osteopoikilosis: report of a clinical case and review of the literature. Joint Bone Spine 2002; 69: 230-233.
4. Baasanjav S, Jamsheer A, Kolanczyk M, et al. Osteopoikilosis and multiple exostoses caused by novel mutations in LEMD3 and EXT1 genes respectively – coincidence in one family. BMC Med Genet 2010; 11: 110-117.
5. Ben-Asher E, Zelzer E, Lancet D. LEMD3: the gene responsible for bone density disorders (osteopoikilosis). IMAJ 2005; 7: 273-274.
6. Hellemans J, Preobrazhenska O, Willaert A, et al. Loss-of-function mutations in LEMD3 result in osteopoikilosis, Buschke-Ollendorff syndrome and melorheostosis. Nat Genet 2004; 36: 1213-1218.
7. Mumm S, Wenkert D, Zhang X, et al. Deactivating germline mutations in LEMD3 cause osteopoikilosis and Buschke-Ollendorff syndrome, but not sporadic melorheostosis. J Bone Min Res 2007; 22: 243-250.
8. Raskin MM. Osteopoikilosis: possible association with dystocia and keloid. South Med J 1975; 68: 270-278.
9. Zimmermann-Górska I, Włodarczyk R, Jakubowski S. Nadmierne bliznowacenie tkanek po plastyce totalnej stawów kolanowych u chorej na reumatoidalne zapalenie stawów z równoczesną osteopoikilią. Reumatologia 1992; 30: 249-255.
10. Cazzola M, Caruso I, Montrare F, et al. Rheumatoid arthritis associated with osteopoikilosis: a case report. Clin Exp Rheumatol 1989; 7: 423-426.
11. Zajdel J, Zajdel R. Reumatoidalne zapalenie stawów u chorej z osteopoikilią. Wiad Lek 1996; 49: 7-12.
12. Ureten K. Osteopoikilosis in a patient with rheumatoid arthritis complicated with dry eyes. Rheumatol Int 2007; 27: 1079-1082.
13. Manolova I, Gerenova J, Ivanova M. Serum levels of transforming growth factor-β1 (TGF-β1) in patients with systemic lupus erythematosus and Hashimoto thyroiditis. Eur Cytokine Netw 2013; 24: 69-74.
14. Bicer A, Tursen K, Ozer C, et al. Coexistence of osteopoikilosis and discoid lupus erythematosus: a case report. Clin Rheumatol 2012; 10: 405-407.
15. Asano Y, Ihn H, Yamane K, et al. Impaired Smad7-Smurf-mediated negative regulation of TGF-β signalling in scleroderma fibroblasts. J Clin Invest 2004; 113: 253-264.
16. Igarashi A, Nashiro K, Kikuchi K, et al. Connective tissue growth factor gene expression in tissue sections from localized scleroderma, keloid, and other fibrotic skin disorders. J Invest Dermatol 1996; 106: 729-733.
17. Sari I, Simsek I, Guvenc I, et al. Osteopoikilosis coexistence with ankylosing spondylitis and familial Mediterraen fever. Rheumatol Int 2009; 29: 321-323.
18. Ruaro B, Sulli A, Alessandri E, et al. Coexistence of osteopoikilosis with seronegative spondyloarthritis and Raynaud’s phenomenon: first case report with evaluation of the nailfold capillary bed and literature review. Reumatismo 2012; 64: 335-339.
19. Denton CP, Abraham DJ. Transforming growth factor-beta and connective tissue growth factor: Key cytokines in scleroderma pathogenesis. Curr Opin Rheumatol 2001; 13: 505-511.
20. Ihn H. Pathogenesis of fibrosis: role of TGFβ and CTGF. Curr Opin Rheumatol 2002; 14: 681-685.
21. Leask A, Abraham DJ. TGF-β signalling and the fibrotic response. The FASEB Journal 2004; 18: 816-827.
22. Mauviel A. Transforming growth factor-beta: a key mediator of fibrosis. Methods Mol Med 2005; 117: 69-80.
23. Li Mo, Wan YY, Sanjabi S, et al. Transforming growth factor-beta regulation in immune responses. Ann Bev Immunol 2006; 24: 99-146.
24. Yoshimura A, Muto G. TGF-β function in immune suppression in: Current Topics in Microbiology and Immunology. Ahmed R, Honjo T (eds.), Negative-Co-Receptors and Ligands. Springer Berlin-Heilderberg, 2011.
25. Wu J, Xie A, Chen W. Cytokine regulation of immune tolerance. Burns & Trauma 2014; 2: 11-17.
26. Letterio JJ, Geiser AG, Kulkarni AB. Autoimmunity associated with TGF-β-1-deficiency in mice is dependent on MHC class II antigen expression. J Clin Invest 1996; 98: 2109-2119.
Osteopoikilia (OPK) – opisana przez Albers-Schönberga w 1915 r. dysplazja szkieletu – polega na powstawaniu w tkance kostnej gąbczastej zagęszczeń widocznych w badaniach obrazowych w postaci cieni plamistych lub pasmowatych, umiejscowionych przede wszystkim w okolicach stawów [1–3]. Choroba jest uwarunkowana genetycznie, zależna od autosomalnego, dominującego typu dziedziczenia, w ogólnej populacji występuje z częstością ok. 1 : 50 000 [1]. W większości przypadków OPK jest bezobjawowa, ale u 15–20% chorych towarzyszy jej ból lub zapalenie stawów [3]. Zmiany w kościach najczęściej są wykrywane przypadkowo, gdy wykonuje się badania obrazowe z innych wskazań – przeważnie stanów pourazowych.
Przez wiele lat usiłowano wykryć przyczynę OPK, wysuwano wiele hipotez dotyczących zaburzeń w obrębie tkanki kostnej. W 2004 r. Hellemans i wsp. [4, 5] stwierdzili, że etiologia choroby związana jest z mutacją genu LEMD3 (locus 12q14). Mutacje tego genu w rodzinie chorych z OPK wykazali także później Baasanjav i wsp. [6]. Z uwagi na stwierdzenie, że LEMD3 jest antagonistą transformującego czynnika wzrostu (transforming growth factor β1 – TGF-β1), jego mutacja może się łączyć ze zwiększoną ekspresją tej cytokiny i przyczyniać się do nasilonego procesu włóknienia tkanek [2, 4, 7]. Zauważono, że u chorych z OPK dochodzi do powstawania bliznowców [2, 8].
W 1992 r. opisaliśmy przypadek młodej chorej na reumatoidalne zapalenie stawów (RZS), u której w badaniu radiograficznym widoczne były zmiany odpowiadające OPK [9]. Po wykonaniu u chorej aloplastyki stawów kolanowych wokół operowanych stawów doszło do wytworzenia się obfitej masy tkanki włóknistej powodującej przykurcze. Powtórna operacja spowodowała ponownie to powikłanie, przykurcze stopniowo narastały i były przyczyną ciężkiego kalectwa. Oprócz tendencji do włóknienia tkanek, u chorych z OPK zauważono występowanie wielu chorób współistniejących, przede wszystkim RZS [9–11].
W 2013 r. konsultowano chorą z OPK, u której doszło do powstania bliznowców po szczepieniu przeciwgruźliczym i zabiegu chirurgicznym, a ponadto wystąpiły objawy RZS, miastenii, choroby Gravesa i Basedowa oraz niedokrwistość z niedoboru witaminy B12.
Opis przypadku
Chora, lat 36, od 1995 r. (przez 19 lat) leczona z rozpoznaniem RZS. Zmiany zapalne obejmują głównie stawy międzypaliczkowe bliższe palców rąk, śródręczno-paliczkowe i nadgarstkowe, ból pojawia się okresowo w stawach barkowych i kolanowych. Zdjęcia RTG stawów wykazywały od początku choroby zmiany w kościach typowe dla plamistej postaci OPK. Chora była początkowo leczona metotreksatem, glikokortykosteroidami (GKS) i niesteroidowymi lekami przeciwzapalnymi (NLPZ). Metotreksat odstawiono jednak po kilku miesiącach z powodu złej tolerancji.
W 1999 r. oprócz objawów zapalenia stawów wystąpiło bardzo znaczne osłabienie siły mięśniowej, zaburzenia mowy i opadanie powiek. Chora przebywała wówczas na Oddziale Neurologii Szpitala im. J. Strusia w Poznaniu, gdzie metodą tomografii komputerowej wykazano obecność szczątkowej grasicy, a badaniem elektromiograficznym stwierdzono cechy miastenii. Z rozpoznaniem miastenii chora została następnie skierowana do Szpitala Specjalistycznego Chorób Płuc w Zakopanem i poddana tymektomii. Po zabiegu wytworzył się bliznowiec. W 2001 r. chora była leczona jodem 131 z powodu objawów nadczynności tarczycy, z rozpoznaniem choroby Gravesa i Basedowa, w Klinice Endokrynologii Akademii Medycznej w Poznaniu. Po leczeniu wystąpiła niedoczynność tarczycy wymagająca stosowania hormonów. W 2010 r. rozpoznano u chorej niedokrwistość związaną z niedoborem witaminy B12 (leczona na Oddziale Chorób Wewnętrznych Szpitala w Pleszewie).
Obecnie badaniem przedmiotowym stwierdzono nadwagę, w bliźnie pooperacyjnej po tymektomii i w bliźnie powstałej przed laty po wykonaniu szczepienia przeciw gruźlicy widoczne są bliznowce (ryc. 1a, b). W obrębie rąk stwierdzono zanik mięśni międzykostnych, obrzęk stawów śródręczno-paliczkowych i międzypaliczkowych bliższych palców od II do V obu rąk, znacznie ograniczoną ruchomość i bolesność obu stawów nadgarstkowych, bolesność ruchową stawu barkowego prawego.
W badaniach laboratoryjnych o znaczeniu diagnostycznym wykazano obecność czynnika reumatoidalnego w klasie IgM o stężeniu 167 RU/ml i przeciwciał przeciw cytrulinowanym peptydom – 79,2 RU/ml.
Badanie morfologii krwi (przed leczeniem witaminą B12) wykazało: WBC – 6,0 K/µl, RBC – 2,39 M/µl, HGB – 9,0 g/dl, HCT – 26,1%, MCV – 109,2 fl, MCH – 37,7 pg, MCHC – 34,5 g/dl, PLT – 114,0 K/µl, RDW – 17,7%, PDW – 13,9 fl, MPV – 11,5 fl, P-LCR – 34,8%. Po rozpoczęciu leczenia nastąpiła stopniowa normalizacja obrazu morfologicznego krwi.
Zdjęcia rentgenowskie stawów rąk wykazały ostatnio zmiany odpowiadające III/IV okresowi RZS, szczególnie w stawach nadgarstkowych, i towarzyszące im zagęszczenia tkanki kostnej typowe dla plamistej postaci OPK (ryc. 2a, b). Zdjęcia stawów stóp i stawów skokowych uwidoczniły zmiany związane z OPK (ryc. 3a–d).
Chora otrzymuje podtrzymujące dawki GKS (metypred 6,0 mg/dobę), witaminę B12, eutyroks, okresowo NLPZ. W przebiegu RZS obserwuje się okresy nasilenia objawów zapalnych i okresy remisji wymagające odpowiedniej modyfikacji leczenia (m.in. lekami modyfikującymi przebieg choroby).
Dyskusja
Jak wspomniano wyżej, u chorych z OPK oprócz zwiększonej skłonności do włóknienia tkanek obserwuje się współistnienie wielu chorób towarzyszących. Nie ma do tej pory badań dotyczących częstości występowania tych skojarzeń ani wyjaśnienia ich przyczyny. Dysponujemy opisami pojedynczych przypadków, które wskazują jednak na celowość dalszego śledzenia tego zjawiska.
Osteopoikilii towarzyszą stany z nasilonym włóknieniem narządów (wątroba), nowotwory złośliwe oraz choroby autoimmunologiczne. Opisywano równoczesne występowanie OPK i RZS [9–11], a także RZS skojarzonego z objawami zespołu Sjögrena [12], tocznia rumieniowatego układowego [13] i tocznia rumieniowatego krążkowego [14]. Osteopoikilia łączyła się z objawami twardziny układowej [15, 16], powstawaniem bliznowców [7, 16] oraz ze spondyloartropatiami seronegatywnymi [17, 18]. Dotychczas nie obserwowano kojarzenia się OPK z chorobami autoimmunologicznymi rozpoznanymi w opisanym obecnie przypadku.
Transformujący czynnik wzrostu β1 może uczestniczyć w powstawaniu wymienionych wyżej skojarzeń OPK z innymi chorobami. Jak już wspomniano, mutacje genu LEMD3 mogą wpływać na ekspresję tej cytokiny.
Działanie TGF-β1 w ustroju jest wielokierunkowe. Cytokina ta jest głównym regulatorem fibrogenezy – zarówno w stanie prawidłowym, jak i w uszkodzeniach tkanek (proces gojenia), stymuluje syntezę macierzy pozakomórkowej, a hamuje produkcję metaloproteinaz [19–22]. Odgrywa ponadto rolę w angiogenezie, wpływa na przebudowę tkanki kostnej, a równocześnie wykazuje działanie przeciwzapalne i immunosupresyjne [23, 24]. Udowodniono m.in., że hamuje ona aktywność cytotoksyczną komórek NK oraz moduluje różnicowanie i proliferację limfocytów B i T [22, 25]. U myszy pozbawionych genu kodującego TGF-β1 dochodzi do wytwarzania przeciwciał przeciwjądrowych, powstawania kompleksów immunologicznych i do wielonarządowych zmian zapalnych [26]. W surowicy chorych na toczeń rumieniowaty układowy, a także w przebiegu choroby Hashimoto wykazano istotne zmniejszenie stężenia TGF-β1 [13].
Badania z zakresu genetyki i biologii molekularnej prowadzone w wielu ośrodkach pozwalają stopniowo poznawać etiopatogenezę wymienionych wyżej chorób i przyczyny ich kojarzenia się ze sobą.
Przypadek przedstawiony w niniejszym opracowaniu zasługuje na uwagę w związku z niezwykłym współistnieniem chorób autoimmunologicznych towarzyszących OPK z równoczesną skłonnością do tworzenia bliznowców. Opis ten jest ponadto kolejnym dowodem, że u osób z OPK mogą nastąpić powikłania zabiegów chirurgicznych związane z powstającą blizną. Zagrożenie to dotyczy przede wszystkim zabiegów wykonywanych w obrębie stawów, ponieważ – tak jak u poprzednio opisanej chorej – może dojść do ich unieruchomienia i do kalectwa [9].
Piśmiennictwo
1. Benli IT, Akalin S, Boysan E, et al. Epidemiological, clinical and radiological aspects of osteopoikilosis. J Bone Joint Surg 1991; 74: 504-506.
2. Sarralde A, Garcia-Cruz D, Nazara Z, Sanchez-Corona J. Osteopoikilosis: Report of a familial case. Genet Counsel 1994; 5: 373-375.
3. Borman P, Özoran K, Aydoğ Ş, Coşkun S. Osteopoikilosis: report of a clinical case and review of the literature. Joint Bone Spine 2002; 69: 230-233.
4. Baasanjav S, Jamsheer A, Kolanczyk M, et al. Osteopoikilosis and multiple exostoses caused by novel mutations in LEMD3 and EXT1 genes respectively – coincidence in one family. BMC Med Genet 2010; 11: 110-117.
5. Ben-Asher E, Zelzer E, Lancet D. LEMD3: the gene responsible for bone density disorders (osteopoikilosis). IMAJ 2005; 7: 273-274.
6. Hellemans J, Preobrazhenska O, Willaert A, et al. Loss-of-function mutations in LEMD3 result in osteopoikilosis, Buschke-Ollendorff syndrome and melorheostosis. Nat Genet 2004; 36: 1213-1218.
7. Mumm S, Wenkert D, Zhang X, et al. Deactivating germline mutations in LEMD3 cause osteopoikilosis and Buschke-Ollendorff syndrome, but not sporadic melorheostosis. J Bone Min Res 2007; 22: 243-250.
8. Raskin MM. Osteopoikilosis: possible association with dystocia and keloid. South Med J 1975; 68: 270-278.
9. Zimmermann-Górska I, Włodarczyk R, Jakubowski S. Nadmierne bliznowacenie tkanek po plastyce totalnej stawów kolanowych u chorej na reumatoidalne zapalenie stawów z równoczesną osteopoikilią. Reumatologia 1992; 30: 249-255.
10. Cazzola M, Caruso I, Montrare F, et al. Rheumatoid arthritis associated with osteopoikilosis: a case report. Clin Exp Rheumatol 1989; 7: 423-426.
11. Zajdel J, Zajdel R. Reumatoidalne zapalenie stawów u chorej z osteopoikilią. Wiad Lek 1996; 49: 7-12.
12. Ureten K. Osteopoikilosis in a patient with rheumatoid arthritis complicated with dry eyes. Rheumatol Int 2007; 27: 1079-1082.
13. Manolova I, Gerenova J, Ivanova M. Serum levels of transforming growth factor-β1 (TGF-β1) in patients with systemic lupus erythematosus and Hashimoto thyroiditis. Eur Cytokine Netw 2013; 24: 69-74.
14. Bicer A, Tursen K, Ozer C, et al. Coexistence of osteopoikilosis and discoid lupus erythematosus: a case report. Clin Rheumatol 2012; 10: 405-407.
15. Asano Y, Ihn H, Yamane K, et al. Impaired Smad7-Smurf-mediated negative regulation of TGF-β signalling in scleroderma fibroblasts. J Clin Invest 2004; 113: 253-264.
16. Igarashi A, Nashiro K, Kikuchi K, et al. Connective tissue growth factor gene expression in tissue sections from localized scleroderma, keloid, and other fibrotic skin disorders. J Invest Dermatol 1996; 106: 729-733.
17. Sari I, Simsek I, Guvenc I, et al. Osteopoikilosis coexistence with ankylosing spondylitis and familial Mediterraen fever. Rheumatol Int 2009; 29: 321-323.
18. Ruaro B, Sulli A, Alessandri E, et al. Coexistence of osteopoikilosis with seronegative spondyloarthritis and Raynaud’s phenomenon: first case report with evaluation of the nailfold capillary bed and literature review. Reumatismo 2012; 64: 335-339.
19. Denton CP, Abraham DJ. Transforming growth factor-beta and connective tissue growth factor: Key cytokines in scleroderma pathogenesis. Curr Opin Rheumatol 2001; 13: 505-511.
20. Ihn H. Pathogenesis of fibrosis: role of TGFβ and CTGF. Curr Opin Rheumatol 2002; 14: 681-685.
21. Leask A, Abraham DJ. TGF-β signalling and the fibrotic response. The FASEB Journal 2004; 18: 816-827.
22. Mauviel A. Transforming growth factor-beta: a key mediator of fibrosis. Methods Mol Med 2005; 117: 69-80.
23. Li Mo, Wan YY, Sanjabi S, et al. Transforming growth factor-beta regulation in immune responses. Ann Bev Immunol 2006; 24: 99-146.
24. Yoshimura A, Muto G. TGF-β function in immune suppression in: Current Topics in Microbiology and Immunology. Ahmed R, Honjo T (eds.), Negative-Co-Receptors and Ligands. Springer Berlin-Heilderberg, 2011.
25. Wu J, Xie A, Chen W. Cytokine regulation of immune tolerance. Burns & Trauma 2014; 2: 11-17.
26. Letterio JJ, Geiser AG, Kulkarni AB. Autoimmunity associated with TGF-β-1-deficiency in mice is dependent on MHC class II antigen expression. J Clin Invest 1996; 98: 2109-2119.
Źródło:
Irena Zimmermann-Górska Reumatologia 2014; 52, 2: 146–152 DOI (digital object identifier): 10.5114/reum.2014.42802
Irena Zimmermann-Górska Reumatologia 2014; 52, 2: 146–152 DOI (digital object identifier): 10.5114/reum.2014.42802
Kategorie:
Reumatoidalne zapalenie stawów