Ostre zespoły wieńcowe bez uniesienia odcinka ST - wytyczne ESC 2020 w praktyce lekarza rodzinnego w 2021 r.

W ostatnich kilkunastu latach zwiększyła się częstość rozpoznawania ostrego zespołu wieńcowego bez uniesienia odcinka ST (nonSTsegment elevation acute coronary syndrome – NSTE-ACS). Prawdopodobnie przyczyną jest nie tyle rzeczywisty wzrost zapadalności, co udoskonalenie metod diagnostycznych, głównie opartych na stosowaniu wysokoczułych testów do oznaczania troponin T lub I, oraz usprawnienie systemów postępowania z chorymi z bólem w klatce piersiowej.
Artykuł Sylwii Iwańczyk z I Kliniki Kardiologii Uniwersytetu Medycznego im. K. Marcinkowskiego w Poznaniu.
Zaobserwowano również wyraźny wzrost częstości wykonywania wczesnej koronarografii u pacjentów z zawałem serca bez uniesienia odcinka ST (nonSTsegment elevation myocardial infarction – NSTEMI) (≤ 72 h od przyjęcia) – z 9% w 1995 r. do 60% w 2010 r., oraz przezskórnej rewaskularyzacji mięśnia sercowego w trakcie pierwszego pobytu w szpitalu – z 12,5% do 67%. Dzięki tym zmianom zredukowano 6-miesięczną śmiertelność z 17,2% do 6,3% [1]. Rozpoznanie ostrego zawału mięśnia sercowego (acute myocardial infarction – AMI) wymaga spełnienia następujących kryteriów:
1) wzrost i/lub spadek poziomu biomarkera sercowego [preferencyjnie troponiny sercowej oznaczanej metodą wysokoczułą (hs-cTn) T lub I] z ≥ 1 wartością > 99. percentyla górnej granicy zakresu wartości referencyjnych oraz
2) co najmniej jedno z poniższych:
• objawy niedokrwienia mięśnia sercowego,
• nowe zmiany niedokrwienne w EKG,
• pojawienie się patologicznych załamków Q w EKG,
• dowody w badaniach obrazowych na utratę żywotnego miokardium lub nowe regionalne nieprawidłowości kurczliwości ścian o wzorcu odpowiadającym etiologii niedokrwiennej,
• skrzeplina w tętnicy wieńcowej zidentyfikowana w angiografii lub badaniu sekcyjnym. W zależności od patogenezy rozróżnia się pięć typów zawału mięśnia sercowego (tab. 1).

Rozpoznanie
Rozpoznanie NSTEMI ustala się na podstawie obrazu klinicznego. Wśród NSTE-ACS wyróżniono kilka postaci klinicznych:
• przedłużony (> 20 min) ból dławicowy w spoczynku,
• świeża (de novo) dławica piersiowa (II lub III klasa wg Canadian Cardiovascular Society – CCS),
• świeża destabilizacja uprzednio stabilnej dławicy piersiowej z nasileniem do co najmniej III klasy CCS (dławica crescendo),
• dławica pozawałowa.
Typowa dławica piersiowa charakteryzuje się bólem zamostkowym, uczuciem ucisku lub ciężkości (angina) promieniującym do lewego ramienia, obu rąk, prawego ramienia, szyi lub szczęki, które może być przerywane (zwykle trwa kilka minut) lub uporczywe [2]. Mogą wystąpić dodatkowe objawy, takie jak pocenie się, nudności, ból w nadbrzuszu, duszność i omdlenie. Nietypowe objawy obejmują izolowany ból w nadbrzuszu, dolegliwości podobne do niestrawności oraz izolowaną duszność lub zmęczenie. Nietypowe symptomy częściej obserwuje się u osób starszych, u kobiet oraz u chorych na cukrzycę, przewlekłą chorobę nerek czy otępienie [3]. Zaostrzenie objawów pod wpływem wysiłku fizycznego i ich ustąpienie w spoczynku lub po podaniu azotanów zwiększa prawdopodobieństwo wystąpienia niedokrwienia mięśnia sercowego. Do stanów, które mogą zaostrzyć lub przyspieszyć NSTE-ACS, zalicza się anemię, infekcję, stan zapalny, gorączkę, przełom nadciśnieniowy, stres emocjonalny oraz zaburzenia metaboliczne lub endokrynologiczne (szczególnie tarczycy).
Narzędzia diagnostyczne
Elektrokardiogram
Zaleca się wykonanie spoczynkowego 12-odprowadzeniowego EKG w ciągu 10 min od przybycia pacjenta na oddział ratunkowy lub przy pierwszym kontakcie z medycznymi służbami ratowniczymi w warunkach przedszpitalnych z natychmiastową interpretacją przez wykwalifikowanego lekarza. Zapis EKG w przypadku NSTE-ACS może być prawidłowy, jednakże charakterystyczne nieprawidłowości obejmują:
• obniżenie odcinka ST,
• przemijające uniesienie odcinka ST,
• zmiany załamka T.
W razie wątpliwości wskazane jest wykonanie zapisu z odprowadzeń V7–V9, a w razie podejrzenia zawału prawej komory zapisu z odprowadzeń prawokomorowych V3R i V4R. Chorych z objawami niedokrwienia mięśnia sercowego i blokiem lewej odnogi pęczka Hisa (left bundle branch block – LBBB) leczy się jak pacjentów z zawałem serca z uniesieniem odcinka ST (STsegment elevation myocardial infarction – STEMI), niezależnie od wcześniejszego występowania lub nieobecności LBBB. Uniesienie odcinka ST u pacjentów z blokiem prawej odnogi pęczka Hisa (right bundle branch block – RBBB) wskazuje na STEMI. Obniżenie odcinka ST w odprowadzeniu I, aVL i V5–V6 wskazuje na rozpoznanie NSTE-ACS.
Biomarkery – troponina sercowa oznaczana metodą wysokoczułą
W diagnostyce NSTE-ACS zasadniczą rolę odgrywają troponiny sercowe I oraz T oznaczane metodą wysokoczułą. Należy jednak pamiętać, że ich poziom może wzrastać w innych stanach związanych z uszkodzeniem kardiomiocytów niż ostry zawał mięśnia sercowego typu 1 (tab. 2).

Algorytmy szybkiego wykluczenia i potwierdzenia NSTE-ACS
W diagnostyce NSTE-ACS zaleca się stosowanie algorytmu 0 h/1 h (pobranie krwi wyjściowo i po 1 h) lub algorytmu 0 h/2 h (pobranie krwi wyjściowo i po 2 h) (ryc. 1). Algorytmy ESC 0 h/1 h i 0 h/2 h odnoszą się do wszystkich pacjentów, niezależnie od czasu upływającego od początku bólu w klatce piersiowej. Należy rozważyć wykonanie dodatkowego oznaczenia stężenia troponin sercowych po 3 h u chorych zgłaszających się w czasie poniżej 1 h od początku bólu i zakwalifikowanych do grupy „wykluczenia”. Algorytmy powinno się stosować wyłącznie w powiązaniu ze wszystkimi dostępnymi danymi klinicznymi, z uwzględnieniem szczegółowej oceny klinicznej oraz EKG.
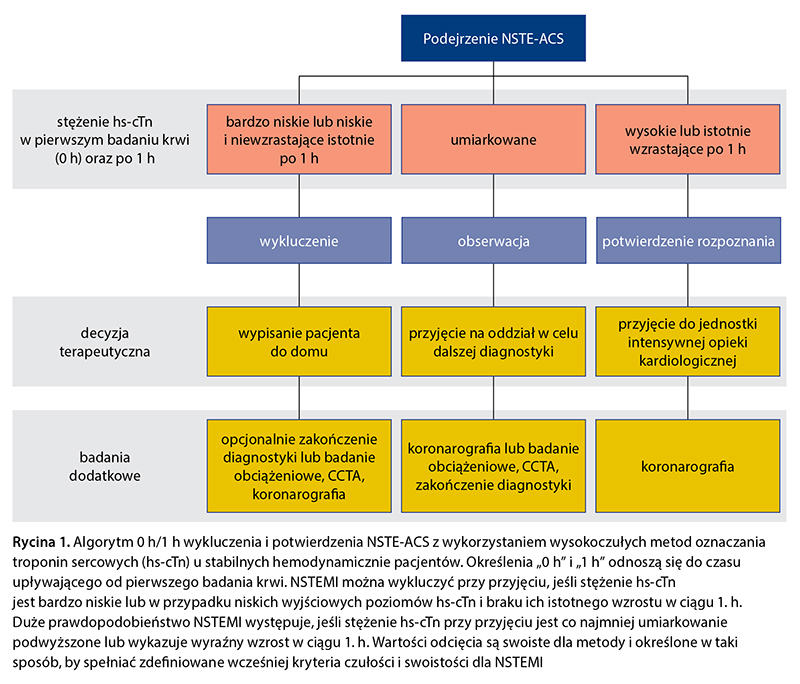
Obserwacja
Pacjenci, którzy nie zostali zakwalifikowani do kategorii „potwierdzenia” ani „wykluczenia” zawału serca, wymagają obserwacji. Zalecane jest trzecie oznaczenie troponiny sercowej po 3 h i wykonanie echokardiografii. Koronarografię należy rozważyć u pacjentów z wysoce prawdopodobnym podejrzeniem klinicznym NSTE-ACS (np. ze znaczącym wzrostem poziomu troponin sercowych w okresie od przyjęcia do 3. h). Obrazową diagnostykę nieinwazyjną lub badania obciążeniowe [echokardiografia obciążeniowa, pozytonowa tomografia emisyjna (PET), tomografia emisyjna pojedynczego fotonu (SPECT), rezonans magnetyczny (CMR)] w ramach dalszej diagnostyki szpitalnej zaleca się u pacjentów z małym lub pośrednim prawdopodobieństwem NSTE-ACS. U chorych, u których zdiagnozowano alternatywne przyczyny wzrostu stężenia troponin sercowych w postaci wysokiej częstości rytmu komór w przebiegu migotania przedsionków (atrial fibrillation – AF) lub stanu nagłego w nadciśnieniu tętniczym, nie zaleca się dalszych badań diagnostycznych.
Obrazowanie nieinwazyjne
Obrazowanie nieinwazyjne obejmuje ocenę czynnościową i anatomiczną:
1) ocena czynnościowa:
• echokardiografia przezklatkowa – u wszystkich pacjentów podczas hospitalizacji z powodu NSTE-ACS, • obrazowanie obciążeniowe – u pacjentów bez zmian niedokrwiennych w 12-odprowadzeniowym EKG i z prawidłowym stężeniem hs-cTn, u których bóle w klatce piersiowej nie nawracają przez kilka godzin,
• CMR – ocena perfuzji i zaburzeń kurczliwości, ocena tkanki bliznowatej i jej różnicowanie z niedawno przebytym zawałem serca, różnicowanie m.in.: zawału serca, zapalenia mięśnia sercowego lub kardiomiopatii takotsubo,
• SPECT – ocena perfuzji mięśnia sercowego;
2) ocena anatomiczna:
• CCTA wykazuje dużą negatywną wartość predykcyjną w odniesieniu do wykluczenia ostrego zespołu wieńcowego.
Obrazowanie obciążeniowe jest preferowane w stosunku do wysiłkowego EKG ze względu na większą dokładność diagnostyczną oraz wartość prognostyczną.
Rozpoznanie różnicowe (tab. 3)
W diagnostyce różnicowej NSTE-ACS zawsze powinno się uwzględnić:
• rozwarstwienie aorty,
• zatorowość płucną,
• odmę opłucnową prężną.
Echokardiografię przezklatkową należy wykonać u wszystkich pacjentów po zatrzymaniu krążenia oraz z niestabilnością hemodynamiczną, która może wynikać z przyczyn sercowo-naczyniowych, niezwłocznie po badaniu EKG.

Farmakoterapia
Leki przeciwpłytkowe i podwójna terapia przeciwpłytkowa
Zalecany standard leczenia u pacjentów z NSTE-ACS stanowi podwójna terapia przeciwpłytkowa (dual antiplatelet therapy – DAPT) obejmująca kwas acetylosalicylowy (acetylsalicylic acid – ASA) i silny inhibitor receptora P2Y12 (tikagrelor lub prasugrel). Klopidogrel, który charakteryzuje się słabszym i zmiennym hamowaniem płytek, zalecany jest jedynie w razie przeciwwskazań do leczenia prasugrelem bądź tikagrelorem, niedostępności tych leków lub ich złej tolerancji ze względu na nieakceptowalnie wysokie ryzyko krwawienia.
Wstępne leczenie przeciwpłytkowe
Nie zaleca się rutynowego wstępnego podawania inhibitora receptora P2Y12 u pacjentów z NSTE-ACS oraz nieznaną anatomią tętnic wieńcowych i zaplanowanym wczesnym postępowaniem inwazyjnym. Strategia rutynowego nasycenia silnymi inhibitorami receptora P2Y12 (tikagrelorem lub prasugrelem) zwiększa ryzyko powikłań krwotocznych u pacjentów z rozpoznaniem innym niż NSTE-ACS (np. z rozwarstwieniem aorty lub powikłaniami krwotocznymi obejmującymi krwawienie wewnątrzczaszkowe). Ponadto może spowodować zwiększenie ryzyka krwawienia lub opóźnienie zabiegu bezpośredniej rewaskularyzacji mięśnia sercowego (CABG) po diagnostycznej angiografii.
Leczenie po interwencji i terapia przeciwpłytkowa
U chorych z NSTE-ACS poddanych PCI zaleca się stosowanie DAPT (inhibitor P2Y12 i ASA) przez 12 miesięcy, o ile nie ma przeciwwskazań w postaci zbyt dużego ryzyka krwawienia. W przypadku dużego ryzyka krwawienia (≥ 25 pkt w skali PRECISE-DAPT lub spełnione kryteria ARCHBR) powinno się rozważyć zaprzestanie terapii inhibitorem receptora P2Y12 po 3–6 miesiącach. U pacjentów obciążonych bardzo dużym ryzykiem krwawienia (przebyty epizod krwawienia w ostatnim miesiącu lub planowany zabieg chirurgiczny w niedługiej przyszłości, bez możliwości jego odroczenia) należy rozważyć terapię ASA i klopidogrelem przez 1 miesiąc. U chorych z dużym ryzykiem zdarzeń niedokrwiennych (tab. 4) i bez zwiększonego ryzyka poważnego lub zagrażającego życiu krwawienia należy rozważyć dołączenie kolejnego leku przeciwzakrzepowego (rywaroksaban 2,5 mg 2 razy na dobę przez ok. rok) do ASA w ramach rozszerzonej długoterminowej prewencji wtórnej po okresie 12 miesięcy. W przypadku umiarkowanego ryzyka zdarzeń niedokrwiennych (tab. 4) bez zwiększonego ryzyka poważnego lub zagrażającego życiu krwawienia można rozważyć dołączenie kolejnego leku przeciwzakrzepowego (rywaroksaban 2,5 mg 2 razy na dobę przez ok. rok) do ASA w ramach rozszerzonej długoterminowej prewencji wtórnej po okresie 12 miesięcy. Zgodnie z zaleceniami, pacjentów z chorobą wieńcową przyporządkowuje się do grupy dużego lub umiarkowanego ryzyka incydentów niedokrwiennych. W tabeli 4 przedstawiono kryteria kwalifikujące do poszczególnych grup. Leczenie przeciwzakrzepowe u pacjentów z NSTE-ACS i migotaniem przedsionków poddanych PCI W doustnym leczeniu przeciwkrzepliwym NOAC są preferowane względem VKA przy braku przeciwwskazań. W ramach schematów TAT, a także DAPT, zaleca się następujące dawki NOAC: apiksaban 5 mg 2 razy na dobę, dabigatran 110 mg lub 150 mg 2 razy na dobę, edoksaban 60 mg na dobę, rywaroksaban 15 mg lub 20 mg na dobę.
Redukcję dawki NOAC zaleca się u pacjentów z niewydolnością nerek, a można rozważyć u chorych z dużym ryzykiem krwawienia. Tikagrelor można wziąć pod uwagę u pacjentów z dużym ryzykiem zdarzeń niedokrwiennych i z małym ryzykiem krwawienia. Leczenie powyżej 1 miesiąca złożone z OAC + DAPT (TAT) można rozważyć (do 6 miesięcy) u wybranych chorych z dużym ryzykiem zdarzeń niedokrwiennych (IIa C). Leczenie powyżej 12 miesięcy złożone z OAC + SAPT – u wybranych pacjentów z dużym ryzykiem zdarzeń niedokrwiennych.


Leczenie inwazyjne
Na podstawie ocenionego ryzyka zgonu pacjent z podejrzeniem NSTE-ACS powinien zostać poddany leczeniu inwazyjnemu w określonych ramach czasowych:
1) natychmiastowa strategia inwazyjna (< 2 h) zalecana u pacjentów spełniających co najmniej jedno z następujących kryteriów bardzo dużego ryzyka:
• niestabilność hemodynamiczna lub wstrząs kardiogenny,
• nawracający lub utrzymujący się mimo leczenia ból w klatce piersiowej,
• zagrażające życiu arytmie,
• mechaniczne powikłania zawału serca,
• niewydolność serca jednoznacznie powiązana z NSTE-ACS,
• obniżenie odcinka ST > 1 mm w ≥ 6 odprowadzeniach towarzyszące uniesieniu odcinka ST w aVR i/lub V1;
2) wczesna strategia inwazyjna (w ciągu 24 h) zalecana u pacjentów spełniających którekolwiek z następujących kryteriów dużego ryzyka:
• rozpoznanie NSTEMI sugerowane przez algorytm diagnostyczny,
• dynamiczne lub prawdopodobnie nowe zmiany odcinka ST-T w sąsiednich odprowadzeniach sugerujące utrzymujące się niedokrwienie,
• przemijające uniesienie odcinka ST,
• > 140 pkt w skali GRACE;
3) selektywna strategia inwazyjna po wykonaniu odpowiednich badań w kierunku niedokrwienia lub stwierdzeniu anatomicznie istotnych zwężeń w CCTA zalecana u pacjentów uznanych za obciążonych małym ryzykiem.
Farmakologiczne leczenie długoterminowe
Leki hipolipemizujące
Zaleca się stosowanie statyn u wszystkich pacjentów z NSTE-ACS w celu obniżenia poziomu cholesterolu LDL (LDL-C) o ≥ 50% w stosunku do wartości wyjściowej i uzyskania stężenia LDL-C < 1,4 mmol/l (< 55 mg/dl). W przypadku nieuzyskania docelowego poziomu LDL-C po 4–6 tygodniach stosowania statyn w maksymalnej tolerowanej dawce zaleca się ich połączenie z ezetymibem. Jeśli po 4–6 tygodniach stosowania takiego leczenia nadal nie udaje się uzyskać docelowego poziomu LDL-C, zaleca się dołączenie inhibitora PCSK9.
Jeśli obecny NSTE-ACS jest kolejnym takim epizodem w okresie krótszym niż 2 lata od pierwszego ostrego zespołu wieńcowego i wystąpił podczas stosowania maksymalnej tolerowanej terapii opartej na statynach, można rozważyć docelowe stężenie LDL-C < 1,0 mmol/l (< 40 mg/dl). Inhibitory konwertazy angiotensyny lub sartany Stosowanie ACEI (lub sartanów w przypadkach nietolerancji ACEI) zaleca się u pacjentów z niewydolnością serca z obniżoną LVEF (< 40%), cukrzycą lub CKD, o ile nie ma przeciwwskazań (ciężkiej niewydolności nerek, hiperkaliemii itd.) w celu redukcji śmiertelności ogólnej i sercowo-naczyniowej oraz chorobowości sercowo-naczyniowej.
β-adrenolityki
Zaleca się podawanie β-adrenolityków pacjentom ze skurczową dysfunkcją LV lub niewydolnością serca z obniżoną LVEF (< 40%). U osób po przebytym zawale serca należy rozważyć długoterminowe doustne leczenie β-adrenolitykiem w celu redukcji śmiertelności ogólnej i sercowo-naczyniowej oraz chorobowości sercowo-naczyniowej.
Antagonista receptora mineralokortykoidowego
Stosowanie antagonisty receptora mineralokortykoidowego (MRA) zaleca się u pacjentów z niewydolnością serca z obniżoną LVEF (< 40%) w celu redukcji śmiertelności ogólnej i sercowo-naczyniowej oraz chorobowości sercowo-naczyniowej.
Inhibitory pompy protonowej
Inhibitory pompy protonowej są zalecane u pacjentów przyjmujących ASA w monoterapii, DAPT, DAT, TAT lub OAC w monoterapii, obciążonych dużym ryzykiem krwawienia z przewodu pokarmowego w celu redukcji ryzyka krwawień z żołądka.
Piśmiennictwo
1. Puymirat E, Simon T, Cayla G i wsp.; USIK, USIC 2000, and FASTMI investigators. Acute myocardial infarction: changes in patient characteristics, management, and 6month outcomes over a period of 20 years in the FASTMI program (French Registry of Acute ST-Elevation or Non-ST-Elevation Myocardial Infarction) 1995 to 2015. Circulation 2017; 136: 1908–1919.
2. Ibanez B, James S, Agewall S i wsp.; ESC Scientific Document Group. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-egment elevation: the Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2018; 39: 119-177.
3. Twerenbold R, Badertscher P, Boeddinghaus J i wsp. 0/1-hour triage algorithm for myocardial infarction in patients with renal dysfunction. Circulation 2018; 137: 436–451.
Zaobserwowano również wyraźny wzrost częstości wykonywania wczesnej koronarografii u pacjentów z zawałem serca bez uniesienia odcinka ST (nonSTsegment elevation myocardial infarction – NSTEMI) (≤ 72 h od przyjęcia) – z 9% w 1995 r. do 60% w 2010 r., oraz przezskórnej rewaskularyzacji mięśnia sercowego w trakcie pierwszego pobytu w szpitalu – z 12,5% do 67%. Dzięki tym zmianom zredukowano 6-miesięczną śmiertelność z 17,2% do 6,3% [1]. Rozpoznanie ostrego zawału mięśnia sercowego (acute myocardial infarction – AMI) wymaga spełnienia następujących kryteriów:
1) wzrost i/lub spadek poziomu biomarkera sercowego [preferencyjnie troponiny sercowej oznaczanej metodą wysokoczułą (hs-cTn) T lub I] z ≥ 1 wartością > 99. percentyla górnej granicy zakresu wartości referencyjnych oraz
2) co najmniej jedno z poniższych:
• objawy niedokrwienia mięśnia sercowego,
• nowe zmiany niedokrwienne w EKG,
• pojawienie się patologicznych załamków Q w EKG,
• dowody w badaniach obrazowych na utratę żywotnego miokardium lub nowe regionalne nieprawidłowości kurczliwości ścian o wzorcu odpowiadającym etiologii niedokrwiennej,
• skrzeplina w tętnicy wieńcowej zidentyfikowana w angiografii lub badaniu sekcyjnym. W zależności od patogenezy rozróżnia się pięć typów zawału mięśnia sercowego (tab. 1).

Rozpoznanie
Rozpoznanie NSTEMI ustala się na podstawie obrazu klinicznego. Wśród NSTE-ACS wyróżniono kilka postaci klinicznych:
• przedłużony (> 20 min) ból dławicowy w spoczynku,
• świeża (de novo) dławica piersiowa (II lub III klasa wg Canadian Cardiovascular Society – CCS),
• świeża destabilizacja uprzednio stabilnej dławicy piersiowej z nasileniem do co najmniej III klasy CCS (dławica crescendo),
• dławica pozawałowa.
Typowa dławica piersiowa charakteryzuje się bólem zamostkowym, uczuciem ucisku lub ciężkości (angina) promieniującym do lewego ramienia, obu rąk, prawego ramienia, szyi lub szczęki, które może być przerywane (zwykle trwa kilka minut) lub uporczywe [2]. Mogą wystąpić dodatkowe objawy, takie jak pocenie się, nudności, ból w nadbrzuszu, duszność i omdlenie. Nietypowe objawy obejmują izolowany ból w nadbrzuszu, dolegliwości podobne do niestrawności oraz izolowaną duszność lub zmęczenie. Nietypowe symptomy częściej obserwuje się u osób starszych, u kobiet oraz u chorych na cukrzycę, przewlekłą chorobę nerek czy otępienie [3]. Zaostrzenie objawów pod wpływem wysiłku fizycznego i ich ustąpienie w spoczynku lub po podaniu azotanów zwiększa prawdopodobieństwo wystąpienia niedokrwienia mięśnia sercowego. Do stanów, które mogą zaostrzyć lub przyspieszyć NSTE-ACS, zalicza się anemię, infekcję, stan zapalny, gorączkę, przełom nadciśnieniowy, stres emocjonalny oraz zaburzenia metaboliczne lub endokrynologiczne (szczególnie tarczycy).
Narzędzia diagnostyczne
Elektrokardiogram
Zaleca się wykonanie spoczynkowego 12-odprowadzeniowego EKG w ciągu 10 min od przybycia pacjenta na oddział ratunkowy lub przy pierwszym kontakcie z medycznymi służbami ratowniczymi w warunkach przedszpitalnych z natychmiastową interpretacją przez wykwalifikowanego lekarza. Zapis EKG w przypadku NSTE-ACS może być prawidłowy, jednakże charakterystyczne nieprawidłowości obejmują:
• obniżenie odcinka ST,
• przemijające uniesienie odcinka ST,
• zmiany załamka T.
W razie wątpliwości wskazane jest wykonanie zapisu z odprowadzeń V7–V9, a w razie podejrzenia zawału prawej komory zapisu z odprowadzeń prawokomorowych V3R i V4R. Chorych z objawami niedokrwienia mięśnia sercowego i blokiem lewej odnogi pęczka Hisa (left bundle branch block – LBBB) leczy się jak pacjentów z zawałem serca z uniesieniem odcinka ST (STsegment elevation myocardial infarction – STEMI), niezależnie od wcześniejszego występowania lub nieobecności LBBB. Uniesienie odcinka ST u pacjentów z blokiem prawej odnogi pęczka Hisa (right bundle branch block – RBBB) wskazuje na STEMI. Obniżenie odcinka ST w odprowadzeniu I, aVL i V5–V6 wskazuje na rozpoznanie NSTE-ACS.
Biomarkery – troponina sercowa oznaczana metodą wysokoczułą
W diagnostyce NSTE-ACS zasadniczą rolę odgrywają troponiny sercowe I oraz T oznaczane metodą wysokoczułą. Należy jednak pamiętać, że ich poziom może wzrastać w innych stanach związanych z uszkodzeniem kardiomiocytów niż ostry zawał mięśnia sercowego typu 1 (tab. 2).

Algorytmy szybkiego wykluczenia i potwierdzenia NSTE-ACS
W diagnostyce NSTE-ACS zaleca się stosowanie algorytmu 0 h/1 h (pobranie krwi wyjściowo i po 1 h) lub algorytmu 0 h/2 h (pobranie krwi wyjściowo i po 2 h) (ryc. 1). Algorytmy ESC 0 h/1 h i 0 h/2 h odnoszą się do wszystkich pacjentów, niezależnie od czasu upływającego od początku bólu w klatce piersiowej. Należy rozważyć wykonanie dodatkowego oznaczenia stężenia troponin sercowych po 3 h u chorych zgłaszających się w czasie poniżej 1 h od początku bólu i zakwalifikowanych do grupy „wykluczenia”. Algorytmy powinno się stosować wyłącznie w powiązaniu ze wszystkimi dostępnymi danymi klinicznymi, z uwzględnieniem szczegółowej oceny klinicznej oraz EKG.

Obserwacja
Pacjenci, którzy nie zostali zakwalifikowani do kategorii „potwierdzenia” ani „wykluczenia” zawału serca, wymagają obserwacji. Zalecane jest trzecie oznaczenie troponiny sercowej po 3 h i wykonanie echokardiografii. Koronarografię należy rozważyć u pacjentów z wysoce prawdopodobnym podejrzeniem klinicznym NSTE-ACS (np. ze znaczącym wzrostem poziomu troponin sercowych w okresie od przyjęcia do 3. h). Obrazową diagnostykę nieinwazyjną lub badania obciążeniowe [echokardiografia obciążeniowa, pozytonowa tomografia emisyjna (PET), tomografia emisyjna pojedynczego fotonu (SPECT), rezonans magnetyczny (CMR)] w ramach dalszej diagnostyki szpitalnej zaleca się u pacjentów z małym lub pośrednim prawdopodobieństwem NSTE-ACS. U chorych, u których zdiagnozowano alternatywne przyczyny wzrostu stężenia troponin sercowych w postaci wysokiej częstości rytmu komór w przebiegu migotania przedsionków (atrial fibrillation – AF) lub stanu nagłego w nadciśnieniu tętniczym, nie zaleca się dalszych badań diagnostycznych.
Obrazowanie nieinwazyjne
Obrazowanie nieinwazyjne obejmuje ocenę czynnościową i anatomiczną:
1) ocena czynnościowa:
• echokardiografia przezklatkowa – u wszystkich pacjentów podczas hospitalizacji z powodu NSTE-ACS, • obrazowanie obciążeniowe – u pacjentów bez zmian niedokrwiennych w 12-odprowadzeniowym EKG i z prawidłowym stężeniem hs-cTn, u których bóle w klatce piersiowej nie nawracają przez kilka godzin,
• CMR – ocena perfuzji i zaburzeń kurczliwości, ocena tkanki bliznowatej i jej różnicowanie z niedawno przebytym zawałem serca, różnicowanie m.in.: zawału serca, zapalenia mięśnia sercowego lub kardiomiopatii takotsubo,
• SPECT – ocena perfuzji mięśnia sercowego;
2) ocena anatomiczna:
• CCTA wykazuje dużą negatywną wartość predykcyjną w odniesieniu do wykluczenia ostrego zespołu wieńcowego.
Obrazowanie obciążeniowe jest preferowane w stosunku do wysiłkowego EKG ze względu na większą dokładność diagnostyczną oraz wartość prognostyczną.
Rozpoznanie różnicowe (tab. 3)
W diagnostyce różnicowej NSTE-ACS zawsze powinno się uwzględnić:
• rozwarstwienie aorty,
• zatorowość płucną,
• odmę opłucnową prężną.
Echokardiografię przezklatkową należy wykonać u wszystkich pacjentów po zatrzymaniu krążenia oraz z niestabilnością hemodynamiczną, która może wynikać z przyczyn sercowo-naczyniowych, niezwłocznie po badaniu EKG.

Farmakoterapia
Leki przeciwpłytkowe i podwójna terapia przeciwpłytkowa
Zalecany standard leczenia u pacjentów z NSTE-ACS stanowi podwójna terapia przeciwpłytkowa (dual antiplatelet therapy – DAPT) obejmująca kwas acetylosalicylowy (acetylsalicylic acid – ASA) i silny inhibitor receptora P2Y12 (tikagrelor lub prasugrel). Klopidogrel, który charakteryzuje się słabszym i zmiennym hamowaniem płytek, zalecany jest jedynie w razie przeciwwskazań do leczenia prasugrelem bądź tikagrelorem, niedostępności tych leków lub ich złej tolerancji ze względu na nieakceptowalnie wysokie ryzyko krwawienia.
Wstępne leczenie przeciwpłytkowe
Nie zaleca się rutynowego wstępnego podawania inhibitora receptora P2Y12 u pacjentów z NSTE-ACS oraz nieznaną anatomią tętnic wieńcowych i zaplanowanym wczesnym postępowaniem inwazyjnym. Strategia rutynowego nasycenia silnymi inhibitorami receptora P2Y12 (tikagrelorem lub prasugrelem) zwiększa ryzyko powikłań krwotocznych u pacjentów z rozpoznaniem innym niż NSTE-ACS (np. z rozwarstwieniem aorty lub powikłaniami krwotocznymi obejmującymi krwawienie wewnątrzczaszkowe). Ponadto może spowodować zwiększenie ryzyka krwawienia lub opóźnienie zabiegu bezpośredniej rewaskularyzacji mięśnia sercowego (CABG) po diagnostycznej angiografii.
Leczenie po interwencji i terapia przeciwpłytkowa
U chorych z NSTE-ACS poddanych PCI zaleca się stosowanie DAPT (inhibitor P2Y12 i ASA) przez 12 miesięcy, o ile nie ma przeciwwskazań w postaci zbyt dużego ryzyka krwawienia. W przypadku dużego ryzyka krwawienia (≥ 25 pkt w skali PRECISE-DAPT lub spełnione kryteria ARCHBR) powinno się rozważyć zaprzestanie terapii inhibitorem receptora P2Y12 po 3–6 miesiącach. U pacjentów obciążonych bardzo dużym ryzykiem krwawienia (przebyty epizod krwawienia w ostatnim miesiącu lub planowany zabieg chirurgiczny w niedługiej przyszłości, bez możliwości jego odroczenia) należy rozważyć terapię ASA i klopidogrelem przez 1 miesiąc. U chorych z dużym ryzykiem zdarzeń niedokrwiennych (tab. 4) i bez zwiększonego ryzyka poważnego lub zagrażającego życiu krwawienia należy rozważyć dołączenie kolejnego leku przeciwzakrzepowego (rywaroksaban 2,5 mg 2 razy na dobę przez ok. rok) do ASA w ramach rozszerzonej długoterminowej prewencji wtórnej po okresie 12 miesięcy. W przypadku umiarkowanego ryzyka zdarzeń niedokrwiennych (tab. 4) bez zwiększonego ryzyka poważnego lub zagrażającego życiu krwawienia można rozważyć dołączenie kolejnego leku przeciwzakrzepowego (rywaroksaban 2,5 mg 2 razy na dobę przez ok. rok) do ASA w ramach rozszerzonej długoterminowej prewencji wtórnej po okresie 12 miesięcy. Zgodnie z zaleceniami, pacjentów z chorobą wieńcową przyporządkowuje się do grupy dużego lub umiarkowanego ryzyka incydentów niedokrwiennych. W tabeli 4 przedstawiono kryteria kwalifikujące do poszczególnych grup. Leczenie przeciwzakrzepowe u pacjentów z NSTE-ACS i migotaniem przedsionków poddanych PCI W doustnym leczeniu przeciwkrzepliwym NOAC są preferowane względem VKA przy braku przeciwwskazań. W ramach schematów TAT, a także DAPT, zaleca się następujące dawki NOAC: apiksaban 5 mg 2 razy na dobę, dabigatran 110 mg lub 150 mg 2 razy na dobę, edoksaban 60 mg na dobę, rywaroksaban 15 mg lub 20 mg na dobę.
Redukcję dawki NOAC zaleca się u pacjentów z niewydolnością nerek, a można rozważyć u chorych z dużym ryzykiem krwawienia. Tikagrelor można wziąć pod uwagę u pacjentów z dużym ryzykiem zdarzeń niedokrwiennych i z małym ryzykiem krwawienia. Leczenie powyżej 1 miesiąca złożone z OAC + DAPT (TAT) można rozważyć (do 6 miesięcy) u wybranych chorych z dużym ryzykiem zdarzeń niedokrwiennych (IIa C). Leczenie powyżej 12 miesięcy złożone z OAC + SAPT – u wybranych pacjentów z dużym ryzykiem zdarzeń niedokrwiennych.


Leczenie inwazyjne
Na podstawie ocenionego ryzyka zgonu pacjent z podejrzeniem NSTE-ACS powinien zostać poddany leczeniu inwazyjnemu w określonych ramach czasowych:
1) natychmiastowa strategia inwazyjna (< 2 h) zalecana u pacjentów spełniających co najmniej jedno z następujących kryteriów bardzo dużego ryzyka:
• niestabilność hemodynamiczna lub wstrząs kardiogenny,
• nawracający lub utrzymujący się mimo leczenia ból w klatce piersiowej,
• zagrażające życiu arytmie,
• mechaniczne powikłania zawału serca,
• niewydolność serca jednoznacznie powiązana z NSTE-ACS,
• obniżenie odcinka ST > 1 mm w ≥ 6 odprowadzeniach towarzyszące uniesieniu odcinka ST w aVR i/lub V1;
2) wczesna strategia inwazyjna (w ciągu 24 h) zalecana u pacjentów spełniających którekolwiek z następujących kryteriów dużego ryzyka:
• rozpoznanie NSTEMI sugerowane przez algorytm diagnostyczny,
• dynamiczne lub prawdopodobnie nowe zmiany odcinka ST-T w sąsiednich odprowadzeniach sugerujące utrzymujące się niedokrwienie,
• przemijające uniesienie odcinka ST,
• > 140 pkt w skali GRACE;
3) selektywna strategia inwazyjna po wykonaniu odpowiednich badań w kierunku niedokrwienia lub stwierdzeniu anatomicznie istotnych zwężeń w CCTA zalecana u pacjentów uznanych za obciążonych małym ryzykiem.
Farmakologiczne leczenie długoterminowe
Leki hipolipemizujące
Zaleca się stosowanie statyn u wszystkich pacjentów z NSTE-ACS w celu obniżenia poziomu cholesterolu LDL (LDL-C) o ≥ 50% w stosunku do wartości wyjściowej i uzyskania stężenia LDL-C < 1,4 mmol/l (< 55 mg/dl). W przypadku nieuzyskania docelowego poziomu LDL-C po 4–6 tygodniach stosowania statyn w maksymalnej tolerowanej dawce zaleca się ich połączenie z ezetymibem. Jeśli po 4–6 tygodniach stosowania takiego leczenia nadal nie udaje się uzyskać docelowego poziomu LDL-C, zaleca się dołączenie inhibitora PCSK9.
Jeśli obecny NSTE-ACS jest kolejnym takim epizodem w okresie krótszym niż 2 lata od pierwszego ostrego zespołu wieńcowego i wystąpił podczas stosowania maksymalnej tolerowanej terapii opartej na statynach, można rozważyć docelowe stężenie LDL-C < 1,0 mmol/l (< 40 mg/dl). Inhibitory konwertazy angiotensyny lub sartany Stosowanie ACEI (lub sartanów w przypadkach nietolerancji ACEI) zaleca się u pacjentów z niewydolnością serca z obniżoną LVEF (< 40%), cukrzycą lub CKD, o ile nie ma przeciwwskazań (ciężkiej niewydolności nerek, hiperkaliemii itd.) w celu redukcji śmiertelności ogólnej i sercowo-naczyniowej oraz chorobowości sercowo-naczyniowej.
β-adrenolityki
Zaleca się podawanie β-adrenolityków pacjentom ze skurczową dysfunkcją LV lub niewydolnością serca z obniżoną LVEF (< 40%). U osób po przebytym zawale serca należy rozważyć długoterminowe doustne leczenie β-adrenolitykiem w celu redukcji śmiertelności ogólnej i sercowo-naczyniowej oraz chorobowości sercowo-naczyniowej.
Antagonista receptora mineralokortykoidowego
Stosowanie antagonisty receptora mineralokortykoidowego (MRA) zaleca się u pacjentów z niewydolnością serca z obniżoną LVEF (< 40%) w celu redukcji śmiertelności ogólnej i sercowo-naczyniowej oraz chorobowości sercowo-naczyniowej.
Inhibitory pompy protonowej
Inhibitory pompy protonowej są zalecane u pacjentów przyjmujących ASA w monoterapii, DAPT, DAT, TAT lub OAC w monoterapii, obciążonych dużym ryzykiem krwawienia z przewodu pokarmowego w celu redukcji ryzyka krwawień z żołądka.
Piśmiennictwo
1. Puymirat E, Simon T, Cayla G i wsp.; USIK, USIC 2000, and FASTMI investigators. Acute myocardial infarction: changes in patient characteristics, management, and 6month outcomes over a period of 20 years in the FASTMI program (French Registry of Acute ST-Elevation or Non-ST-Elevation Myocardial Infarction) 1995 to 2015. Circulation 2017; 136: 1908–1919.
2. Ibanez B, James S, Agewall S i wsp.; ESC Scientific Document Group. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-egment elevation: the Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2018; 39: 119-177.
3. Twerenbold R, Badertscher P, Boeddinghaus J i wsp. 0/1-hour triage algorithm for myocardial infarction in patients with renal dysfunction. Circulation 2018; 137: 436–451.
Źródło:
Lekarz POZ 6/2020 vol.6
Lekarz POZ 6/2020 vol.6




