Różnicowanie autoimmunologicznego zapalenia od nowotworu trzustki za pomocą metod diagnostyki obrazowej

Przebieg autoimmunologicznego zapalenia trzustki (AIP) i nowotworu trzustki (PC) może być bardzo podobny. Ostateczne rozpoznanie ustala się na podstawie obrazu klinicznego, wyników badań radiologicznych i histopatologicznych. Właściwe różnicowanie tych dwóch chorób pozwala uniknąć okaleczających pankreatektomii u pacjentów z AIP.
Autorzy: Katarzyna Nadolska, Agnieszka Białecka, Elżbieta Zawada, Bartosz Nadolski
Wprowadzenie
Nowotwór trzustki (pancreatic carcinoma – PC) znajduje się na 13. miejscu na liście najczęstszych nowotworów, jednak jest czwartą przyczyną śmierci z powodu nowotworu na świecie – powoduje ok. 4% zgonów z przyczyn onkologicznych. Częstość jego występowania i śmiertelność z roku na rok wzrastają. Ponadto w momencie rozpoznania u ok. 80% pacjentów choroba jest zaawansowana miejscowo lub występują przerzuty odległe. Rokowania w PC są złe, mediana czasu przeżycia wynosi ok. 4 miesiące, a u pacjentów z rozsianą chorobą ok. 2–3 miesiące [1].
Autoimmunologiczne zapalenie trzustki (autoimmune pancreatitis – AIP) jest rzadką chorobą, dokładna jego częstość jego występowania jest nieznana. Stanowi ok. 5–11% przypadków przewlekłego zapalenia trzustki. Obraz trzustki w trakcie AIP jest bardzo zmienny, często upodabnia się do PC. Przebieg AIP jest jednak odmienny. Leczenie steroidami powoduje regresję zmian morfologicznych i powrót do prawidłowego funkcjonowania trzustki. Remisję choroby udaje się uzyskać u 98% pacjentów. Może również dojść do samoograniczenia choroby, współczynnik spontanicznej remisji wynosi 74%.
Autoimmunologiczne zapalenie trzustki charakteryzuje się nawrotami, dotyczą one ok. 24% pacjentów leczonych steroidami i są jeszcze częstsze u osób nieleczonych.
W badaniach histopatologicznych po całkowitej pankreatektomii u pacjentów, u których mylnie podejrzewano PC, w 2,6% przypadków stwierdzano AIP. Powodem jest myląca manifestacja makroskopowa [2].
Opis przypadku
Pacjentka 41-letnia z rozpoznaną niedokrwistością, niedożywieniem (BMI 21), kamicą pęcherzyka żółciowego oraz przepukliną rozworu przełykowego została przyjęta do Kliniki Chirurgii Wątroby i Chirurgii Ogólnej w celu poszerzenia diagnostyki zmiany opisywanej we wcześniejszych badaniach w głowie trzustki.
Kobieta była uprzednio hospitalizowana w szpitalu powiatowym z powodu przewlekłych nudności, wymiotów i dolegliwości bólowych w nadbrzuszu. Wykonano gastroskopię, która wykazała na krzywiźnie większej żołądka groniastą, łatwo krwawiącą zmianę (po kontakcie z aparatem) z zaznaczoną granicą prawidłowej makroskopowo śluzówki. Przeprowadzono również badanie tomografii komputerowej jamy brzusznej z kontrastem, dzięki któremu zobrazowano powiększoną głowę trzustki o wymiarze 48 × 56 mm, o niejednorodnej strukturze, z obecnością w obrębie wyrostka haczykowatego hipodensyjnej zmiany wielkości 15 × 14 mm. Pozostała część trzustki otoczona naciekiem obejmującym również część zstępującą dwunastnicy i naczynia krezkowe górne. W obrębie nacieku opisano liczne węzły chłonne w osi krótkiej do 10 mm (ryc. 1).

Sprawdzono markery nowotworowe: CEA 3,37 ng/ml, CA 125 6,3 U/ml i CA 19-9 39,11 U/ml (norma do 37 U/ml). Pacjentka z podejrzeniem guza głowy trzustki i choroby rozrostowej żołądka została skierowana na dalszą diagnostykę. Trafiła do Kliniki Chirurgii Wątroby i Chirurgii Ogólnej. Powtórzono badanie tomografii komputerowej jamy brzusznej z podaniem kontrastu dożylnie i zakontrastowaniem przewodu pokarmowego doustnie. Badanie potwierdziło, że głowa trzustki niejednorodnie się wzmacnia. Opisano dwa hipodensyjne obszary: w obrębie wyrostka haczykowatego 14 × 11 mm i przy ścianie dwunastnicy 11 × 5 mm. Wokół zmienionej głowy trzustki stwierdzono hipodensyjną zmianę przylegającą do dwunastnicy, wątroby, naczyń krezkowych górnych, żyły głównej górnej i żyły nerkowej lewej. Całość zmiany była wielkości 60 × 65 × 66 mm, w jej obrębie znajdowały się liczne węzły chłonne w osi krótkiej długości do 10 mm (ryc. 2).

Wysnuto podejrzenie PC trzustki z naciekiem do zróżnicowania z zapaleniem trzustki okolicy bruzdy. Kolejne tomograficzne kontrolne badanie jamy brzusznej wykonane po 2 tygodniach nie wykazało różnicy w porównaniu z poprzednim obrazem. Pacjentkę przyjęto ponownie do Kliniki Chirurgii Wątroby i Chirurgii Ogólnej. Po przeprowadzeniu podstawowych badań zakwalifikowano ją do laparoskopii zwiadowczej w celu pobrania biopsji zmiany opisywanej w trzustce. Podczas zabiegu zaobserwowano guz przemieszczający i modelujący okolice odźwiernika i pierwszą część dwunastnicy. Po odpreparowaniu zrostów z miejsca największego uwypuklenia guza pobrano bioptat.
Badanie histopatologiczne nie wykazało utkania nowotworowego w dostarczonym materiale (,,W badaniu mikroskopowym widoczna tkanka łączna oraz fragment utkania gruczołowego trzustki”). Pacjentka w stanie dobrym wyszła ze szpitala. Po ok. 2 miesiącach trafiła na szpitalny oddział ratunkowy z powodu nasilenia dolegliwości bólowych w nadbrzuszu, wymiotów i nudności. Wykonano podstawowe badania: USG i RTG jamy brzusznej, dzięki którym wykluczono niedrożność oraz perforację przewodu pokarmowego. W wyniku USG opisano masę w głowie trzustki wielkości 5 cm, dwunastnicę z poszerzoną ścianą do 12 mm oraz liczne węzły chłonne w ich okolicy wielkości do 20 × 8 mm. Badania laboratoryjne wykazały podwyższone wykładniki stanu zapalnego (CRP 6,37 mg/l) oraz zwiększone wartości enzymów: amylaza 226 U/l, fosfataza alkaliczna 172 U/l, GGTP-323 U/l. Pacjentkę umówiono na planowe przyjęcie w celu kontroli zmiany w trzustce i oceny stanu odżywienia.
Kobieta ponownie została przyjęta do Kliniki Chirurgii Wątroby i Chirurgii Ogólnej. Tomografia komputerowa wykazała mierne poszerzenie przewodu żółciowego wspólnego do 9 mm, zaznaczone drogi wątrobowe, koncentryczne pogrubienie ścian dwunastnicy do 14 mm (cześć zstępująca i zagięcie dolne), dodatkowo pojawił się wąski zbiornik płynowy między głową trzustki i dwunastnicy. Poprzednio opisywana hipodensyjna zmiana okolicy głowy trzustki i dwunastnicy nie uległa ewolucji, nadal otaczała liczne naczynia, w jej okolicy znajdowało się wiele węzłów chłonnych, w osi krótkiej do 10 mm. Wykonano gastroskopię, która wykazała zapalenie błony śluzowej przełyku, żołądka i dwunastnicy, zakażenie Helicobacter pylori oraz niewydolność wpustu żołądka. Przeprowadzono pasaż przewodu pokarmowego po doustnym podaniu środka kontrastowego (Ultravist). Podczas badania na poziomie wstępnicy pojawiło się kilka poziomów płynu długości do 8 cm, co sugerowało subileus. W badaniach laboratoryjnych wykazano mierne podwyższenie wykładników stanu zapalnego. Powtórzono badanie markerów nowotworowych: CEA 4,26 ng/l, CA 19-9 72,6 U/ml (norma do 37 U/ml).
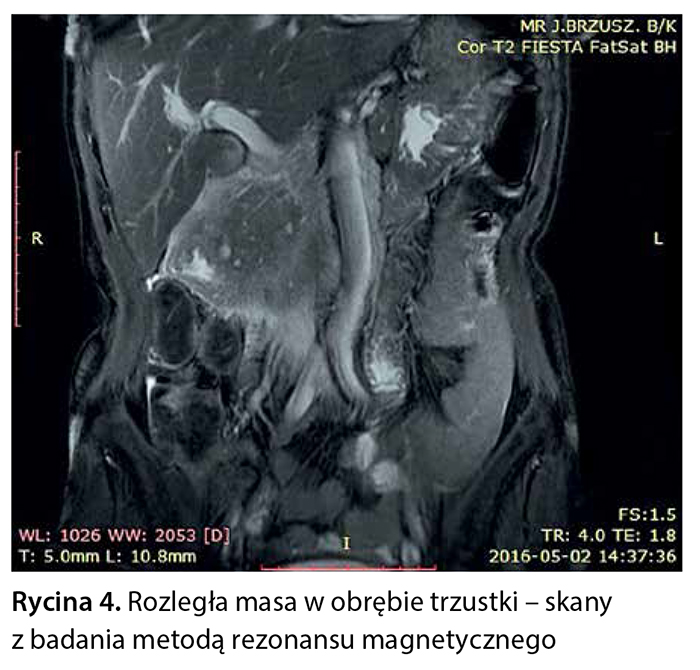
Z powodu niejednoznacznych wyników badań obrazowych pacjentce zaproponowano badanie metodą rezonansu magnetycznego z dożylnym podaniem środka kontrastowego (Gadovist) z zastosowaniem sekwencji FOCUS DWI do zobrazowania zmian w trzustce. W tym badaniu w obrębie głowy trzustki widoczna była niejednorodna masa wielkości 76 × 50 × 53 mm, w fazie T1 hipointensywna, ulegająca nieco słabszemu wzmocnieniu pokontrastowemu w porównaniu z pozostałym miąższem trzustki, wykazująca niejednorodne ograniczenie dyfuzji (ryc. 3–6).



Na podstawie obrazu klinicznego oraz wyników badań dodatkowych wysunięto podejrzenie AIP. W efekcie zastosowanego leczenia dolegliwości bólowe oraz parametry stanu zapalnego uległy zmniejszeniu.
Pacjentka pozostaje pod stałą opieką Poradni Żywienia i Poradni Chirurgicznej, a w razie nasilenia dolegliwości bólowych zgłasza się na szpitalny oddział ratunkowy.
Dyskusja
Ścieżka diagnostyczna pacjenta z podejrzeniem nowotworu i zapalenia trzustki jest podobna. Różnice w wynikach przeprowadzonych badań często są niewielkie, dlatego należy je wnikliwie analizować, łącznie z obrazem klinicznym. Najczęstszym objawem klinicznym PC jest ból w nadbrzuszu, który może promieniować do pleców. W badaniach dodatkowych niekiedy stwierdza się powiększony, niebolesny pęcherzyk żółciowy (Courvoisier’s gallbladder), wędrujące zapalenie żył (Trousseau’s syndrome), cukrzycę de novo. U 10–15% pacjentów z PC mogą się pojawić objawy nadmiernego wytwarzania lipazy trzustkowej: bóle mięśniowe, martwica tkanki tłuszczowej, zmiany lityczne kości, przy podwyższonych wartościach lipazy i eozynofilii.
Objawy kliniczne AIP bywają bardzo zbliżone. Może pojawić się żółtaczka, spadek masy ciała, cukrzyca de novo. Silne dolegliwości bólowe i objawy ostrego zapalenia trzustki są rzadko spotykane [3]. Z powodu przewlekłego stanu zapalnego zdarzają się manifestacje pozatrzustkowe AIP związane z nacieczeniem limfocytarnym, tj. zapalenie jelit, dróg żółciowych, płuc, nerek, ślinianek, węzłów chłonnych. U 50% pacjentów z AIP stwierdza się podwyższone poziomy IgG i przeciwciał przeciwjądrowych. Dodatkowo może być zwiększony poziom markera nowotworowego CA 19-9.
Badanie USG w obu przypadkach może wykazać szereg nieprawidłowości: hipoechogeniczną masę w obrębie trzustki otoczoną przez obszar o podwyższonej echogeniczności – naciek zapalny lub odczyn desmoplastyczny tkanki tłuszczowej. W obrębie nacieku mogą się znajdować powiększone węzły chłonne. Zdarza się poszerzenie przewodu trzustkowego i dróg żółciowych. Może występować wodobrzusze. Te liczne objawy nie umożliwią jednak końcowego zróżnicowania obu tych stanów chorobowych.
Głównym narzędziem diagnostycznym stosowanym do oceny trzustki jest tomografia komputerowa, jednak w przypadku omawianych jednostek chorobowych może ona nie dać pewnej diagnozy. Zarówno w AIP, jak i w PC tomografia komputerowa może wykazać:
• słabo zróżnicowaną masę (rozlaną lub ogniskową) w obrębie trzustki,
• pogrubienie okolicznej tkanki tłuszczowej o zatartym zarysie – naciek zapalny lub odczyn desmoplastyczny,
• powiększone węzły chłonne okołotrzustkowe, powyżej 1 cm w osi krótkiej,
• jednoczesne poszerzenie przewodu trzustkowego i dróg żółciowych (double duct sign).
Bardziej typowe dla AIP są ogniskowe zmiany w obrębie trzustki ograniczone głównie do głowy i wyrostka haczykowatego. Na proces zapalny mogą również wskazywać pozatrzustkowe manifestacje AIP: pseudoguzy zapalne nerek – ogniska hipodensyjne, cechy włóknienia zaotrzewnowego z zajęciem okołoaortalnej tkanki tłuszczowej, wysięk opłucnowy.
Wzmocnienie pokontrastowe w AIP i PC wykazuje nieco odmienny wzorzec, jednak są to subtelne różnice, nie zawsze jednoznaczne.
W AIP obserwuje się obniżone wzmocnienie kontrastowe podczas fazy trzustkowej (40 s), ale bliskie normalnemu zakontrastowanie w fazie wrotnej (70 s). W PC natomiast w 75–90% przypadków zmiana jest hipodensyjna w fazie tętniczej, a na skanach opóźnionych może być izodensyjna.
Tomografia komputerowa odgrywa ważną rolę w zdiagnozowaniu zmian nieresekcyjnych w PC, gdyż daje dokładny obraz tętnic i żył. Dzięki temu badaniu udaje się makroskopowo prawidłowo określić zmiany nieresekcyjne w 89–100% przypadków. O nieresekcyjności świadczy otoczenie powyżej 180 stopni obwodu naczyń (tj. TC, SMA) przez nowotwór (stadium T4 zaawansowania).
Kolejnym badaniem, z którym obecnie wiąże się duże nadzieje, jest rezonans magnetyczny z dożylnym podaniem kontrastu (gadolin). Oba stany chorobowe będą się podobnie prezentowały w fazie T1 jako hipointensywne zmiany względem normalnej trzustki. Po podaniu gadolinu donaczyniowo w obu przypadkach zmienione chorobowo fragmenty miąższu wykażą wolniejsze wzmocnienie od prawidłowej trzustki. Dlatego satysfakcjonujące bywają obrazy w fazie tętniczej po dynamicznym podaniu środka kontrastującego, z opcją wygaszenia tłuszczu.
Istnieją doniesienia, że w badaniach dyfuzyjnych MR (DWI) wyniki pomiaru współczynnika ADC (apparent diffusion coefficient) mogą być charakterystyczne dla prawidłowego miąższu trzustki, zmian zapalnych i nowotworu trzustki. Powstały prace, w których analizowano mapy współczynnika ADC uzyskane na podstawie pomiarów współczynnika dyfuzji (ADC 10, 30, 50, 100) z ograniczonych obszarów normalnego, zmienionego zapalnie i zmienionego nowotworowo miąższu trzustki (w fazie T1 rezonansu magnetycznego z wygaszeniem tłuszczu i FRFSE-FS). Zaobserwowano, że normalny miąższ trzustki wykazuje jednorodną intensywność sygnału w DWI, co odpowiada jednolitemu kolorowi na mapie ADC badanego obszaru. Intensywność sygnału obszarów zmienionych zapalnie lub nowotworowo w trzustce jest natomiast niejednorodna, z mieszanymi kolorami na mapach ADC [4]. Wynika to z patologicznego charakteru zmian zapalnych oraz nowotworowych trzustki i jest wytłumaczalne na poziomie mikroskopowym. Zmiany zapalne charakteryzują się naciekiem z komórek limfatycznych, destrukcją miąższu trzustki i przewlekłym włóknieniem. Nowotworzenie trzustki jest związane z pojawieniem się komórek nowotworowych i intensywnym włóknieniem, zwanym reakcją desmoplastyczną. Włóknienie jest więc wspólną cechą AIP i PC. Z badań naukowych wynika, że włóknienie może ograniczać dyfuzję wody, co skutkuje obniżeniem wartości współczynnika ADC [4]. W związku z tym zarówno obszary AIP, jak i PC charakteryzują się rozlanym ograniczeniem dyfuzji z wyższym sygnałem DWI i niższymi wartościami pomiaru współczynnika dyfuzji ADC w porównaniu ze zdrowym miąższem trzustki. Zaobserwowano, że obniżenie wartości współczynnika ADC w AIP jest mniejsze niż w PC. Z tą cechą wiązane są duże nadzieje dotyczące ostatecznego różnicowania AIP i PC na podstawie wskaźnika ADC. Nadal jednak nie zostały dokładnie określone zakresy wskaźnika ADC dla obu tych stanów chorobowych – zagadnienie to znajduje się w fazie badań klinicznych. W różnych pracach podawane są inne charakterystyczne wartości pomiarów ADC, co może być spowodowane różnymi sposobami jego pomiaru, m.in. wielkością ROI (region of interest), z którego tworzone są mapy ADC. Być może pomogłaby jej standaryzacja. Kamisawa i wsp. uważają za optymalną wartość różnicującą AIP i PC współczynnika dyfuzji 1,075 × 10–3 mm2/s [5].
Kolejnym badaniem, które miałoby końcowo różnicować oba stany chorobowe, jest biopsja zmienionego miąższu trzustki. Wykonuje się ją przed podjęciem decyzji o przeprowadzeniu zabiegu chirurgicznego oraz przed proponowanym leczeniem (np. chemio- i radioterapią lub steroidoterapią). W niektórych przypadkach nawet wynik biopsji nie jest przekonujący. Często w pierwszym rzucie proponuje się pacjentowi biopsję podczas ultrasonografii endoskopowej (endoscopic ultrasound fine-needle aspiration – EUS-FNA). EUS jest uznawana za jedno z najbardziej czułych badań w wykrywaniu nowotworów głowy trzustki, zwłaszcza gdy zmiany są mniejsze niż 3 cm [6], jednak nie zawsze jest możliwa (np. z powodu utrudnionego dojścia do zmiany lub ryzyka uszkodzenia naczyń), a czasami nie dostarcza wystarczającej ilości materiału do postawienia diagnozy. Dlatego jeśli EUS-FNA nie jest wystarczająca, wykonuje się biopsję chirurgiczną zmienionych chorobowo fragmentów podczas laparoskopii [7]. Laparoskopia jest bardziej czuła od innych technik w wykrywaniu przerzutów nowotworowych do otrzewnej lub powierzchownych przerzutów do wątroby.
Wnioski
Rozpoznanie AIP jest wyzwaniem dla każdego klinicysty. Opracowano liczne kryteria diagnostyczne, by ułatwić rozpoznawanie AIP, np. klasyfikacja ASIAN z 2008 r., klasyfikacja MAYO z 2006 r. Różnią się one doborem badań dodatkowych wynikającym z odmiennych preferencji badaczy. W 2010 r. na 14th Congress of the International Association of Pancreatology grupa robocza ujednoliciła wcześniejsze ustalenia i sformułowała następujące kryteria diagnostyczne AIP:
• charakterystyczne cechy w badaniach obrazowych (dla miąższu trzustki w tomografii komputerowej lub rezonansie magnetycznym, dla przewodów żółciowych we wstecznej cholangiopankreatografii endoskopowej lub w cholangiografii rezonansu magnetycznego),
• badania serologiczne (IgG, IgG4, przeciwciała przeciwjądrowe),
• zajęcie innych narządów,
• histopatologia trzustki,
• odpowiedź na steroidoterapię [8].
Pacjent powinien spełniać jedno lub więcej z wymienionych powyżej kryteriów.
W przypadku kryterium badań obrazowych i trudności w odróżnieniu AIP od PC zasugerowano następujące postępowanie:
• gdy w badaniach obrazowych mamy do czynienia z rozlanym powiększeniem trzustki bez cech masy i poszerzenia przewodu żółciowego, gdy nie ma innych dodatkowych dowodów w badaniach przemawiających za PC, sugeruje się rozpoznanie AIP,
• gdy w badaniach obrazowych widoczne są cechy silnie przemawiające za PC, tj. hipodensyjna masa, poszerzenie przewodu trzustkowego lub jego nagłe zwężenie, przy braku cech przemawiających za AIP należy rozpoznać PC,
• przypadki, w których nie można jednoznacznie opowiedzieć się za AIP ani PC, należy traktować jak PC [8].
U opisywanej pacjentki wyniki badań obrazowych nie dawały jasnej odpowiedzi, co uniemożliwia zaliczenie tego kryterium jako przemawiającego za AIP. Autorzy nie znają wyników badań serologicznych. Zdiagnozowano zapalenie dwunastnicy i żołądka, co możemy uznać za zajęcie innych narządów. Wyniki badania histopatologicznego trzustki przemawiały za AIP. Nie ma informacji dotyczących odpowiedzi na steroidoterapię. Można więc uznać, że pacjentka spełnia dwa z pięciu kryteriów, co przemawia za AIP. Za tym rozpoznaniem przemawia również długi czas obserwacji pacjentki – ponad 20 miesięcy.
Piśmiennictwo
1. Zhang Q, Zeng L, Chen Y i wsp. Pancreatic cancer epidemiology, detection, and management. Gastroenterol Res Pract 2016; 2016: 8962321.
2. van Heerde J, Biermann K, Zondervan P i wsp. Prevalence of autoimmune pancreatitis and other benign disorders in pancreatoduodenectomy for presumed malignancy of the pancreatic head. Dig Dis Sci 2012; 57: 2458-2465.
3. Luis P, Suresh T. Autoimmune pancreatitis. Curr Gastroenterol Rep 2005; 7: 101-106.
4. Ma X, Zhao X, Ouyang H i wsp. Quantified ADC histogram analysis: a new method for differentiating mass-forming focal pancreatitis from pancreatic cancer. Acta Radiol 2014; 55: 785-792.
5. Kamisawa T, Takuma K, Anjiki H i wsp. Differentiation of autoimmune pancreatitis from pancreatic cancer by diffusion-weighted MRI. Am J Gastroenterol 2010; 105: 1870-1875.
6. Horwhat J, Gerke H, Acosta R i wsp. Focal or diffuse “fullness” of the pancreas on CT. Usually benign, but EUS plus/minus FNA is warranted to identify malignancy. JOP 2009; 10: 37-42.
7. Toshiyama R, Noda T, Eguchi H i wsp. Two cases of resectable pancreatic cancer diagnosed by open surgical biopsy after endoscopic ultrasound fine-needle aspiration failed to yield diagnosis: case reports. Surg Case Rep 2017; 3: 39.
8. Tooru S, Suresh C, Luca F i wsp. International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the International Association of Pancreatology. Pancreas 2011; 40: 352-358.
Pełna treść artykułu:Katarzyna Nadolska, Agnieszka Białecka, Elżbieta Zawada, Bartosz Nadolski. Różnicowanie autoimmunologicznego zapalenia od nowotworu trzustki za pomocą metod diagnostyki obrazowej. Lekarz POZ 2021; 7 (6): 441-447.
Wprowadzenie
Nowotwór trzustki (pancreatic carcinoma – PC) znajduje się na 13. miejscu na liście najczęstszych nowotworów, jednak jest czwartą przyczyną śmierci z powodu nowotworu na świecie – powoduje ok. 4% zgonów z przyczyn onkologicznych. Częstość jego występowania i śmiertelność z roku na rok wzrastają. Ponadto w momencie rozpoznania u ok. 80% pacjentów choroba jest zaawansowana miejscowo lub występują przerzuty odległe. Rokowania w PC są złe, mediana czasu przeżycia wynosi ok. 4 miesiące, a u pacjentów z rozsianą chorobą ok. 2–3 miesiące [1].
Autoimmunologiczne zapalenie trzustki (autoimmune pancreatitis – AIP) jest rzadką chorobą, dokładna jego częstość jego występowania jest nieznana. Stanowi ok. 5–11% przypadków przewlekłego zapalenia trzustki. Obraz trzustki w trakcie AIP jest bardzo zmienny, często upodabnia się do PC. Przebieg AIP jest jednak odmienny. Leczenie steroidami powoduje regresję zmian morfologicznych i powrót do prawidłowego funkcjonowania trzustki. Remisję choroby udaje się uzyskać u 98% pacjentów. Może również dojść do samoograniczenia choroby, współczynnik spontanicznej remisji wynosi 74%.
Autoimmunologiczne zapalenie trzustki charakteryzuje się nawrotami, dotyczą one ok. 24% pacjentów leczonych steroidami i są jeszcze częstsze u osób nieleczonych.
W badaniach histopatologicznych po całkowitej pankreatektomii u pacjentów, u których mylnie podejrzewano PC, w 2,6% przypadków stwierdzano AIP. Powodem jest myląca manifestacja makroskopowa [2].
Opis przypadku
Pacjentka 41-letnia z rozpoznaną niedokrwistością, niedożywieniem (BMI 21), kamicą pęcherzyka żółciowego oraz przepukliną rozworu przełykowego została przyjęta do Kliniki Chirurgii Wątroby i Chirurgii Ogólnej w celu poszerzenia diagnostyki zmiany opisywanej we wcześniejszych badaniach w głowie trzustki.
Kobieta była uprzednio hospitalizowana w szpitalu powiatowym z powodu przewlekłych nudności, wymiotów i dolegliwości bólowych w nadbrzuszu. Wykonano gastroskopię, która wykazała na krzywiźnie większej żołądka groniastą, łatwo krwawiącą zmianę (po kontakcie z aparatem) z zaznaczoną granicą prawidłowej makroskopowo śluzówki. Przeprowadzono również badanie tomografii komputerowej jamy brzusznej z kontrastem, dzięki któremu zobrazowano powiększoną głowę trzustki o wymiarze 48 × 56 mm, o niejednorodnej strukturze, z obecnością w obrębie wyrostka haczykowatego hipodensyjnej zmiany wielkości 15 × 14 mm. Pozostała część trzustki otoczona naciekiem obejmującym również część zstępującą dwunastnicy i naczynia krezkowe górne. W obrębie nacieku opisano liczne węzły chłonne w osi krótkiej do 10 mm (ryc. 1).

Sprawdzono markery nowotworowe: CEA 3,37 ng/ml, CA 125 6,3 U/ml i CA 19-9 39,11 U/ml (norma do 37 U/ml). Pacjentka z podejrzeniem guza głowy trzustki i choroby rozrostowej żołądka została skierowana na dalszą diagnostykę. Trafiła do Kliniki Chirurgii Wątroby i Chirurgii Ogólnej. Powtórzono badanie tomografii komputerowej jamy brzusznej z podaniem kontrastu dożylnie i zakontrastowaniem przewodu pokarmowego doustnie. Badanie potwierdziło, że głowa trzustki niejednorodnie się wzmacnia. Opisano dwa hipodensyjne obszary: w obrębie wyrostka haczykowatego 14 × 11 mm i przy ścianie dwunastnicy 11 × 5 mm. Wokół zmienionej głowy trzustki stwierdzono hipodensyjną zmianę przylegającą do dwunastnicy, wątroby, naczyń krezkowych górnych, żyły głównej górnej i żyły nerkowej lewej. Całość zmiany była wielkości 60 × 65 × 66 mm, w jej obrębie znajdowały się liczne węzły chłonne w osi krótkiej długości do 10 mm (ryc. 2).

Wysnuto podejrzenie PC trzustki z naciekiem do zróżnicowania z zapaleniem trzustki okolicy bruzdy. Kolejne tomograficzne kontrolne badanie jamy brzusznej wykonane po 2 tygodniach nie wykazało różnicy w porównaniu z poprzednim obrazem. Pacjentkę przyjęto ponownie do Kliniki Chirurgii Wątroby i Chirurgii Ogólnej. Po przeprowadzeniu podstawowych badań zakwalifikowano ją do laparoskopii zwiadowczej w celu pobrania biopsji zmiany opisywanej w trzustce. Podczas zabiegu zaobserwowano guz przemieszczający i modelujący okolice odźwiernika i pierwszą część dwunastnicy. Po odpreparowaniu zrostów z miejsca największego uwypuklenia guza pobrano bioptat.
Badanie histopatologiczne nie wykazało utkania nowotworowego w dostarczonym materiale (,,W badaniu mikroskopowym widoczna tkanka łączna oraz fragment utkania gruczołowego trzustki”). Pacjentka w stanie dobrym wyszła ze szpitala. Po ok. 2 miesiącach trafiła na szpitalny oddział ratunkowy z powodu nasilenia dolegliwości bólowych w nadbrzuszu, wymiotów i nudności. Wykonano podstawowe badania: USG i RTG jamy brzusznej, dzięki którym wykluczono niedrożność oraz perforację przewodu pokarmowego. W wyniku USG opisano masę w głowie trzustki wielkości 5 cm, dwunastnicę z poszerzoną ścianą do 12 mm oraz liczne węzły chłonne w ich okolicy wielkości do 20 × 8 mm. Badania laboratoryjne wykazały podwyższone wykładniki stanu zapalnego (CRP 6,37 mg/l) oraz zwiększone wartości enzymów: amylaza 226 U/l, fosfataza alkaliczna 172 U/l, GGTP-323 U/l. Pacjentkę umówiono na planowe przyjęcie w celu kontroli zmiany w trzustce i oceny stanu odżywienia.
Kobieta ponownie została przyjęta do Kliniki Chirurgii Wątroby i Chirurgii Ogólnej. Tomografia komputerowa wykazała mierne poszerzenie przewodu żółciowego wspólnego do 9 mm, zaznaczone drogi wątrobowe, koncentryczne pogrubienie ścian dwunastnicy do 14 mm (cześć zstępująca i zagięcie dolne), dodatkowo pojawił się wąski zbiornik płynowy między głową trzustki i dwunastnicy. Poprzednio opisywana hipodensyjna zmiana okolicy głowy trzustki i dwunastnicy nie uległa ewolucji, nadal otaczała liczne naczynia, w jej okolicy znajdowało się wiele węzłów chłonnych, w osi krótkiej do 10 mm. Wykonano gastroskopię, która wykazała zapalenie błony śluzowej przełyku, żołądka i dwunastnicy, zakażenie Helicobacter pylori oraz niewydolność wpustu żołądka. Przeprowadzono pasaż przewodu pokarmowego po doustnym podaniu środka kontrastowego (Ultravist). Podczas badania na poziomie wstępnicy pojawiło się kilka poziomów płynu długości do 8 cm, co sugerowało subileus. W badaniach laboratoryjnych wykazano mierne podwyższenie wykładników stanu zapalnego. Powtórzono badanie markerów nowotworowych: CEA 4,26 ng/l, CA 19-9 72,6 U/ml (norma do 37 U/ml).
Z powodu niejednoznacznych wyników badań obrazowych pacjentce zaproponowano badanie metodą rezonansu magnetycznego z dożylnym podaniem środka kontrastowego (Gadovist) z zastosowaniem sekwencji FOCUS DWI do zobrazowania zmian w trzustce. W tym badaniu w obrębie głowy trzustki widoczna była niejednorodna masa wielkości 76 × 50 × 53 mm, w fazie T1 hipointensywna, ulegająca nieco słabszemu wzmocnieniu pokontrastowemu w porównaniu z pozostałym miąższem trzustki, wykazująca niejednorodne ograniczenie dyfuzji (ryc. 3–6).




Na podstawie obrazu klinicznego oraz wyników badań dodatkowych wysunięto podejrzenie AIP. W efekcie zastosowanego leczenia dolegliwości bólowe oraz parametry stanu zapalnego uległy zmniejszeniu.
Pacjentka pozostaje pod stałą opieką Poradni Żywienia i Poradni Chirurgicznej, a w razie nasilenia dolegliwości bólowych zgłasza się na szpitalny oddział ratunkowy.
Dyskusja
Ścieżka diagnostyczna pacjenta z podejrzeniem nowotworu i zapalenia trzustki jest podobna. Różnice w wynikach przeprowadzonych badań często są niewielkie, dlatego należy je wnikliwie analizować, łącznie z obrazem klinicznym. Najczęstszym objawem klinicznym PC jest ból w nadbrzuszu, który może promieniować do pleców. W badaniach dodatkowych niekiedy stwierdza się powiększony, niebolesny pęcherzyk żółciowy (Courvoisier’s gallbladder), wędrujące zapalenie żył (Trousseau’s syndrome), cukrzycę de novo. U 10–15% pacjentów z PC mogą się pojawić objawy nadmiernego wytwarzania lipazy trzustkowej: bóle mięśniowe, martwica tkanki tłuszczowej, zmiany lityczne kości, przy podwyższonych wartościach lipazy i eozynofilii.
Objawy kliniczne AIP bywają bardzo zbliżone. Może pojawić się żółtaczka, spadek masy ciała, cukrzyca de novo. Silne dolegliwości bólowe i objawy ostrego zapalenia trzustki są rzadko spotykane [3]. Z powodu przewlekłego stanu zapalnego zdarzają się manifestacje pozatrzustkowe AIP związane z nacieczeniem limfocytarnym, tj. zapalenie jelit, dróg żółciowych, płuc, nerek, ślinianek, węzłów chłonnych. U 50% pacjentów z AIP stwierdza się podwyższone poziomy IgG i przeciwciał przeciwjądrowych. Dodatkowo może być zwiększony poziom markera nowotworowego CA 19-9.
Badanie USG w obu przypadkach może wykazać szereg nieprawidłowości: hipoechogeniczną masę w obrębie trzustki otoczoną przez obszar o podwyższonej echogeniczności – naciek zapalny lub odczyn desmoplastyczny tkanki tłuszczowej. W obrębie nacieku mogą się znajdować powiększone węzły chłonne. Zdarza się poszerzenie przewodu trzustkowego i dróg żółciowych. Może występować wodobrzusze. Te liczne objawy nie umożliwią jednak końcowego zróżnicowania obu tych stanów chorobowych.
Głównym narzędziem diagnostycznym stosowanym do oceny trzustki jest tomografia komputerowa, jednak w przypadku omawianych jednostek chorobowych może ona nie dać pewnej diagnozy. Zarówno w AIP, jak i w PC tomografia komputerowa może wykazać:
• słabo zróżnicowaną masę (rozlaną lub ogniskową) w obrębie trzustki,
• pogrubienie okolicznej tkanki tłuszczowej o zatartym zarysie – naciek zapalny lub odczyn desmoplastyczny,
• powiększone węzły chłonne okołotrzustkowe, powyżej 1 cm w osi krótkiej,
• jednoczesne poszerzenie przewodu trzustkowego i dróg żółciowych (double duct sign).
Bardziej typowe dla AIP są ogniskowe zmiany w obrębie trzustki ograniczone głównie do głowy i wyrostka haczykowatego. Na proces zapalny mogą również wskazywać pozatrzustkowe manifestacje AIP: pseudoguzy zapalne nerek – ogniska hipodensyjne, cechy włóknienia zaotrzewnowego z zajęciem okołoaortalnej tkanki tłuszczowej, wysięk opłucnowy.
Wzmocnienie pokontrastowe w AIP i PC wykazuje nieco odmienny wzorzec, jednak są to subtelne różnice, nie zawsze jednoznaczne.
W AIP obserwuje się obniżone wzmocnienie kontrastowe podczas fazy trzustkowej (40 s), ale bliskie normalnemu zakontrastowanie w fazie wrotnej (70 s). W PC natomiast w 75–90% przypadków zmiana jest hipodensyjna w fazie tętniczej, a na skanach opóźnionych może być izodensyjna.
Tomografia komputerowa odgrywa ważną rolę w zdiagnozowaniu zmian nieresekcyjnych w PC, gdyż daje dokładny obraz tętnic i żył. Dzięki temu badaniu udaje się makroskopowo prawidłowo określić zmiany nieresekcyjne w 89–100% przypadków. O nieresekcyjności świadczy otoczenie powyżej 180 stopni obwodu naczyń (tj. TC, SMA) przez nowotwór (stadium T4 zaawansowania).
Kolejnym badaniem, z którym obecnie wiąże się duże nadzieje, jest rezonans magnetyczny z dożylnym podaniem kontrastu (gadolin). Oba stany chorobowe będą się podobnie prezentowały w fazie T1 jako hipointensywne zmiany względem normalnej trzustki. Po podaniu gadolinu donaczyniowo w obu przypadkach zmienione chorobowo fragmenty miąższu wykażą wolniejsze wzmocnienie od prawidłowej trzustki. Dlatego satysfakcjonujące bywają obrazy w fazie tętniczej po dynamicznym podaniu środka kontrastującego, z opcją wygaszenia tłuszczu.
Istnieją doniesienia, że w badaniach dyfuzyjnych MR (DWI) wyniki pomiaru współczynnika ADC (apparent diffusion coefficient) mogą być charakterystyczne dla prawidłowego miąższu trzustki, zmian zapalnych i nowotworu trzustki. Powstały prace, w których analizowano mapy współczynnika ADC uzyskane na podstawie pomiarów współczynnika dyfuzji (ADC 10, 30, 50, 100) z ograniczonych obszarów normalnego, zmienionego zapalnie i zmienionego nowotworowo miąższu trzustki (w fazie T1 rezonansu magnetycznego z wygaszeniem tłuszczu i FRFSE-FS). Zaobserwowano, że normalny miąższ trzustki wykazuje jednorodną intensywność sygnału w DWI, co odpowiada jednolitemu kolorowi na mapie ADC badanego obszaru. Intensywność sygnału obszarów zmienionych zapalnie lub nowotworowo w trzustce jest natomiast niejednorodna, z mieszanymi kolorami na mapach ADC [4]. Wynika to z patologicznego charakteru zmian zapalnych oraz nowotworowych trzustki i jest wytłumaczalne na poziomie mikroskopowym. Zmiany zapalne charakteryzują się naciekiem z komórek limfatycznych, destrukcją miąższu trzustki i przewlekłym włóknieniem. Nowotworzenie trzustki jest związane z pojawieniem się komórek nowotworowych i intensywnym włóknieniem, zwanym reakcją desmoplastyczną. Włóknienie jest więc wspólną cechą AIP i PC. Z badań naukowych wynika, że włóknienie może ograniczać dyfuzję wody, co skutkuje obniżeniem wartości współczynnika ADC [4]. W związku z tym zarówno obszary AIP, jak i PC charakteryzują się rozlanym ograniczeniem dyfuzji z wyższym sygnałem DWI i niższymi wartościami pomiaru współczynnika dyfuzji ADC w porównaniu ze zdrowym miąższem trzustki. Zaobserwowano, że obniżenie wartości współczynnika ADC w AIP jest mniejsze niż w PC. Z tą cechą wiązane są duże nadzieje dotyczące ostatecznego różnicowania AIP i PC na podstawie wskaźnika ADC. Nadal jednak nie zostały dokładnie określone zakresy wskaźnika ADC dla obu tych stanów chorobowych – zagadnienie to znajduje się w fazie badań klinicznych. W różnych pracach podawane są inne charakterystyczne wartości pomiarów ADC, co może być spowodowane różnymi sposobami jego pomiaru, m.in. wielkością ROI (region of interest), z którego tworzone są mapy ADC. Być może pomogłaby jej standaryzacja. Kamisawa i wsp. uważają za optymalną wartość różnicującą AIP i PC współczynnika dyfuzji 1,075 × 10–3 mm2/s [5].
Kolejnym badaniem, które miałoby końcowo różnicować oba stany chorobowe, jest biopsja zmienionego miąższu trzustki. Wykonuje się ją przed podjęciem decyzji o przeprowadzeniu zabiegu chirurgicznego oraz przed proponowanym leczeniem (np. chemio- i radioterapią lub steroidoterapią). W niektórych przypadkach nawet wynik biopsji nie jest przekonujący. Często w pierwszym rzucie proponuje się pacjentowi biopsję podczas ultrasonografii endoskopowej (endoscopic ultrasound fine-needle aspiration – EUS-FNA). EUS jest uznawana za jedno z najbardziej czułych badań w wykrywaniu nowotworów głowy trzustki, zwłaszcza gdy zmiany są mniejsze niż 3 cm [6], jednak nie zawsze jest możliwa (np. z powodu utrudnionego dojścia do zmiany lub ryzyka uszkodzenia naczyń), a czasami nie dostarcza wystarczającej ilości materiału do postawienia diagnozy. Dlatego jeśli EUS-FNA nie jest wystarczająca, wykonuje się biopsję chirurgiczną zmienionych chorobowo fragmentów podczas laparoskopii [7]. Laparoskopia jest bardziej czuła od innych technik w wykrywaniu przerzutów nowotworowych do otrzewnej lub powierzchownych przerzutów do wątroby.
Wnioski
Rozpoznanie AIP jest wyzwaniem dla każdego klinicysty. Opracowano liczne kryteria diagnostyczne, by ułatwić rozpoznawanie AIP, np. klasyfikacja ASIAN z 2008 r., klasyfikacja MAYO z 2006 r. Różnią się one doborem badań dodatkowych wynikającym z odmiennych preferencji badaczy. W 2010 r. na 14th Congress of the International Association of Pancreatology grupa robocza ujednoliciła wcześniejsze ustalenia i sformułowała następujące kryteria diagnostyczne AIP:
• charakterystyczne cechy w badaniach obrazowych (dla miąższu trzustki w tomografii komputerowej lub rezonansie magnetycznym, dla przewodów żółciowych we wstecznej cholangiopankreatografii endoskopowej lub w cholangiografii rezonansu magnetycznego),
• badania serologiczne (IgG, IgG4, przeciwciała przeciwjądrowe),
• zajęcie innych narządów,
• histopatologia trzustki,
• odpowiedź na steroidoterapię [8].
Pacjent powinien spełniać jedno lub więcej z wymienionych powyżej kryteriów.
W przypadku kryterium badań obrazowych i trudności w odróżnieniu AIP od PC zasugerowano następujące postępowanie:
• gdy w badaniach obrazowych mamy do czynienia z rozlanym powiększeniem trzustki bez cech masy i poszerzenia przewodu żółciowego, gdy nie ma innych dodatkowych dowodów w badaniach przemawiających za PC, sugeruje się rozpoznanie AIP,
• gdy w badaniach obrazowych widoczne są cechy silnie przemawiające za PC, tj. hipodensyjna masa, poszerzenie przewodu trzustkowego lub jego nagłe zwężenie, przy braku cech przemawiających za AIP należy rozpoznać PC,
• przypadki, w których nie można jednoznacznie opowiedzieć się za AIP ani PC, należy traktować jak PC [8].
U opisywanej pacjentki wyniki badań obrazowych nie dawały jasnej odpowiedzi, co uniemożliwia zaliczenie tego kryterium jako przemawiającego za AIP. Autorzy nie znają wyników badań serologicznych. Zdiagnozowano zapalenie dwunastnicy i żołądka, co możemy uznać za zajęcie innych narządów. Wyniki badania histopatologicznego trzustki przemawiały za AIP. Nie ma informacji dotyczących odpowiedzi na steroidoterapię. Można więc uznać, że pacjentka spełnia dwa z pięciu kryteriów, co przemawia za AIP. Za tym rozpoznaniem przemawia również długi czas obserwacji pacjentki – ponad 20 miesięcy.
Piśmiennictwo
1. Zhang Q, Zeng L, Chen Y i wsp. Pancreatic cancer epidemiology, detection, and management. Gastroenterol Res Pract 2016; 2016: 8962321.
2. van Heerde J, Biermann K, Zondervan P i wsp. Prevalence of autoimmune pancreatitis and other benign disorders in pancreatoduodenectomy for presumed malignancy of the pancreatic head. Dig Dis Sci 2012; 57: 2458-2465.
3. Luis P, Suresh T. Autoimmune pancreatitis. Curr Gastroenterol Rep 2005; 7: 101-106.
4. Ma X, Zhao X, Ouyang H i wsp. Quantified ADC histogram analysis: a new method for differentiating mass-forming focal pancreatitis from pancreatic cancer. Acta Radiol 2014; 55: 785-792.
5. Kamisawa T, Takuma K, Anjiki H i wsp. Differentiation of autoimmune pancreatitis from pancreatic cancer by diffusion-weighted MRI. Am J Gastroenterol 2010; 105: 1870-1875.
6. Horwhat J, Gerke H, Acosta R i wsp. Focal or diffuse “fullness” of the pancreas on CT. Usually benign, but EUS plus/minus FNA is warranted to identify malignancy. JOP 2009; 10: 37-42.
7. Toshiyama R, Noda T, Eguchi H i wsp. Two cases of resectable pancreatic cancer diagnosed by open surgical biopsy after endoscopic ultrasound fine-needle aspiration failed to yield diagnosis: case reports. Surg Case Rep 2017; 3: 39.
8. Tooru S, Suresh C, Luca F i wsp. International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the International Association of Pancreatology. Pancreas 2011; 40: 352-358.
Pełna treść artykułu:Katarzyna Nadolska, Agnieszka Białecka, Elżbieta Zawada, Bartosz Nadolski. Różnicowanie autoimmunologicznego zapalenia od nowotworu trzustki za pomocą metod diagnostyki obrazowej. Lekarz POZ 2021; 7 (6): 441-447.
Źródło:
Lekarz POZ 2021; 7 (6): 441-447.
Lekarz POZ 2021; 7 (6): 441-447.




