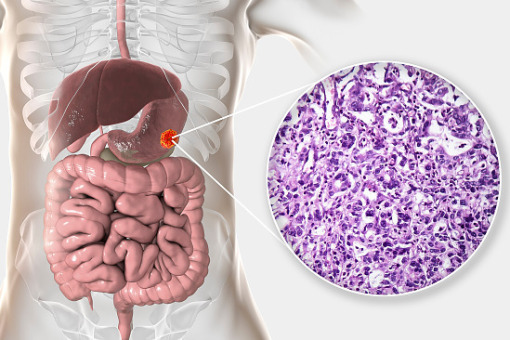
PONIEDZIAŁEK 9 LUTEGO
Aktualności
<
Książki
>
Patronat naukowy portalu

|
Patronat naukowy portalu:
Prof. dr hab. n. med. Grażyna Rydzewska, Kierownik Kliniki Gastroenterologii CSK MSWiA Redaktor prowadzący:
Prof. dr hab. n. med. Piotr Eder, Katedra i Klinika Gastroenterologii, Żywienia Człowieka i Chorób Wewnętrznych Uniwersytetu Medycznego im. Karola Marcinkowskiego w Poznaniu |