Co nowego w etiologii zespołu jelita drażliwego (IBS) – mikroflora jelitowa proszona do tablicy!
Zespół jelita drażliwego (ang. irritable bowel syndrome - IBS) należy do najczęstszych zaburzeń czynnościowych przewodu pokarmowego i charakteryzuje się występowaniem przewlekle lub okresowo takich objawów jak ból i dyskomfort brzucha z towarzyszącym wzdęciem, zaparciem i/lub biegunką.
Wprowadzenie
Zespół jelita drażliwego (ang. irritable bowel syndrome - IBS) należy do najczęstszych zaburzeń czynnościowych przewodu pokarmowego i charakteryzuje się występowaniem przewlekle lub okresowo takich objawów jak ból i dyskomfort brzucha z towarzyszącym wzdęciem, zaparciem i/lub biegunką. Objawom może towarzyszyć uczucie niepełnego wypróżnienia. Charakterystyczną cechą jest także towarzyszący bólom brzucha zmienny rytm wypróżnień i występowanie luźnych stolców na przemian z zaparciami. Rozpoznanie zespołu jelita drażliwego można postawić najczęściej na podstawie tzw. kryteriów rzymskich po zebraniu dokładnego wywiadu lekarskiego i przeprowadzeniu badania przedmiotowego, często bez potrzeby wykonywania dodatkowych, specjalistycznych badań diagnostycznych. U części pacjentów może jednak zaistnieć taka potrzeba i dotyczy to szczególnie osób u których istnieje podejrzenie choroby organicznej. Aktualnie obowiązujące to kryteria rzymskie III z 2006 roku (Tabela 1). Kryteria rzymskie III w odróżnieniu od poprzedniej klasyfikacji z 1999 roku (kryteria rzymskie II) pozwalają lepiej uwzględnić czas pasażu jelitowego i na ich podstawie można wyróżnić postać biegunkową, zaparciową i mieszaną zespołu. U części pacjentów zgłaszane objawy nie pozwalają na określenie konkretnej postaci zespołu. W diagnostyce różnicowej, zwłaszcza u pacjentów z postacią biegunkową choroby należy dodatkowo uwzględnić możliwości występowania choroby trzewnej.
Rycina 1
Epidemiologia IBS
Częstość występowania IBS w krajach europejskich i Stanach Zjednoczonych określa się na 7-30%. Objawy częściej występują u kobiet (2:1). Większość osób z miernie wyrażonymi objawami nigdy nie zwraca się do lekarza po pomoc, natomiast w grupie osób, które takie pomocy szukają zdecydowaną większość stanowią kobiety (4:1). Należy podkreślić, że choć ryzyko wystąpienia choroby organicznej u osób z zespołem jelita drażliwego jest porównywalne do osób zdrowych, to jednak utrzymujące się objawy przyczyniają się do bardzo istotnego obniżenia jakości życia (ang. quality of life – QoL).
U tych osób jakość życia jest znacznie obniżona i porównywalna do pacjentów
z przewlekłymi chorobami organicznymi, takimi jak zaawansowana cukrzyca
czy schyłkowa niewydolność nerek. Należy zaznaczyć, że część pacjentów z objawami
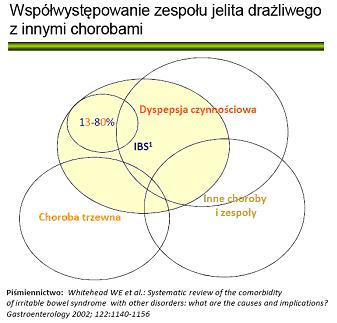
IBS zgłasza także inne objawy, pozornie nie związane z przewodem pokarmowym. Wśród tych pacjentów częstość współwystępowania takich zespołów jak fibromialgia, zespół przewlekłego zmęczenia, bóle stawu skroniowo-żuchwowego czy przewlekły ból miednicy mniejszej jest znaczna. Nierzadkie jest też współwystępowanie i nakładanie objawów
IBS z objawami z górnego odcinka przewodu pokarmowego o charakterze dyspepsji czynnościowej (rycina 1).
Tabela 1. Kryteria rzymskie III w diagnostyce zespołu jelita drażliwego
Należy także zwrócić uwagę na charakterystyczne współistnienie objawów
ze strony układu nerwowego – u ponad połowy pacjentów można rozpoznać mniej
lub bardziej nasiloną depresję, a wiele osób przejawia w różnym stopniu wyrażone zaburzenia osobowościowe. Osoby te w sposób szczególny swoje problemy psychiczne manifestują objawami somatycznymi, zwłaszcza w sytuacjach stresowych i innych zaburzeniach emocjonalnych.
Rycina 2

Wszystkie wyżej wymienione czynniki sprawiają, że znaczne są także koszty nakłady ekonomiczne związane z diagnostyką i leczeniem tego zespołu. Częste, przewlekłe i nasilone dolegliwości są przyczyną absencji chorobowej i wystawiania wielu zaświadczeń lekarskich, częstych wizyt lekarskich i hospitalizacji, wykonywania
i powtarzania dodatkowych badań oraz stosowania wielu leków. Ze względu na brak dostatecznej wiedzy na temat przyczyny powstawania objawów i stosowania prawie wyłącznie leków działających objawowo, niezadowolenie wśród pacjentów
z dotychczasowego leczenia jest ogromne (rycina 2; 3).
Rycina 3

Etiologia
Należy podkreślić, że etiopatologia zespołu jelita drażliwego jest złożona i nadal
nie dokładnie poznana. Aczkolwiek w ostatnich latach nasza wiedza na temat etiologii zespołu IBS wzbogaciła się o istotne elementy (rycina 4). Tradycyjnie wymienia
się na następujące mechanizmy prowadzące do powstawania objawów w tym zespole:
1) zaburzenia motoryki jelit
2) nadwrażliwość trzewna,
3) ograniczony do błony śłuzowej i podśluzowej przewlekły stan zapalny jelit (ang. minimal „inflammatory” bowel state) oraz
4) zaburzenia układu immunologicznego w obrębie błony śluzowej przewodu pokarmowego.
Nowe badania wskazują na istotny związek z powyższymi i udział w patogenezie
5) mikroflory jelitowej i osi mikroflora-mózg-jelito,
6) roli czynników epigenetycznych i stresu we wczesnym okresie życia (ang. early life stress events)
Rycina 4

Zaburzenia motoryki przewodu pokarmowego
W badaniach z użyciem manometru i pomiarów elektrofizjologicznych wykazano, że u pacjentów z IBS często występuje nieprawidłowa motoryka jelit. Do zaburzeń perystaltyki często dochodzi w wyniku ekspozycji na stres lub posiłek. Początkowo uważano, że nieprawidłowości te dotyczą głównie jelita grubego, jednak w ostatnich pracach wykazano, że patologią może być objęty każdy odcinek przewodu pokarmowego. Ponadto wykazano, że zaburzenia w zakresie motoryki przewodu pokarmowego korelują z odczuwanymi przez pacjentów objawami. Dotyczy to także grupy osób z dominującym wzdęciem, u których zaburzenia pasażu dotyczą także gazów jelitowych. Co ciekawe w badaniach eksperymentalnych wskazano na istotny wpływ mikroflory jelitowej na czas pasażu jelitowego i tak u zwierząt doświadczalnych pozbawionych flory jelitowej (tzw. germ-free animals) powszechnie występuje gastropareza, zwolnienie pasażu jelitowego i rozdęcie kątnicy. Kolonizacja tych zwierząt mikroflorą jelitową powoduje ustąpienie patologii i przywrócenie prawidłowej pracy przewodu pokarmowego. Z drugiej strony zaburzenia mikroflory jelitowej mogą prowadzić do nieprawidłowej fermentacji jelitowej z nadmierną, patologiczną produkcją wodoru i metanu, gazami odpowiedzialnymi za zwolnienie pasażu jelitowego i powstanie nadwrażliwości trzewnej, co przez pacjenta odczuwane jest jako bolesne wzdęcie.
Nadwrażliwość trzewna i przewlekły stan zapalny błony śluzowej jelita
Zaburzenia motoryki jelit, jakkolwiek często występują u pacjentów z IBS, to jednak
nie są charakterystyczne wyłącznie dla tego zespołu. W ostatnich latach coraz więcej uwagi lekarze poświęcają tzw. nadwrażliwości trzewnej, które to zjawisko występuje powszechnie u pacjentów z zespołem jelita drażliwego. Obecnie uważa się, że do nadwrażliwości trzewnej dochodzi wtórnie w wyniku aktywacji czynników i elementów układu immunologicznego w błonie śluzowej. Zaburzenia mikroflory jelitowej mogą prowadzić do nieprawidłowej aktywacji układu immunologicznego i utrzymywania się subtelnego ale przewlekłego stanu zapalnego śluzówki jelit. Hipoteza ta wydaje
się mieć potwierdzenie w badaniach tkanek jelitowych, uzyskiwanych podczas badań endoskopowych u pacjentów z IBS, w których wykazano nadmierne gromadzenie komórek tucznych i neutrofilów w błonie śluzowej z towarzyszącym uszkodzeniem zwojów nerwowych. U pacjentów z IBS obserwowano nadmierny rozpad komórek tucznych z uwolnieniem mediatorów stanu zapalnego w bezpośrednim sąsiedztwie zakończeń nerwowych. Z kolei w badaniach in-vitro wykazano, że nadsącz z hodowli zawierających tkankę jelitową pozyskaną za pomocą biopsji od pacjentów z objawami IBS działał drażniąco na zwoje nerwowe w mechanizmie zależnym od rozpadu komórek tucznych. Ponadto u pacjentów z IBS obserwowano nadmierne gromadzenie limfocytów, komórek enterochromatofilnych i zwiększoną przepuszczalność bariery jelitowej. Patologiczną aktywację układu immunologicznego, wywołującą tzw. alert prozapalny można także zaobserwować poprzez pomiar zwiększonego stężenia krążących cytokin zapalnych
we krwi obwodowej. Powyższe obserwowane u pacjentów z IBS zjawiska bezpośrednio korelują z natężeniem odczuwanego przez nich bólu i innych dolegliwości. Współczesny pogląd na etiopatogenezę zespołu jelita drażliwego obrazuje rycina 5.
Rycina 5
Uproszczony schemat obrazujący współczesne poglądy na patogenezę IBS

Od dawna wiadomo, że przebyte zakażenie przewodu pokarmowego, wirusowe
czy bakteryjne może prowadzić do wystąpienia tzw. poinfekcyjnego zespołu jelita drażliwego. Obserwacje te poczyniono jeszcze w toku badań epidemiologicznych przeprowadzonych w latach 60 tych ubiegłego stulecia. Obecnie uważa się, że prawie 1/3 pacjentów z IBS rozwija objawy ze strony przewodu pokarmowego po przebytej infekcji. Czynnikiem etiologicznym, często nie diagnozowanym, jest najczęściej zakażenie bakteryjne (salmonella, shigella czy campylobacter jejuni), wirusowe (noro-wirusy)
i/lub pasożytnicze (Giardia intestinalis i duodenalis) (tabela 2).
Tabela 2. Rola czynników infekcyjnych w patogenezie zespołu jelita drażliwego

Uważa się ponadto, że ryzyko wystąpienia objawów IBS po przebytej infekcji wzrasta co najmniej pięciokrotnie i zależy od kilku dodatkowych czynników, które korelują ze stopniem nasilenia objawów. Do nich można zaliczyć: a) czas trwania infekcji jelitowej – im dłuższe zakażenie tym większe ryzyko wystąpienia zespołu, b) młodszy wiek – większe ryzyko, oraz c) współwystępowanie objawów depresyjnych lub lękowych ze strony układu nerwowego w czasie zakażenia przewodu pokarmowego, d) płeć żeńską,
e) palenie papierosów, a także f) stopień wirulencji czynnika zakaźnego oraz g) przebytą kurację antybiotykową. Pomimo, że istnieje tendencja do zmniejszania bądź samoistnego wycofywania się dolegliwości, u znacznej liczby pacjentów objawy mogą utrzymywać się nawet przez okres 6 lat jaki upłynął od zakażenia.
Mikroflora jelitowa w zespole jelita drażliwego
W chwili przyjścia na świat człowieka przewód pokarmowy jest zasiedlany przez tysiące mikroorganizmów, które wchodzą w skład mikroflory jelitowej tworząc zintegrowany, spójny, dobrze funkcjonujący ekosystem. Mikroflora jelitowa jest niezwykle zróżnicowana i złożona. Należy wskazać na szereg trudności diagnostycznych w zakresie flory jelitowej, a mianowicie na fakt, że większość mikroorganizmów nie podlega hodowlom in-vitro i nie wzrasta na pożywkach hodowlanych. Jednak wraz z pojawieniem się nowych metod diagnostycznych z wykorzystaniem technik biologii molekularnej,
w ostatnim czasie można już dokonywać szczegółowej analizy bakterii wchodzących w skład mikroflory przewodu pokarmowego (rycina 6).
Rycina 6

Mikroflora jelitowa i produkty fermentacji bakteryjnej biorą udział w regulacji wielu szlaków metabolicznych, warunkują prawidłową pracę układu pokarmowego i immunologicznego i są odpowiedzialne za utrzymanie prawidłowej gospodarki metabolicznej organizmu. W ostatnich latach wykazano związek mikroflory jelitowej z wieloma stanami patologicznymi a w szczególności z otyłością, chorobą trzewną, cukrzycą, chorobami wątroby, chorobami zapalnymi jelit i nowotworami przewodu pokarmowego. Zaburzenia w zakresie mikroflory jelitowej występują też powszechnie we zespole jelita drażliwego. Możemy wyróżnić różne populacje bakterii wchodzące w skład flory jelitowej – tą część, która bytuje w świetle jelita, odpowiedzialna głównie za procesy metaboliczne oraz populację bakterii związanych z błoną śluzową jelita. Ta ostatnia grupa jest odpowiedzialna m.in. za aktywację układu immunologicznego
i interakcję z włóknami wypustek nerwowych w ścianie jelita. U pacjentów z IBS występują zarówno ilościowe jak i jakościowe zaburzenia mikroflory jelitowej w porównaniu do osób zdrowych. W badaniach z wykorzystaniem technik biologii molekularnej u pacjentów z IBS stwierdzono obniżenie lub brak pałeczek kwasu mlekowego oraz bifidobakterii wraz ze wzrostem drobnoustrojów z grupy patogennych szczepów i gatunków Clostridia i Enterobacteriacae. Dokonując analizy molekularnej flory jelitowej w zależności od rodzaju dominujących objawów wykazano, że pacjenci z postacią biegunkową mają znacznie zmniejszoną liczbę pałeczek kwasu mlekowego, natomiast wśród osób z zaparciem dominują formy z gatunku Veillonella. Ponadto wskazano na znaczną niestabilność populacji bakteryjnych u pacjentów z IBS w porównaniu do osób zdrowych. Ta obserwacja pozwala tłumaczyć, dlaczego niewielki stres, błąd dietetyczny lub potencjalnie banalny czynnik zakaźny może nasilać dysbiozę i wywoływać objawy. Zmiany ilościowe flory jelitowej mogą nasilać fermentację jelitową i procesy dekoniguacji kwasów żółciowych
w jelicie cienkim i grubym. Procesy te mogą wpływać na zmianę krążenia i wydalania kwasów żółciowych w jelicie grubym a tym samym wpływać na jego motorykę.
Dysbioza i zaburzenia osi mózgowo-jelitowej w IBS
Infekcja jelitowa może prowadzić do tzw. dysbiozy czyli zaburzeń w obrębie ekosystemu i mikroflory jelitowej, który to stan w konsekwencji jest odpowiedzialny za wystąpienie przewlekłej reakcji zapalnej błony śluzowej jelit. Należy wspomnieć, że także inne czynniki mogą negatywnie oddziaływać na mikroflorę jelitową i prowadzić do dysbiozy. Wśród nich można wymienić m.in. stosowane leki (najczęściej antybiotyki
i niesterydowe leki przeciwzapalne [NLPZ]), dietę bogatą w tłuszcze zwierzęce i sztuczne węglowodany oraz przewlekły stres fizyczny i psychiczny (rycina 7).
Rycina 7

W niedawno opublikowanej pracy, wykazano istotne zaburzenia mikroflory jelitowej u pacjentów poddawanych krótkotrwałej antybiotykoterapii mającej na celu eradykację Helicobacter pylori. Szczegółowa analiza molekularna mikroflory jelitowej u niektórych pacjentów wykazywała znaczne zmniejszenie populacji bakterii gram dodatnich, w tym pałeczek kwasu mlekowego i bifidobakterii wraz ze wzrostem populacji bakterii proteolitycznych, odpowiedzialnych za nieprawidłową fermentację i produkcję gazów jelitowych. Ponadto stwierdzono wysoką aktywację genów antybiotykooporności mikrobiomu bakterii jelitowych u tych pacjentów. Zaburzenia ilościowe i jakościowe różnych składu populacji bakteryjnych utrzymywały się przez okres 4 lat od zakończenia kuracji antybiotykowej (rycina 8). U części pacjentów z IBS opisywano także zespół przerostu flory bakteryjnej w jelicie cienkim (ang. small intestinal bacterial overgrowth – SIBO) a jego występowanie korelowano z nasileniem objawów. W zespole tym dochodzi do nieprawidłowej kolonizacji nabłonka proksymalnej części jelita cienkiego przez bakterie produkujące duże ilości wodoru i metanu, co prowadządzi do zaburzeń motoryki jelit. Należy jednak zaznaczyć, że istnieją problemy natury metodologicznej w diagnozowaniu zespołu SIBO a jego znaczenie w patogenezie IBS pozostaje nadal tematem licznych naukowych sporów i kontrowersji.
Rycina 8

Bezsporne z kolei są obserwacje, że u osób z IBS w wyniku przetrwałej reakcji zapalnej błony śluzowej stwierdza się zwiększone wartości cytokin prozapalnych w obrębie błon śluzowych i krążeniu obwodowym, a ich stężenia bezpośrednio korelują ze stopniem nasileniem dolegliwości bólowych i utrzymywaniem się objawów. U tych pacjentów za pomocą nowoczesnych technik obrazowania układu nerwowego, można wykazać zaburzenia osi mózgowo-jelitowej, nadmierną aktywację układu podwzgórze – przysadka - nadnercza i dysfunkcję obwodowych zakończeń nerwowych w nabłonku jelitowym. Obserwacje te potwierdzono także w badaniach doświadczalnych, w których wykazano, że zwiększone stężenia czynnika martwicy nowotworów TNF-alfa i interleukiny-6 pochodzenia jelitowego w krążeniu obwodowym, negatywnie oddziałują na oś mózgowo-jelitową. Opisane mechanizmy mogą w pewnym stopniu tłumaczyć występowanie nieprawidłowych stanów emocjonalnych i zaburzeń depresyjnych u pacjentów z IBS. W najnowszych badaniach wykazano, że stopień zapalenia błony śluzowej jelitu zwierząt laboratoryjnych był skorelowany z występowaniem u nich epizodów lękowych. Dodatkowo stwierdzono mniejszą ekspresję BDNF (ang. Brain Derived Neurotropic Factor) na poziomie mRNA w obrębie struktury hipokampa, wzrost stężenia krążącego w surowicy TNF-alfa i białka kynureniny. Z kolei stwierdzono zmniejszoną ekspresję niektórych białek, niezbędnych do prawidłowej pracy mózgu. Co ciekawe zastosowanie przeciwciał monoklonalnych anty-TNF-alfa bądź leków immunosupresyjnych lub niektórych szczepów bakterii probiotycznych powodowało wycofywanie się opisywanych zmian.
Mikroflora jelitowa jako czynnik epigenetyczny w IBS
Epigenetyka zajmuje się badaniem zmienności i wpływem na ekspresję genów, które to zjawiska nie wpływają na pierwotną zmianę sekwencji DNA. Jednym z najlepiej poznanych mechanizmów epigenetycznych jest proces metyzacji DNA i modyfikacji białek histonowych. Uważa się, że stopień metylacji materiału genetycznego jest odwrotnie proporozjonalny do aktywności genu. U pacjentów z IBS stwierdzono istotne zaburzenia metylacji genu dla receptora glikosterydowego. Prawdopodobnie zmiany te zachodzą na drodze epigenetycznej we wczesnym etapie życia a mikroorganizmy i ich produkty odgrywają ważną rolę w tym procesie. W tym okresie niezmiernie istotny jest też wpływ flory jelitowej na rozwój osi podwzgórze – przysadka - nadnercza. W przypadku występowania dysbiozy dochodzi do nieprawidłowości w rozwoju i funkcji tego układu, a zmiany te utrzymują się przez całe życie osobnicze. Bakterie jelitowe odgrywają także istotna rolę w regulacji układu immunologicznego poprzez syntezę molekuł
i oligonukleotydów, które wchodzą w interakcję z receptorami TLR i pełnią funkcję ochronne. Należy podkreślić, że czynniki stresowe występujące we wczesnym okresie życia warunkują skład i różnorodność mikroflory jelitowej a także elementów odpowiedzi immunologicznej nieswoistej i mają swój udział w patogenezie zespołu jelita drażliwego na dalszych etapach życia.
Modulacja flory jelitowej jako nowe leczenie przyczynowe w zespole jelita drażliwego
Modulacja mikroflory jelitowej za pomocą probiotyków i prebiotyków a także antybiotyków stanowi obecnie bardzo obiecującą strategię leczniczą. Ponieważ przewlekła i powtarzana kuracja antybiotykowa niesie za sobą wiele zagrożeń, wydaje się, że bakterie probiotyczne otworzyły nowe horyzonty w leczeniu pacjentów z objawami zespołu jelita drażliwego. Pomimo, że do tej pory nie wykazano efektu terapeutycznego dla grupy probiotyków, a jedynie dla konkretnych szczepów probiotycznych, wydaje się, że wybrane probiotyki znajdą swoje miejsce w postępowaniu terapeutycznym u pacjentów z IBS. Należy przypomnieć, że efekt jaki wywołuje probiotyk jest ściśle związany z konkretnym, użytym w badaniu szczepem, a ekstrapolacja uzyskanych wyników na inne bakterie probiotyczne jest niedozwolona. Jaki powinien być więc idealny probiotyk, który można zarekomendować lekarzom i ich pacjentom z zespołem jelita drażliwego? (rycina 9).
Rycina 9
Miejsce probiotyków w leczeniu zespołu jelita drażliwego

Przede wszystkim powinien charakteryzować się doskonałym profilem bezpieczeństwa. Ponadto wyboru można dokonać w oparciu o mechanizm jego działania a także mechanizmy patogenetyczne zespołu jelita drażliwego: zaburzenia mikroflory jelitowej i osi mózgowo-jelitowej, przewlekły stan zapalny śluzówki jelit i nadmierny rozpad komórek tucznych, upośledzenie bariery jelitowej i patologiczna aktywacja układu immunologicznego. Mechanizm działania powinien być udokumentowany w badaniach in-vitro i in-vivio a jego skuteczność potwierdzona w dobrze zaplanowanych, randomizowanych i kontrolowanych z podwójnie ślepą próbą z placebo badaniach klinicznych.
Podsumowanie
Zespół jelita drażliwego jest przewlekłą chorobą o złożonej etiologii. Badania ostatnich lat wskazują na znaczny wpływ mikroflory i osi mózgowo-jelitowej w patogenezie objawów. Modulacja mikroflory jelitowej za pomocą probiotyków i prebiotyków otwiera nowe, obiecujące możliwości w leczeniu pacjentów z tym zespołem. Rekomendacje dotyczące stosowania probiotyków w IBS powinny uwzględniać udokumentowany w badaniach in-vitro i in-vivo mechanizm ich działania oraz potwierdzone bezpieczeństwo i skuteczność w przeprowadzonych, dobrze zaplanowanych badaniach klinicznych u ludzi.
Dr n. med. Wojciech Marlicz
Klinika Gastroenterologii Pomorskiego Uniwersytetu Medycznego w Szczecinie
Zespół jelita drażliwego (ang. irritable bowel syndrome - IBS) należy do najczęstszych zaburzeń czynnościowych przewodu pokarmowego i charakteryzuje się występowaniem przewlekle lub okresowo takich objawów jak ból i dyskomfort brzucha z towarzyszącym wzdęciem, zaparciem i/lub biegunką. Objawom może towarzyszyć uczucie niepełnego wypróżnienia. Charakterystyczną cechą jest także towarzyszący bólom brzucha zmienny rytm wypróżnień i występowanie luźnych stolców na przemian z zaparciami. Rozpoznanie zespołu jelita drażliwego można postawić najczęściej na podstawie tzw. kryteriów rzymskich po zebraniu dokładnego wywiadu lekarskiego i przeprowadzeniu badania przedmiotowego, często bez potrzeby wykonywania dodatkowych, specjalistycznych badań diagnostycznych. U części pacjentów może jednak zaistnieć taka potrzeba i dotyczy to szczególnie osób u których istnieje podejrzenie choroby organicznej. Aktualnie obowiązujące to kryteria rzymskie III z 2006 roku (Tabela 1). Kryteria rzymskie III w odróżnieniu od poprzedniej klasyfikacji z 1999 roku (kryteria rzymskie II) pozwalają lepiej uwzględnić czas pasażu jelitowego i na ich podstawie można wyróżnić postać biegunkową, zaparciową i mieszaną zespołu. U części pacjentów zgłaszane objawy nie pozwalają na określenie konkretnej postaci zespołu. W diagnostyce różnicowej, zwłaszcza u pacjentów z postacią biegunkową choroby należy dodatkowo uwzględnić możliwości występowania choroby trzewnej.
Rycina 1

Epidemiologia IBS
Częstość występowania IBS w krajach europejskich i Stanach Zjednoczonych określa się na 7-30%. Objawy częściej występują u kobiet (2:1). Większość osób z miernie wyrażonymi objawami nigdy nie zwraca się do lekarza po pomoc, natomiast w grupie osób, które takie pomocy szukają zdecydowaną większość stanowią kobiety (4:1). Należy podkreślić, że choć ryzyko wystąpienia choroby organicznej u osób z zespołem jelita drażliwego jest porównywalne do osób zdrowych, to jednak utrzymujące się objawy przyczyniają się do bardzo istotnego obniżenia jakości życia (ang. quality of life – QoL).
U tych osób jakość życia jest znacznie obniżona i porównywalna do pacjentów
z przewlekłymi chorobami organicznymi, takimi jak zaawansowana cukrzyca
czy schyłkowa niewydolność nerek. Należy zaznaczyć, że część pacjentów z objawami
IBS zgłasza także inne objawy, pozornie nie związane z przewodem pokarmowym. Wśród tych pacjentów częstość współwystępowania takich zespołów jak fibromialgia, zespół przewlekłego zmęczenia, bóle stawu skroniowo-żuchwowego czy przewlekły ból miednicy mniejszej jest znaczna. Nierzadkie jest też współwystępowanie i nakładanie objawów
IBS z objawami z górnego odcinka przewodu pokarmowego o charakterze dyspepsji czynnościowej (rycina 1).
Tabela 1. Kryteria rzymskie III w diagnostyce zespołu jelita drażliwego
| Przewlekłe lub nawracające co najmniej przez 3 miesiące z początkiem objawów przed 6 miesiącami: 1. Bóle brzucha bądź dyskomfort: a) zmniejszające się po defekacji b) i/lub związane ze zmianą w częstości oddawania stolca c) i/lub związane ze zmianą wyglądu i konsystencji stolca, oraz: 2) Dwa lub więcej z następujących zaburzeń: a) zmiana częstości wypróżnień (powyżej 3 dziennie lub poniżej 3 tygodniowo) b) zmiana konsystencji stolca (nadmiernie twardy lub luźny) c) zmiana pasażu stolca (parcie na stolec, nagłe oddawanie stolca, uczucie niepełnej defekacji) d) wydalanie śluzu e) wzdęcia brzucha 3) Brak objawów alarmowych ze strony przewodu pokarmowego i/lub innych chorób mogących być przyczyną zgłaszanych dolegliwości. |
Należy także zwrócić uwagę na charakterystyczne współistnienie objawów
ze strony układu nerwowego – u ponad połowy pacjentów można rozpoznać mniej
lub bardziej nasiloną depresję, a wiele osób przejawia w różnym stopniu wyrażone zaburzenia osobowościowe. Osoby te w sposób szczególny swoje problemy psychiczne manifestują objawami somatycznymi, zwłaszcza w sytuacjach stresowych i innych zaburzeniach emocjonalnych.
Rycina 2

Wszystkie wyżej wymienione czynniki sprawiają, że znaczne są także koszty nakłady ekonomiczne związane z diagnostyką i leczeniem tego zespołu. Częste, przewlekłe i nasilone dolegliwości są przyczyną absencji chorobowej i wystawiania wielu zaświadczeń lekarskich, częstych wizyt lekarskich i hospitalizacji, wykonywania
i powtarzania dodatkowych badań oraz stosowania wielu leków. Ze względu na brak dostatecznej wiedzy na temat przyczyny powstawania objawów i stosowania prawie wyłącznie leków działających objawowo, niezadowolenie wśród pacjentów
z dotychczasowego leczenia jest ogromne (rycina 2; 3).
Rycina 3

Etiologia
Należy podkreślić, że etiopatologia zespołu jelita drażliwego jest złożona i nadal
nie dokładnie poznana. Aczkolwiek w ostatnich latach nasza wiedza na temat etiologii zespołu IBS wzbogaciła się o istotne elementy (rycina 4). Tradycyjnie wymienia
się na następujące mechanizmy prowadzące do powstawania objawów w tym zespole:
1) zaburzenia motoryki jelit
2) nadwrażliwość trzewna,
3) ograniczony do błony śłuzowej i podśluzowej przewlekły stan zapalny jelit (ang. minimal „inflammatory” bowel state) oraz
4) zaburzenia układu immunologicznego w obrębie błony śluzowej przewodu pokarmowego.
Nowe badania wskazują na istotny związek z powyższymi i udział w patogenezie
5) mikroflory jelitowej i osi mikroflora-mózg-jelito,
6) roli czynników epigenetycznych i stresu we wczesnym okresie życia (ang. early life stress events)
Rycina 4

Zaburzenia motoryki przewodu pokarmowego
W badaniach z użyciem manometru i pomiarów elektrofizjologicznych wykazano, że u pacjentów z IBS często występuje nieprawidłowa motoryka jelit. Do zaburzeń perystaltyki często dochodzi w wyniku ekspozycji na stres lub posiłek. Początkowo uważano, że nieprawidłowości te dotyczą głównie jelita grubego, jednak w ostatnich pracach wykazano, że patologią może być objęty każdy odcinek przewodu pokarmowego. Ponadto wykazano, że zaburzenia w zakresie motoryki przewodu pokarmowego korelują z odczuwanymi przez pacjentów objawami. Dotyczy to także grupy osób z dominującym wzdęciem, u których zaburzenia pasażu dotyczą także gazów jelitowych. Co ciekawe w badaniach eksperymentalnych wskazano na istotny wpływ mikroflory jelitowej na czas pasażu jelitowego i tak u zwierząt doświadczalnych pozbawionych flory jelitowej (tzw. germ-free animals) powszechnie występuje gastropareza, zwolnienie pasażu jelitowego i rozdęcie kątnicy. Kolonizacja tych zwierząt mikroflorą jelitową powoduje ustąpienie patologii i przywrócenie prawidłowej pracy przewodu pokarmowego. Z drugiej strony zaburzenia mikroflory jelitowej mogą prowadzić do nieprawidłowej fermentacji jelitowej z nadmierną, patologiczną produkcją wodoru i metanu, gazami odpowiedzialnymi za zwolnienie pasażu jelitowego i powstanie nadwrażliwości trzewnej, co przez pacjenta odczuwane jest jako bolesne wzdęcie.
Nadwrażliwość trzewna i przewlekły stan zapalny błony śluzowej jelita
Zaburzenia motoryki jelit, jakkolwiek często występują u pacjentów z IBS, to jednak
nie są charakterystyczne wyłącznie dla tego zespołu. W ostatnich latach coraz więcej uwagi lekarze poświęcają tzw. nadwrażliwości trzewnej, które to zjawisko występuje powszechnie u pacjentów z zespołem jelita drażliwego. Obecnie uważa się, że do nadwrażliwości trzewnej dochodzi wtórnie w wyniku aktywacji czynników i elementów układu immunologicznego w błonie śluzowej. Zaburzenia mikroflory jelitowej mogą prowadzić do nieprawidłowej aktywacji układu immunologicznego i utrzymywania się subtelnego ale przewlekłego stanu zapalnego śluzówki jelit. Hipoteza ta wydaje
się mieć potwierdzenie w badaniach tkanek jelitowych, uzyskiwanych podczas badań endoskopowych u pacjentów z IBS, w których wykazano nadmierne gromadzenie komórek tucznych i neutrofilów w błonie śluzowej z towarzyszącym uszkodzeniem zwojów nerwowych. U pacjentów z IBS obserwowano nadmierny rozpad komórek tucznych z uwolnieniem mediatorów stanu zapalnego w bezpośrednim sąsiedztwie zakończeń nerwowych. Z kolei w badaniach in-vitro wykazano, że nadsącz z hodowli zawierających tkankę jelitową pozyskaną za pomocą biopsji od pacjentów z objawami IBS działał drażniąco na zwoje nerwowe w mechanizmie zależnym od rozpadu komórek tucznych. Ponadto u pacjentów z IBS obserwowano nadmierne gromadzenie limfocytów, komórek enterochromatofilnych i zwiększoną przepuszczalność bariery jelitowej. Patologiczną aktywację układu immunologicznego, wywołującą tzw. alert prozapalny można także zaobserwować poprzez pomiar zwiększonego stężenia krążących cytokin zapalnych
we krwi obwodowej. Powyższe obserwowane u pacjentów z IBS zjawiska bezpośrednio korelują z natężeniem odczuwanego przez nich bólu i innych dolegliwości. Współczesny pogląd na etiopatogenezę zespołu jelita drażliwego obrazuje rycina 5.
Rycina 5
Uproszczony schemat obrazujący współczesne poglądy na patogenezę IBS

Od dawna wiadomo, że przebyte zakażenie przewodu pokarmowego, wirusowe
czy bakteryjne może prowadzić do wystąpienia tzw. poinfekcyjnego zespołu jelita drażliwego. Obserwacje te poczyniono jeszcze w toku badań epidemiologicznych przeprowadzonych w latach 60 tych ubiegłego stulecia. Obecnie uważa się, że prawie 1/3 pacjentów z IBS rozwija objawy ze strony przewodu pokarmowego po przebytej infekcji. Czynnikiem etiologicznym, często nie diagnozowanym, jest najczęściej zakażenie bakteryjne (salmonella, shigella czy campylobacter jejuni), wirusowe (noro-wirusy)
i/lub pasożytnicze (Giardia intestinalis i duodenalis) (tabela 2).
Tabela 2. Rola czynników infekcyjnych w patogenezie zespołu jelita drażliwego

Uważa się ponadto, że ryzyko wystąpienia objawów IBS po przebytej infekcji wzrasta co najmniej pięciokrotnie i zależy od kilku dodatkowych czynników, które korelują ze stopniem nasilenia objawów. Do nich można zaliczyć: a) czas trwania infekcji jelitowej – im dłuższe zakażenie tym większe ryzyko wystąpienia zespołu, b) młodszy wiek – większe ryzyko, oraz c) współwystępowanie objawów depresyjnych lub lękowych ze strony układu nerwowego w czasie zakażenia przewodu pokarmowego, d) płeć żeńską,
e) palenie papierosów, a także f) stopień wirulencji czynnika zakaźnego oraz g) przebytą kurację antybiotykową. Pomimo, że istnieje tendencja do zmniejszania bądź samoistnego wycofywania się dolegliwości, u znacznej liczby pacjentów objawy mogą utrzymywać się nawet przez okres 6 lat jaki upłynął od zakażenia.
Mikroflora jelitowa w zespole jelita drażliwego
W chwili przyjścia na świat człowieka przewód pokarmowy jest zasiedlany przez tysiące mikroorganizmów, które wchodzą w skład mikroflory jelitowej tworząc zintegrowany, spójny, dobrze funkcjonujący ekosystem. Mikroflora jelitowa jest niezwykle zróżnicowana i złożona. Należy wskazać na szereg trudności diagnostycznych w zakresie flory jelitowej, a mianowicie na fakt, że większość mikroorganizmów nie podlega hodowlom in-vitro i nie wzrasta na pożywkach hodowlanych. Jednak wraz z pojawieniem się nowych metod diagnostycznych z wykorzystaniem technik biologii molekularnej,
w ostatnim czasie można już dokonywać szczegółowej analizy bakterii wchodzących w skład mikroflory przewodu pokarmowego (rycina 6).
Rycina 6

Mikroflora jelitowa i produkty fermentacji bakteryjnej biorą udział w regulacji wielu szlaków metabolicznych, warunkują prawidłową pracę układu pokarmowego i immunologicznego i są odpowiedzialne za utrzymanie prawidłowej gospodarki metabolicznej organizmu. W ostatnich latach wykazano związek mikroflory jelitowej z wieloma stanami patologicznymi a w szczególności z otyłością, chorobą trzewną, cukrzycą, chorobami wątroby, chorobami zapalnymi jelit i nowotworami przewodu pokarmowego. Zaburzenia w zakresie mikroflory jelitowej występują też powszechnie we zespole jelita drażliwego. Możemy wyróżnić różne populacje bakterii wchodzące w skład flory jelitowej – tą część, która bytuje w świetle jelita, odpowiedzialna głównie za procesy metaboliczne oraz populację bakterii związanych z błoną śluzową jelita. Ta ostatnia grupa jest odpowiedzialna m.in. za aktywację układu immunologicznego
i interakcję z włóknami wypustek nerwowych w ścianie jelita. U pacjentów z IBS występują zarówno ilościowe jak i jakościowe zaburzenia mikroflory jelitowej w porównaniu do osób zdrowych. W badaniach z wykorzystaniem technik biologii molekularnej u pacjentów z IBS stwierdzono obniżenie lub brak pałeczek kwasu mlekowego oraz bifidobakterii wraz ze wzrostem drobnoustrojów z grupy patogennych szczepów i gatunków Clostridia i Enterobacteriacae. Dokonując analizy molekularnej flory jelitowej w zależności od rodzaju dominujących objawów wykazano, że pacjenci z postacią biegunkową mają znacznie zmniejszoną liczbę pałeczek kwasu mlekowego, natomiast wśród osób z zaparciem dominują formy z gatunku Veillonella. Ponadto wskazano na znaczną niestabilność populacji bakteryjnych u pacjentów z IBS w porównaniu do osób zdrowych. Ta obserwacja pozwala tłumaczyć, dlaczego niewielki stres, błąd dietetyczny lub potencjalnie banalny czynnik zakaźny może nasilać dysbiozę i wywoływać objawy. Zmiany ilościowe flory jelitowej mogą nasilać fermentację jelitową i procesy dekoniguacji kwasów żółciowych
w jelicie cienkim i grubym. Procesy te mogą wpływać na zmianę krążenia i wydalania kwasów żółciowych w jelicie grubym a tym samym wpływać na jego motorykę.
Dysbioza i zaburzenia osi mózgowo-jelitowej w IBS
Infekcja jelitowa może prowadzić do tzw. dysbiozy czyli zaburzeń w obrębie ekosystemu i mikroflory jelitowej, który to stan w konsekwencji jest odpowiedzialny za wystąpienie przewlekłej reakcji zapalnej błony śluzowej jelit. Należy wspomnieć, że także inne czynniki mogą negatywnie oddziaływać na mikroflorę jelitową i prowadzić do dysbiozy. Wśród nich można wymienić m.in. stosowane leki (najczęściej antybiotyki
i niesterydowe leki przeciwzapalne [NLPZ]), dietę bogatą w tłuszcze zwierzęce i sztuczne węglowodany oraz przewlekły stres fizyczny i psychiczny (rycina 7).
Rycina 7

W niedawno opublikowanej pracy, wykazano istotne zaburzenia mikroflory jelitowej u pacjentów poddawanych krótkotrwałej antybiotykoterapii mającej na celu eradykację Helicobacter pylori. Szczegółowa analiza molekularna mikroflory jelitowej u niektórych pacjentów wykazywała znaczne zmniejszenie populacji bakterii gram dodatnich, w tym pałeczek kwasu mlekowego i bifidobakterii wraz ze wzrostem populacji bakterii proteolitycznych, odpowiedzialnych za nieprawidłową fermentację i produkcję gazów jelitowych. Ponadto stwierdzono wysoką aktywację genów antybiotykooporności mikrobiomu bakterii jelitowych u tych pacjentów. Zaburzenia ilościowe i jakościowe różnych składu populacji bakteryjnych utrzymywały się przez okres 4 lat od zakończenia kuracji antybiotykowej (rycina 8). U części pacjentów z IBS opisywano także zespół przerostu flory bakteryjnej w jelicie cienkim (ang. small intestinal bacterial overgrowth – SIBO) a jego występowanie korelowano z nasileniem objawów. W zespole tym dochodzi do nieprawidłowej kolonizacji nabłonka proksymalnej części jelita cienkiego przez bakterie produkujące duże ilości wodoru i metanu, co prowadządzi do zaburzeń motoryki jelit. Należy jednak zaznaczyć, że istnieją problemy natury metodologicznej w diagnozowaniu zespołu SIBO a jego znaczenie w patogenezie IBS pozostaje nadal tematem licznych naukowych sporów i kontrowersji.
Rycina 8

Bezsporne z kolei są obserwacje, że u osób z IBS w wyniku przetrwałej reakcji zapalnej błony śluzowej stwierdza się zwiększone wartości cytokin prozapalnych w obrębie błon śluzowych i krążeniu obwodowym, a ich stężenia bezpośrednio korelują ze stopniem nasileniem dolegliwości bólowych i utrzymywaniem się objawów. U tych pacjentów za pomocą nowoczesnych technik obrazowania układu nerwowego, można wykazać zaburzenia osi mózgowo-jelitowej, nadmierną aktywację układu podwzgórze – przysadka - nadnercza i dysfunkcję obwodowych zakończeń nerwowych w nabłonku jelitowym. Obserwacje te potwierdzono także w badaniach doświadczalnych, w których wykazano, że zwiększone stężenia czynnika martwicy nowotworów TNF-alfa i interleukiny-6 pochodzenia jelitowego w krążeniu obwodowym, negatywnie oddziałują na oś mózgowo-jelitową. Opisane mechanizmy mogą w pewnym stopniu tłumaczyć występowanie nieprawidłowych stanów emocjonalnych i zaburzeń depresyjnych u pacjentów z IBS. W najnowszych badaniach wykazano, że stopień zapalenia błony śluzowej jelitu zwierząt laboratoryjnych był skorelowany z występowaniem u nich epizodów lękowych. Dodatkowo stwierdzono mniejszą ekspresję BDNF (ang. Brain Derived Neurotropic Factor) na poziomie mRNA w obrębie struktury hipokampa, wzrost stężenia krążącego w surowicy TNF-alfa i białka kynureniny. Z kolei stwierdzono zmniejszoną ekspresję niektórych białek, niezbędnych do prawidłowej pracy mózgu. Co ciekawe zastosowanie przeciwciał monoklonalnych anty-TNF-alfa bądź leków immunosupresyjnych lub niektórych szczepów bakterii probiotycznych powodowało wycofywanie się opisywanych zmian.
Mikroflora jelitowa jako czynnik epigenetyczny w IBS
Epigenetyka zajmuje się badaniem zmienności i wpływem na ekspresję genów, które to zjawiska nie wpływają na pierwotną zmianę sekwencji DNA. Jednym z najlepiej poznanych mechanizmów epigenetycznych jest proces metyzacji DNA i modyfikacji białek histonowych. Uważa się, że stopień metylacji materiału genetycznego jest odwrotnie proporozjonalny do aktywności genu. U pacjentów z IBS stwierdzono istotne zaburzenia metylacji genu dla receptora glikosterydowego. Prawdopodobnie zmiany te zachodzą na drodze epigenetycznej we wczesnym etapie życia a mikroorganizmy i ich produkty odgrywają ważną rolę w tym procesie. W tym okresie niezmiernie istotny jest też wpływ flory jelitowej na rozwój osi podwzgórze – przysadka - nadnercza. W przypadku występowania dysbiozy dochodzi do nieprawidłowości w rozwoju i funkcji tego układu, a zmiany te utrzymują się przez całe życie osobnicze. Bakterie jelitowe odgrywają także istotna rolę w regulacji układu immunologicznego poprzez syntezę molekuł
i oligonukleotydów, które wchodzą w interakcję z receptorami TLR i pełnią funkcję ochronne. Należy podkreślić, że czynniki stresowe występujące we wczesnym okresie życia warunkują skład i różnorodność mikroflory jelitowej a także elementów odpowiedzi immunologicznej nieswoistej i mają swój udział w patogenezie zespołu jelita drażliwego na dalszych etapach życia.
Modulacja flory jelitowej jako nowe leczenie przyczynowe w zespole jelita drażliwego
Modulacja mikroflory jelitowej za pomocą probiotyków i prebiotyków a także antybiotyków stanowi obecnie bardzo obiecującą strategię leczniczą. Ponieważ przewlekła i powtarzana kuracja antybiotykowa niesie za sobą wiele zagrożeń, wydaje się, że bakterie probiotyczne otworzyły nowe horyzonty w leczeniu pacjentów z objawami zespołu jelita drażliwego. Pomimo, że do tej pory nie wykazano efektu terapeutycznego dla grupy probiotyków, a jedynie dla konkretnych szczepów probiotycznych, wydaje się, że wybrane probiotyki znajdą swoje miejsce w postępowaniu terapeutycznym u pacjentów z IBS. Należy przypomnieć, że efekt jaki wywołuje probiotyk jest ściśle związany z konkretnym, użytym w badaniu szczepem, a ekstrapolacja uzyskanych wyników na inne bakterie probiotyczne jest niedozwolona. Jaki powinien być więc idealny probiotyk, który można zarekomendować lekarzom i ich pacjentom z zespołem jelita drażliwego? (rycina 9).
Rycina 9
Miejsce probiotyków w leczeniu zespołu jelita drażliwego

Przede wszystkim powinien charakteryzować się doskonałym profilem bezpieczeństwa. Ponadto wyboru można dokonać w oparciu o mechanizm jego działania a także mechanizmy patogenetyczne zespołu jelita drażliwego: zaburzenia mikroflory jelitowej i osi mózgowo-jelitowej, przewlekły stan zapalny śluzówki jelit i nadmierny rozpad komórek tucznych, upośledzenie bariery jelitowej i patologiczna aktywacja układu immunologicznego. Mechanizm działania powinien być udokumentowany w badaniach in-vitro i in-vivio a jego skuteczność potwierdzona w dobrze zaplanowanych, randomizowanych i kontrolowanych z podwójnie ślepą próbą z placebo badaniach klinicznych.
Podsumowanie
Zespół jelita drażliwego jest przewlekłą chorobą o złożonej etiologii. Badania ostatnich lat wskazują na znaczny wpływ mikroflory i osi mózgowo-jelitowej w patogenezie objawów. Modulacja mikroflory jelitowej za pomocą probiotyków i prebiotyków otwiera nowe, obiecujące możliwości w leczeniu pacjentów z tym zespołem. Rekomendacje dotyczące stosowania probiotyków w IBS powinny uwzględniać udokumentowany w badaniach in-vitro i in-vivo mechanizm ich działania oraz potwierdzone bezpieczeństwo i skuteczność w przeprowadzonych, dobrze zaplanowanych badaniach klinicznych u ludzi.
Dr n. med. Wojciech Marlicz
Klinika Gastroenterologii Pomorskiego Uniwersytetu Medycznego w Szczecinie



