Funkcjonowanie poznawcze po przebytej infekcji SARS-CoV-2

Badania epidemiologiczne potwierdzają związek między chorobami neuropsychiatrycznymi a infekcjami wirusowymi. Procesy zapalne mogą wpływać na funkcjonowanie mózgu, powstawanie chorób neurodegeneracyjnych i prawdopodobnie ujawnianie się chorób psychicznych. Deficyty poznawcze są częstym i poważnym problemem u pacjentów z czynną infekcją SARS-CoV-2 i u osób, które przeszły COVID-19.
Autorka: Monika Talarowska
Wstęp
W pierwszych miesiącach pandemii wirusa SARS-CoV-2 doniesienia naukowe, ale również działania podejmowane na pierwszej linii frontu walki z nim koncentrowały się wokół łagodzenia objawów zespołu ostrej niewydolności oddechowej (severe acute respiratory syndrome coronavirus 2) (Bodnar i wsp. 2021). Takie postępowanie z pewnością było słuszne, gdyż to właśnie te symptomy najczęściej prowadziły i prowadzą do śmierci pacjentów. Jednak dziś, po ponad roku od ogłoszenia pierwszych przypadków zarażenia, wiemy, że odległe symptomy infekcji koronawirusem-2 daleko wykraczają poza utrzymujące się osłabienie układu oddechowego. Tematykę przedstawioną w niniejszym artykule autorka poruszała w jednej ze swoich wcześniejszych publikacji już w 2010 r. (Grypa i infekcje grypopochodne a funkcje poznawcze; Talarowska i wsp. 2010). Obecność objawów neuropoznawczych obserwowanych w przebiegu lub w konsekwencji zarażenia wirusem SARS-CoV-2 nie powinna być zaskoczeniem. Zaskakujące są natomiast ich nasilenie i czas trwania.
Prezentowana praca jest podsumowaniem dostępnych wyników badań oraz analiz teoretycznych dotyczących poznawczych konsekwencji infekcji koronawirusem-2. Przygotowując ją, autorka korzystała z doniesień naukowych prezentowanych w bazie PubMed (dostęp z 31.01.2021 r.; słowa kluczowe: cognition, cognitive functions, SARS-CoV-2, COVID-19, dysexecutive syndrome).
Neuro-SARS2 – najbardziej typowy obraz
W dostępnej literaturze można odnaleźć dwa nowe terminy, stworzone dla określenia deficytów neurologicznych, neuropoznawczych i neuropsychiatrycznych obserwowanych w przebiegu infekcji koronawirusem-2: Neuro-SARS oraz NeuroCOVID (neurological symptoms and neuropsychiatric disorders related to COVID-19) (Oliveira i wsp. 2021).
Zdaniem Ellula i wsp. (2020) oraz Mao i wsp. (2020) ponad jedna trzecia pacjentów w ostrej fazie COVID-19 prezentuje objawy typowe dla NeuroCOVID, zwykle występujące w ciągu pierwszych kilku dni jawnej symptomatologii klinicznej (tab. 1). Wśród pacjentów przebywających na oddziałach intensywnej opieki medycznej objawy te występują u ponad 80% (Helms i wsp. 2020). Co więcej, obecność symptomów z tej grupy wydaje się istotnym czynnikiem cięższego przebiegu choroby oraz zwiększa ryzyko zgonu (Li i wsp. 2020).
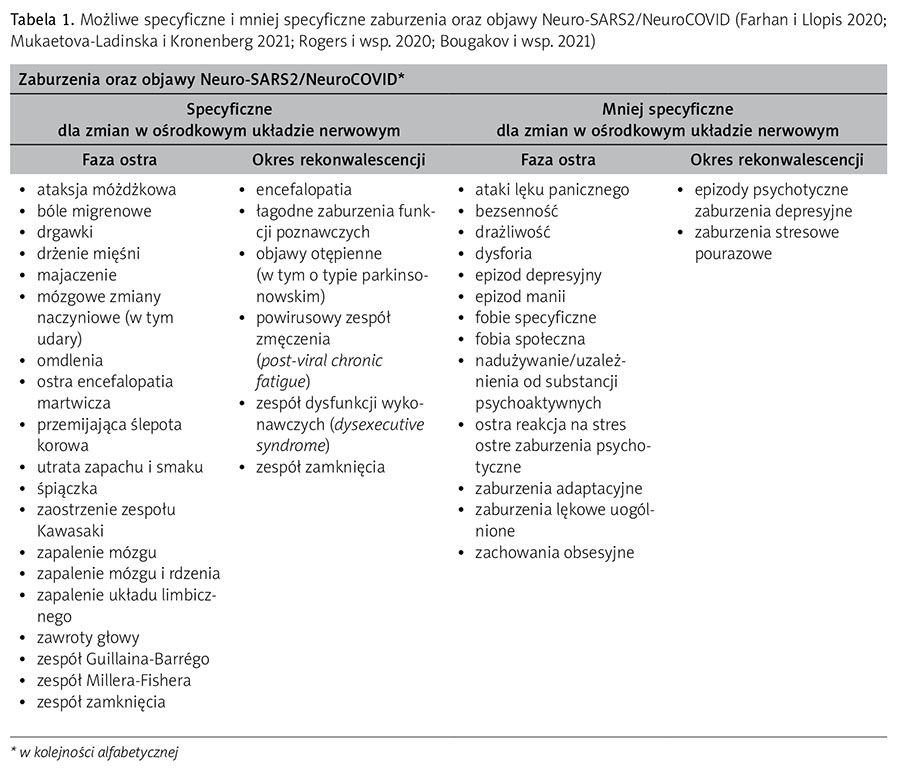
Wśród jednostek chorobowych wymienionych w tabeli 1 najczęściej są obserwowane zawroty i bóle głowy, utrata smaku i węchu, nasilony niepokój, objawy depresyjne oraz majaczenie (Banerjee i Viswanath 2020). Zdaniem Mao i wsp. (2020) nasilenie objawów neurologicznych jest powiązane z ciężkością przebiegu choroby, poziomem stężenia przeciwciał w surowicy oraz liczbą limfocytów we krwi badanych. Udary, encefalopatie oraz obwodowe neuropatie występują znacznie rzadziej, głównie u osób starszych i z obniżoną odpornością (Mao i wsp. 2020). Warto wspomnieć o istnieniu teoretycznego ryzyka, że każdy pacjent zakażony koronawirusem może rozwinąć objawy podobne do otępienia w przebiegu choroby Parkinsona (w modelach zwierzęcych wirus namnaża się bowiem w jądrach podstawy mózgu) (Fishman i wsp. 1985).
Pierwsze doniesienia naukowe dotyczące powirusowych zmian mózgowych pojawiły się już na początku XX w. Zapalenie mózgu von Economo to zapalenie mózgu o przypuszczalnie wirusowej etiologii. Zostało ono opisane w 1917 r. przez Constantina von Economo, w trakcie panującej w Europie epidemii grypy hiszpanki. Występowało ono epidemicznie, początkowo, od 1915 r., na Starym Kontynencie, a później na całym świecie (pandemia śpiączkowego zapalenia mózgu przypadła na lata 1917–1924). Choroba występowała sezonowo, nawracając między styczniem a marcem każdego roku (Banerjee i Viswanath 2020).
Przyczyny zaburzeń funkcji poznawczych w przebiegu infekcji SARS-CoV-2
Wyniki dostępnych badań klinicznych wskazują, że do zmian czynnościowych oraz anatomicznych w przebiegu infekcji wirusem SARS-CoV-2 może dochodzić na kilka sposobów. Przede wszystkim wirus może bezpośrednio atakować mózg (poprzez nerw węchowy rozprzestrzenia się do pnia mózgu i innych jego obszarów, a także przedostaje się do płynu mózgowo-rdzeniowego; Li i wsp. 2020b).
Możliwe jest również zainfekowanie mózgu rozpoczynające się od bezpośredniego przerwania nerwów obwodowych w wyniku naruszenia ciągłości skóry – transmisja międzysynaptyczna wielu koronawirusów nie budzi dziś wątpliwości; Li i wsp. 2020b). Obecność koronawirusa 2 potwierdzono w neuronach, mikrogleju, astrocytach, komórkach śródbłonka, komórkach wyściółki oraz w nerwowych komórkach macierzystych (neural stem cells – NSC) (Sinanović i wsp. 2020).
Badania autopsyjne przeprowadzane w czasie epidemii SARS w 2004 r. wykazały obecność wirusa SARS-CoV-1 przede wszystkim w korze mózgowej oraz podwzgórzu chorych, a także w płynie mózgowo-rdzeniowym (Lau i wsp. 2004). W przypadku koronawirusa 2 wyniki badań nad płynem mózgowo-rdzeniowym pobranym od pacjentów nie dają jednoznacznych odpowiedzi (Andriuta i wsp. 2020).
Kolejnym możliwym mechanizmem uszkodzeń jest etiologia naczyniowa oraz zapalna, obejmująca cały organizm lub tylko mózg. Jednak nadal nie jest pewne, czy zmiany te są bezpośrednią konsekwencją infekcji, czy też następstwem całej kaskady procesów zachodzących w organizmie w jej wyniku (tzw. burza cytokinowa oraz neurozapalenie) (Carossino i wsp. 2020; Mehta i wsp. 2020). Prawdopodobny mechanizm patofizjologiczny może być powiązany z osłabieniem układu odporności wrodzonej, stanowiącego pierwszą linię obrony gospodarza, a także ze zmianami w morfologii komórek odpornościowych (tzw. efekt cytotoksyczny), czy nawet z procesem autoimmunizacji (Jasti i wsp. 2021; Pantelis i wsp. 2021).
Istota biała mózgu jest szczególnie podatna na uszkodzenia niedokrwienne w przebiegu COVID-19 (Bougakov i wsp. 2021), ma również kluczowe znaczenie dla prawidłowej sprawności poznawczej (Forkel i wsp. 2021). Istnieje coraz więcej dowodów na to, że hipoperfuzja mózgowa przyspiesza akumulację amyloidu β (Aβ) i jest powiązana z patologią białka tau oraz TDP-43 (Miners i wsp. 2020). Kolejnym obszarem mózgu wrażliwym na infekcje koronawirusowe są układy hipokampa, co zwiększa prawdopodobieństwo deficytów pamięci oraz ryzyko wystąpienia objawów choroby Alzheimera w późniejszym czasie (Ritchie i wsp. 2020).
Poziom doświadczanego stresu, związanego pośrednio i bezpośrednio z infekcją wirusową, również może być istotnym czynnikiem ryzyka rozwoju deficytów poznawczych w przebiegu infekcji wirusem SARS-CoV-2 [zdaniem Quinn i Joormann (2015) efektywność funkcji wykonawczych oraz kontroli poznawczej słabnie wraz z nasilającym się poziomem stresu]. Nadmierne pobudzenie osi podwzgórze–przysadka–nadnercza (hypothalamic–pituitary–adrenal axis – oś HPA), uruchamiając szereg mechanizmów sprzężenia zwrotnego, prowadzi do nadmiernego uwalniania hormonów steroidowych upośledzających zwrotnie funkcjonowanie układu odpornościowego. Zmiany te mogą przyspieszyć infekcję lub pogorszyć jej przebieg, a w dalszej perspektywie prowadzić do szeregu opisanych powyżej objawów neuropsychiatrycznych i neuropoznawczych (Dinakaran i wsp. 2020). Warto również zauważyć, że poziomy cytokin prozapalnych w osoczu krwi (np. interleukiny (IL)-6, czynnika martwicy nowotworu α (TNF-α), IL-8, IL-10, IL-2R) były znacznie wyższe u pacjentów z infekcją koronawirusa 2, którzy zmarli, co może leżeć u podstaw wspomnianej encefalopatii (Troyer i wsp. 2020).
Strukturą mózgu szczególnie podatną na zmiany funkcjonalne wywołane stresem i dysregulacją osi HPA są układy hipokampów. Dochodzi wówczas m.in. do spadku ekspresji czynnika neurotroficznego pochodzenia mózgowego (brain-derived neurotrophic factor – BDNF), osłabienia długotrwałego wzmocnienia synaptycznego (long-term potentiation – LTP) oraz zahamowania neurogenezy w zakręcie zębatym (dentate gyrus – DG) (Talarowska i Gałecki 2016). Kortykosteroidy, których nadmierne wydzielanie stwierdza się w sytuacjach stresogennych, w tym w zaburzeniach depresyjnych, nie tylko wywierają silny negatywny wpływ na rejon hipokampa i ciała migdałowatego, lecz także upośledzają funkcjonowanie kory przedczołowej, zaangażowanej w prawidłowy przebieg funkcji wykonawczych (Krause-Utz i wsp. 2012).
W wielu wcześniejszych pracach autorka wykazywała bezpośredni związek cytokin pro- i przeciwzapalnych z osłabieniem efektywności poznawczej badanych, szczególnie w zakresie sprawności funkcji wykonawczych (Talarowska i wsp. 2012; Talarowska i wsp. 2014a; Talarowska i wsp. 2014b; Talarowska i wsp. 2015a; Talarowska i wsp. 2015b) (z uwagi na temat niniejszej pracy autorka odsyła zainteresowanych czytelników do tych publikacji). Mechanizmy te wydają się mieć istotne znaczenie również w przypadku deficytów poznawczych powiązanych z infekcją wirusem SARS-CoV-2.
Warto podkreślić, że niezależnie od przebytej lub aktywnej infekcji wirusem SARS-CoV-2 zaburzenia zmysłu węchu w postaci jego utraty (anosmia) lub osłabienia (hiposmia) są obserwowane zarówno u pacjentów z objawami depresji (Wang i wsp. 2020), jak i z potwierdzonymi deficytami poznawczymi (Yahiaoui-Doktor i wsp. 2019), a markery aktywnego procesu zapalnego są jednymi z istotnych czynników osłabiających barierę krew–mózg (Bobińska i wsp. 2016).
Funkcje poznawcze a COVID-19
W dalszej części artykułu zostanie przedstawiona analiza możliwych objawów ze sfery poznawczej, które można zauważyć u pacjentów w trakcie aktywnej infekcji koronawirusem-2 lub po jej zakończeniu (ryc. 1).
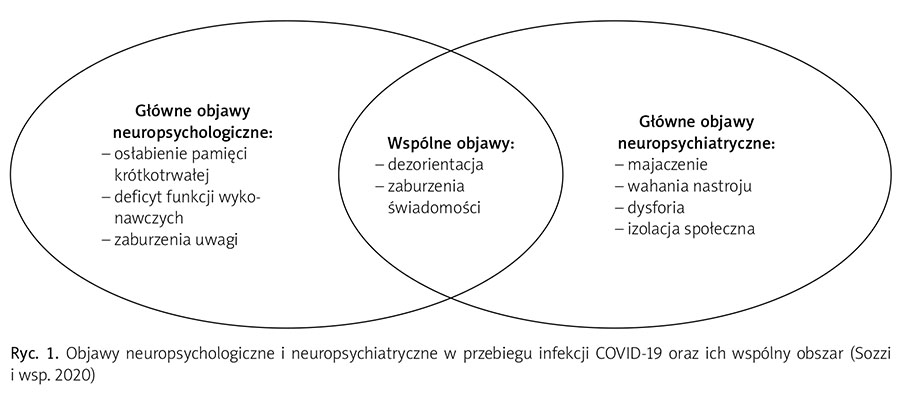
Przebieg zaburzeń funkcji poznawczych w tej grupie chorych jest zróżnicowany – od deficytów wybiórczych, specyficznych i łagodnych po zmiany uogólnione i znacznie nasilone. Pogorszenie funkcjonowania poznawczego może dotyczyć różnych jego aspektów. Wśród częstych objawów wymienia się: osłabienie pamięci krótkotrwałej, osłabienie funkcji uwagi oraz funkcji wykonawczych (m.in. trudności z hamowaniem reakcji, planowaniem i rozwiązywaniem problemów, osłabienie elastyczności poznawczej) (Li i wsp. 2021).
Należy pamiętać, że ocena funkcjonowania poznawczego pacjentów z COVID-19 nie może się ograniczać do stosowania tzw. testów przesiewowych pozwalających na ocenę globalnego poziomu funkcjonowania poznawczego! (Sozzi i wsp. 2020).
Łagodne zaburzenia funkcji poznawczych
Pojęcie „łagodne zaburzenia funkcji poznawczych” (mild cognitive impairment – MCI) przez lata było utożsamiane ze stanem przejściowym pomiędzy niezaburzonym funkcjonowaniem poznawczym a objawami choroby Alzheimera. Obecnie używa się go w szerszym znaczeniu – w odniesieniu do pacjentów bez rozpoznanego otępienia, jednak z widocznymi deficytami poznawczymi, u których istnieje duże ryzyko przejścia choroby w otępienie (Szcześniak i Rymaszewska 2016).
Ogólne kryteria rozpoznawania MCI opracowane przez National Institute on Aging są następujące: 1) zaniepokojenie związane ze zmianą sprawności poznawczej; 2) pogorszenie dotyczące jednego lub kilku obszarów poznawczych; 3) zachowanie samodzielnej zdolności codziennego funkcjonowania; 4) brak otępienia (Albert i wsp. 2011) (tab. 2).

Łagodne zaburzenia poznawcze w postaci osłabienia efektywności pamięci krótkotrwałej oraz procesów uwagi obserwuje się zarówno u osób starszych (po 65. roku życia), jak i wśród młodych pacjentów z łagodnym przebiegiem infekcji koronawirusem-2 (Chung i wsp. 2020; Woo i wsp. 2020).
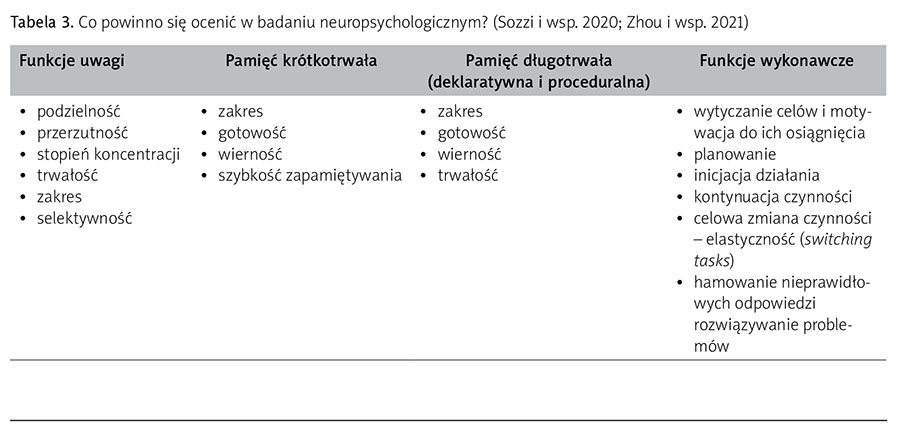
Podłużne badania nad osobami, które z różnych przyczyn chorobowych wymagały stosowania technik wspomagania oddechu, wykazały utrzymujące się osłabienie efektywności procesów uwagi, pamięci krótkotrwałej, płynności werbalnej, szybkości przetwarzania informacji oraz funkcji wykonawczych. Po roku od wypisania z oddziału intensywnej opieki medycznej opisane objawy nadal występowały u 78% pacjentów, a po upływie dwóch lat – u ponad 50% z nich (Mikkelsen i wsp. 2012). Wyniki cytowanych badań mogą mieć istotne znaczenie w przypadku pacjentów z cięższym przebiegiem infekcji koronawirusem-2 (tab. 3).
Zespół dysfunkcji wykonawczych
Drugą grupą objawów neuropoznawczych obserwowanych u chorych w trakcie lub po przebytej infekcji koronawirusem-2 są objawy zespołu dysfunkcji wykonawczych (dysexecutive syndrome) (Ortelli i wsp. 2021). Helms i wsp. (2020) zaobserwowali objawy tego zespołu u 14 pacjentów z 39-osobowej grupy zainfekowanej wirusem SARS-CoV-2. Porównywalne rezultaty uzyskali Zhou i wsp. (2020) w przeprowadzonym przez siebie badaniu (29 „ozdrowieńców” w wieku 30–64 lata oraz 29 osób bez przebytej infekcji koronawirusem-2), w którym wykorzystano test łączenia punktów (Trail Making Test – TMT), test ciągłego wykonania (Continuous Performance Test – służy do oceny procesów uwagi, a dokładnie zaburzeń ciągłości i selektywności uwagi i jej odporności na dystraktory) oraz test powtarzania cyfr. W badaniu oceniano również stężenie wybranych cytokin: IL-2, IL-4, IL-6, IL-10, TNF-α, interferon γ (IFN-γ) oraz białko C-reaktywne (C-reactive protein – CRP). Autorzy odnotowali nie tylko słabsze wykonanie wymienionych testów w grupie „ozdrowieńców” w porównaniu z osobami zdrowymi, lecz także korelację uzyskanych wyników ze stężeniem oznaczonych cytokin (Zhou i wsp. 2020) (tab. 4).

Co można zrobić?
Badania epidemiologiczne potwierdzają związek między chorobami neuropsychiatrycznymi a infekcjami wirusowymi. Procesy zapalne (o ostrym i przewlekłym charakterze) mogą mieć wpływ na funkcjonowanie rozwijającego się mózgu, powstawanie chorób neurodegeneracyjnych oraz prawdopodobnie ujawnianie się niektórych chorób psychicznych, głównie schizofrenii i chorób neurodegeneracyjnych (Talarowska i wsp. 2010). W diagnozie neuropsychologicznej pacjentów po przebytej infekcji wirusem SARS-CoV-2 należy również uwzględnić możliwe interakcje czynników biologicznych oraz psychologicznych związanych z sytuacją zachorowania (osamotnienie, brak kontaktów z bliskimi, lęk o zdrowie i życie) (Talarowska i wsp. 2020).
Warto pamiętać, że dominujące obecnie obawy związane z ryzykiem zakażenia, męczące wszystkich ograniczenia i konieczność izolacji miną. Co prawda nie wiadomo, jak długo może jeszcze potrwać obecna sytuacja, jednak konieczne jest zwrócenie uwagi na możliwe długoterminowe konsekwencje poznawcze przebytej infekcji wirusem SARS-CoV-2 (Negrini i wsp. 2021). Ponadto zmiany w ośrodkowym oraz obwodowym układzie nerwowym, obserwowane w przebiegu zakażenia wirusem SARS-CoV-2 mogą w niedalekiej przyszłości znacznie zwiększyć częstość występowania chorób neurodegeneracyjnych (Verkhratsky i wsp. 2020).
Konieczne w przypadku wystąpienia nasilonych objawów neurologicznych wydaje się również przeprowadzenie szczegółowej diagnostyki neuropsychologicznej w opisanym powyżej zakresie. Może się to przyczynić w znaczącym stopniu do złagodzenia cierpienia pacjentów oraz ich rodzin oraz przyspieszyć powrót do zdrowia.
Piśmiennictwo
1. https://www.statista.com/statistics/1087466/covid19-cases-recoveries-deaths-worldwide/ (dostęp: 31.01.2021 r.).
2. Albert MS, DeKosky ST, Dickson D i wsp. The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement 2011; 7: 270-279.
3. Andriuta D, Roger PA, Thibault W i wsp. COVID-19 encephalopathy: detection of antibodies against SARS-CoV-2 in CSF. J Neurol 2020; 267: 2810-2811.
4. Banerjee D, Viswanath B. Neuropsychiatric manifestations of COVID-19 and possible pathogenic mechanisms: Insights from other coronaviruses. Asian J Psychiatr 2020; 54: 102350.
5. Bobińska K, Szemraj J, Czarny P, Gałecki P. Role of MMP-2, MMP-7, MMP-9 and TIMP-2 in the development of recurrent depressive disorder. J Affect Disord 2016; 205: 119-129.
6. Bodnar B, Patel K, Ho W i wsp. Cellular mechanisms underlying neurological/neuropsychiatric manifestations of COVID-19. J Med Virol 2021; 93: 1983-1998.
7. Bougakov D, Podell K, Goldberg E. Multiple neuroinvasive pathways in COVID-19. Mol Neurobiol 2021; 58: 564-575.
8. Carossino M, Ip HS, Richt JA i wsp. Detection of SARS-CoV-2 by RNAscope® in situ hybridization and immunohistochemistry techniques. Arch Virol 2020; 165: 2373-2377.
9. Chan RC. Dysexecutive symptoms among a non-clinical sample: a study with the use of the Dysexecutive Questionnaire. Br J Psychol 2001; 92 (Pt 3): 551-565.
10. Chung HY, Wickel J, Brunkhorst FM, Geis C. Sepsis-associated encephalopathy: from delirium to dementia? J Clin Med 2020; 9: 703.
11. Dinakaran D, Manjunatha N, Kumar CN, Suresh BM. Neuropsychiatric aspects of COVID-19 pandemic: A selective review. Asian J Psychiatr 2020; 53: 102188.
12. Ellul MA, Benjamin L, Singh B i wsp. Neurological associations of COVID-19. Lancet Neurol 2020; 19: 767-783.
13. Farhan R, Llopis P. Psychiatric and neuropsychiatric syndromes and COVID-19. Lancet Psychiatry 2020; 7: 736.
14. Fishman PS, Gass JS, Swoveland PT i wsp. Infection of the basal ganglia by a murine coronavirus. Science 1985; 229: 877-879.
15. Forkel SJ, Friedrich P, Thiebaut de Schotten M, Howells H. White matter variability, cognition, and disorders: a systematic review. Brain Struct Funct 2021. doi: 10.1007/s00429-021-02382-w.
16. Helms J, Kremer S, Merdji H. Neurologic features in severe SARS-CoV-2 infection. N Engl J Med 2020; 382: 2268-2270.
17. Jasti M, Nalleballe K, Dandu V, Onteddu S. A review of pathophysiology and neuropsychiatric manifestations of COVID-19. J Neurol 2021; 268: 2007-2012.
18. Krause-Utz A, Oei NY, Niedtfeld I i wsp. Influence of emotional distraction on working memory performance in borderline personality disorder. Psychol Med 2012; 42: 2181-2192.
19. Lau KK, Yu WC, Chu CM i wsp. Possible central nervous system infection by SARS coronavirus. Emerging. Infect Dis 2004; 10: 342-344.
20. Li H, Xue Q, Xu X. Involvement of the nervous system in SARS-CoV-2 infection. Neurotox Res 2020a; 38: 1-7.
21. Li J, Long X, Zhang Q i wsp. Emerging evidence for neuropsycho-consequences of COVID-19. Curr Neuropharmacol 2021; 19: 92-96.
22. Li YC, Bai WZ, Hashikawa T. The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients. J Med Virol 2020b; 92: 552-555.
23. Mao L, Jin H, Wang M i wsp. Neurologic manifestations of hospitalized patients with coronavirus disease 2019 in Wuhan, China. JAMA Neurol 2020; 77: 683-690.
24. Mehta P, McAuley DF, Brown M i wsp., on behalf of the HLH Across Speciality Collaboration, UK. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet 2020; 395: 1033-1034.
25. Mikkelsen ME, Christie JD, Lanken PN i wsp. The adult respiratory distress syndrome Cognitive outcomes study. Am J Respir Crit Care Med 2012; 185: 1307-1315.
26. Miners S, Kehoe PG, Love S. Cognitive impact of COVID-19: looping beyond the short term. Alzheimers Res Ther 2020; 12: 170.
27. Mukaetova-Ladinska EB, Kronenberg G. Psychological and neuropsychiatric implications of COVID-19. Eur Arch Psychiatry Clin Neurosci 2021; 271: 235-248.
28. Negrini F, Ferrario I, Mazziotti D i wsp. Neuropsychological features of severe hospitalized coronavirus disease 2019 patients at clinical stability and clues for Postacute Rehabilitation. Arch Phys Med Rehabil 2021; 102: 155-158.
29. Oliveira R, Sotero FD, Teodoro T. NeuroCOVID: critical review of neuropsychiatric manifestations of SARS-CoV-2 infection. Ir J Med Sci 2021; 190: 851-852.
30. Ortelli P, Ferrazzoli D, Sebastianelli L i wsp. Neuropsychological and neurophysiological correlates of fatigue in post-acute patients with neurological manifestations of COVID-19: Insights into a challenging symptom. J Neurol Sci 2021; 420: 117271.
31. Pantelis C, Mahesh Jayaram M, Hannan AJ i wsp. Neurological, neuropsychiatric and neurodevelopmental complications of COVID-19. Aust N Z J Psychiatry 2021; 55: 750-762.
32. Quinn ME, Joormann J. Control when it counts: change in executive control under stress predicts depression symptoms. Emotion 2015; 15: 522-530.
33. Ritchie K, Chan D, Watermeyer T. The cognitive consequences of the COVID-19 epidemic: collateral damage? Brain Commun 2020; 2: fcaa069.
34. Rogers JP, Chesney E, Oliver D i wsp. Psychiatric and neuropsychiatric presentations associated with severe coronavirus infections: a systematic review and meta-analysis with comparison to the COVID-19 pandemic. Lancet Psychiatry 2020; 7: 611-627.
35. Sinanović O, Muftić M, Sinanović S. COVID-19 pandemia: neuropsychiatric comorbidity and consequences. Psychiatr Danub 2020; 32: 236-244.
36. Sozzi M, Algeri L, Corsano M i wsp. Neuropsychology in the times of COVID-19. The role of the psychologist in taking charge of patients with alterations of cognitive functions. Front Neurol 2020; 11: 573207.
37. Szcześniak D, Rymaszewska J. The usefulness of the SLUMS test for diagnosis of mild cognitive impairment and dementia. Psychiatr Pol 2016; 50: 457-472.
38. Talarowska M, Florkowski A, Macander M, Gałecki P. The influenza infection and cognitive functions. Neuropsychiatria i Neuropsychologia 2010; 5: 149-154.
39. Talarowska M, Gałecki P, Maes M i wsp. Nitric oxide plasma concentration associated with cognitive impairment in patients with recurrent depressive disorder. Neurosci Lett 2012; 510: 127-131.
40. Talarowska M, Bobińska K, Zajączkowska M i wsp. Impact of oxidative/nitrosative stress and inflammation on cognitive functions in patients with recurrent depressive disorder. Med Sci Monit 2014a; 20: 110-115.
41. Talarowska M, Chodkiewicz J, Nawrocka N i wsp. Mental health and the SARS-COV-2 epidemic – Polish research study. Int J Environ Res Public Health 2020; 17: 7015.
42. Talarowska M, Szemraj J, Berk M i wsp. Oxidant/antioxidant imbalance is an inherent feature of depression. BMC Psychiatry 2015a; 15: 71.
43. Talarowska M, Szemraj J, Gałecki P. Myeloperoxidase gene expression and cognitive functions in depression. Adv Med Sci 2015b; 60: 1-5.
44. Talarowska M, Galecki P. Cognition and emotions in recurrent depressive disorders – the role of inflammation and the kynurenine pathway. Curr Pharm Des 2016; 22: 955-962.
45. Troyer EA, Kohn JN, Hong S. Are we facing a crashing wave of neuropsychiatric sequelae of COVID-19? Neuropsychiatric symptoms and potential immunologic mechanisms. Brain Behav Immun 2020; 87: 34-39.
46. Verkhratsky A, Li Q, Melino S i wsp. Can COVID-19 pandemic boost the epidemic of neurodegenerative diseases? Biol Direct 2020; 15: 28.
47. Wang F, Wu X, Gao J i wsp. The relationship of olfactory function and clinical traits in major depressive disorder. Behav Brain Res 2020; 386: 112594.
48. Woo MS, Malsy J, Pöttgen J i wsp. Frequent neurocognitive deficits after recovery from mild COVID-19. Brain Commun 2020; 2: fcaa205.
49. Yahiaoui-Doktor M, Luck T, Riedel-Heller SG i wsp. Olfactory function is associated with cognitive performance: results from the population based LIFE-Adult-Study. Alzheimers Res Ther 2019; 11: 43.
50. Zhou H, Lu S, Chen J i wsp. The landscape of cognitive function in recovered COVID-19 patients. J Psychiatr Res 2020; 129: 98-102.
51. Zhou J, Liu Ch, Sun Y i wsp. Cognitive disorders associated with hospitalization of COVID-19: Results from an observational cohort study. Brain Behav Immun 2021; 91: 383-392.
Pełna treść artykułu:Monika Talarowska. Funkcjonowanie poznawcze po przebytej infekcji wirusem SARS-CoV-2. Neuropsychiatria i Neuropsychologia 2021; 16: 109-115.
Wstęp
W pierwszych miesiącach pandemii wirusa SARS-CoV-2 doniesienia naukowe, ale również działania podejmowane na pierwszej linii frontu walki z nim koncentrowały się wokół łagodzenia objawów zespołu ostrej niewydolności oddechowej (severe acute respiratory syndrome coronavirus 2) (Bodnar i wsp. 2021). Takie postępowanie z pewnością było słuszne, gdyż to właśnie te symptomy najczęściej prowadziły i prowadzą do śmierci pacjentów. Jednak dziś, po ponad roku od ogłoszenia pierwszych przypadków zarażenia, wiemy, że odległe symptomy infekcji koronawirusem-2 daleko wykraczają poza utrzymujące się osłabienie układu oddechowego. Tematykę przedstawioną w niniejszym artykule autorka poruszała w jednej ze swoich wcześniejszych publikacji już w 2010 r. (Grypa i infekcje grypopochodne a funkcje poznawcze; Talarowska i wsp. 2010). Obecność objawów neuropoznawczych obserwowanych w przebiegu lub w konsekwencji zarażenia wirusem SARS-CoV-2 nie powinna być zaskoczeniem. Zaskakujące są natomiast ich nasilenie i czas trwania.
Prezentowana praca jest podsumowaniem dostępnych wyników badań oraz analiz teoretycznych dotyczących poznawczych konsekwencji infekcji koronawirusem-2. Przygotowując ją, autorka korzystała z doniesień naukowych prezentowanych w bazie PubMed (dostęp z 31.01.2021 r.; słowa kluczowe: cognition, cognitive functions, SARS-CoV-2, COVID-19, dysexecutive syndrome).
Neuro-SARS2 – najbardziej typowy obraz
W dostępnej literaturze można odnaleźć dwa nowe terminy, stworzone dla określenia deficytów neurologicznych, neuropoznawczych i neuropsychiatrycznych obserwowanych w przebiegu infekcji koronawirusem-2: Neuro-SARS oraz NeuroCOVID (neurological symptoms and neuropsychiatric disorders related to COVID-19) (Oliveira i wsp. 2021).
Zdaniem Ellula i wsp. (2020) oraz Mao i wsp. (2020) ponad jedna trzecia pacjentów w ostrej fazie COVID-19 prezentuje objawy typowe dla NeuroCOVID, zwykle występujące w ciągu pierwszych kilku dni jawnej symptomatologii klinicznej (tab. 1). Wśród pacjentów przebywających na oddziałach intensywnej opieki medycznej objawy te występują u ponad 80% (Helms i wsp. 2020). Co więcej, obecność symptomów z tej grupy wydaje się istotnym czynnikiem cięższego przebiegu choroby oraz zwiększa ryzyko zgonu (Li i wsp. 2020).

Wśród jednostek chorobowych wymienionych w tabeli 1 najczęściej są obserwowane zawroty i bóle głowy, utrata smaku i węchu, nasilony niepokój, objawy depresyjne oraz majaczenie (Banerjee i Viswanath 2020). Zdaniem Mao i wsp. (2020) nasilenie objawów neurologicznych jest powiązane z ciężkością przebiegu choroby, poziomem stężenia przeciwciał w surowicy oraz liczbą limfocytów we krwi badanych. Udary, encefalopatie oraz obwodowe neuropatie występują znacznie rzadziej, głównie u osób starszych i z obniżoną odpornością (Mao i wsp. 2020). Warto wspomnieć o istnieniu teoretycznego ryzyka, że każdy pacjent zakażony koronawirusem może rozwinąć objawy podobne do otępienia w przebiegu choroby Parkinsona (w modelach zwierzęcych wirus namnaża się bowiem w jądrach podstawy mózgu) (Fishman i wsp. 1985).
Pierwsze doniesienia naukowe dotyczące powirusowych zmian mózgowych pojawiły się już na początku XX w. Zapalenie mózgu von Economo to zapalenie mózgu o przypuszczalnie wirusowej etiologii. Zostało ono opisane w 1917 r. przez Constantina von Economo, w trakcie panującej w Europie epidemii grypy hiszpanki. Występowało ono epidemicznie, początkowo, od 1915 r., na Starym Kontynencie, a później na całym świecie (pandemia śpiączkowego zapalenia mózgu przypadła na lata 1917–1924). Choroba występowała sezonowo, nawracając między styczniem a marcem każdego roku (Banerjee i Viswanath 2020).
Przyczyny zaburzeń funkcji poznawczych w przebiegu infekcji SARS-CoV-2
Wyniki dostępnych badań klinicznych wskazują, że do zmian czynnościowych oraz anatomicznych w przebiegu infekcji wirusem SARS-CoV-2 może dochodzić na kilka sposobów. Przede wszystkim wirus może bezpośrednio atakować mózg (poprzez nerw węchowy rozprzestrzenia się do pnia mózgu i innych jego obszarów, a także przedostaje się do płynu mózgowo-rdzeniowego; Li i wsp. 2020b).
Możliwe jest również zainfekowanie mózgu rozpoczynające się od bezpośredniego przerwania nerwów obwodowych w wyniku naruszenia ciągłości skóry – transmisja międzysynaptyczna wielu koronawirusów nie budzi dziś wątpliwości; Li i wsp. 2020b). Obecność koronawirusa 2 potwierdzono w neuronach, mikrogleju, astrocytach, komórkach śródbłonka, komórkach wyściółki oraz w nerwowych komórkach macierzystych (neural stem cells – NSC) (Sinanović i wsp. 2020).
Badania autopsyjne przeprowadzane w czasie epidemii SARS w 2004 r. wykazały obecność wirusa SARS-CoV-1 przede wszystkim w korze mózgowej oraz podwzgórzu chorych, a także w płynie mózgowo-rdzeniowym (Lau i wsp. 2004). W przypadku koronawirusa 2 wyniki badań nad płynem mózgowo-rdzeniowym pobranym od pacjentów nie dają jednoznacznych odpowiedzi (Andriuta i wsp. 2020).
Kolejnym możliwym mechanizmem uszkodzeń jest etiologia naczyniowa oraz zapalna, obejmująca cały organizm lub tylko mózg. Jednak nadal nie jest pewne, czy zmiany te są bezpośrednią konsekwencją infekcji, czy też następstwem całej kaskady procesów zachodzących w organizmie w jej wyniku (tzw. burza cytokinowa oraz neurozapalenie) (Carossino i wsp. 2020; Mehta i wsp. 2020). Prawdopodobny mechanizm patofizjologiczny może być powiązany z osłabieniem układu odporności wrodzonej, stanowiącego pierwszą linię obrony gospodarza, a także ze zmianami w morfologii komórek odpornościowych (tzw. efekt cytotoksyczny), czy nawet z procesem autoimmunizacji (Jasti i wsp. 2021; Pantelis i wsp. 2021).
Istota biała mózgu jest szczególnie podatna na uszkodzenia niedokrwienne w przebiegu COVID-19 (Bougakov i wsp. 2021), ma również kluczowe znaczenie dla prawidłowej sprawności poznawczej (Forkel i wsp. 2021). Istnieje coraz więcej dowodów na to, że hipoperfuzja mózgowa przyspiesza akumulację amyloidu β (Aβ) i jest powiązana z patologią białka tau oraz TDP-43 (Miners i wsp. 2020). Kolejnym obszarem mózgu wrażliwym na infekcje koronawirusowe są układy hipokampa, co zwiększa prawdopodobieństwo deficytów pamięci oraz ryzyko wystąpienia objawów choroby Alzheimera w późniejszym czasie (Ritchie i wsp. 2020).
Poziom doświadczanego stresu, związanego pośrednio i bezpośrednio z infekcją wirusową, również może być istotnym czynnikiem ryzyka rozwoju deficytów poznawczych w przebiegu infekcji wirusem SARS-CoV-2 [zdaniem Quinn i Joormann (2015) efektywność funkcji wykonawczych oraz kontroli poznawczej słabnie wraz z nasilającym się poziomem stresu]. Nadmierne pobudzenie osi podwzgórze–przysadka–nadnercza (hypothalamic–pituitary–adrenal axis – oś HPA), uruchamiając szereg mechanizmów sprzężenia zwrotnego, prowadzi do nadmiernego uwalniania hormonów steroidowych upośledzających zwrotnie funkcjonowanie układu odpornościowego. Zmiany te mogą przyspieszyć infekcję lub pogorszyć jej przebieg, a w dalszej perspektywie prowadzić do szeregu opisanych powyżej objawów neuropsychiatrycznych i neuropoznawczych (Dinakaran i wsp. 2020). Warto również zauważyć, że poziomy cytokin prozapalnych w osoczu krwi (np. interleukiny (IL)-6, czynnika martwicy nowotworu α (TNF-α), IL-8, IL-10, IL-2R) były znacznie wyższe u pacjentów z infekcją koronawirusa 2, którzy zmarli, co może leżeć u podstaw wspomnianej encefalopatii (Troyer i wsp. 2020).
Strukturą mózgu szczególnie podatną na zmiany funkcjonalne wywołane stresem i dysregulacją osi HPA są układy hipokampów. Dochodzi wówczas m.in. do spadku ekspresji czynnika neurotroficznego pochodzenia mózgowego (brain-derived neurotrophic factor – BDNF), osłabienia długotrwałego wzmocnienia synaptycznego (long-term potentiation – LTP) oraz zahamowania neurogenezy w zakręcie zębatym (dentate gyrus – DG) (Talarowska i Gałecki 2016). Kortykosteroidy, których nadmierne wydzielanie stwierdza się w sytuacjach stresogennych, w tym w zaburzeniach depresyjnych, nie tylko wywierają silny negatywny wpływ na rejon hipokampa i ciała migdałowatego, lecz także upośledzają funkcjonowanie kory przedczołowej, zaangażowanej w prawidłowy przebieg funkcji wykonawczych (Krause-Utz i wsp. 2012).
W wielu wcześniejszych pracach autorka wykazywała bezpośredni związek cytokin pro- i przeciwzapalnych z osłabieniem efektywności poznawczej badanych, szczególnie w zakresie sprawności funkcji wykonawczych (Talarowska i wsp. 2012; Talarowska i wsp. 2014a; Talarowska i wsp. 2014b; Talarowska i wsp. 2015a; Talarowska i wsp. 2015b) (z uwagi na temat niniejszej pracy autorka odsyła zainteresowanych czytelników do tych publikacji). Mechanizmy te wydają się mieć istotne znaczenie również w przypadku deficytów poznawczych powiązanych z infekcją wirusem SARS-CoV-2.
Warto podkreślić, że niezależnie od przebytej lub aktywnej infekcji wirusem SARS-CoV-2 zaburzenia zmysłu węchu w postaci jego utraty (anosmia) lub osłabienia (hiposmia) są obserwowane zarówno u pacjentów z objawami depresji (Wang i wsp. 2020), jak i z potwierdzonymi deficytami poznawczymi (Yahiaoui-Doktor i wsp. 2019), a markery aktywnego procesu zapalnego są jednymi z istotnych czynników osłabiających barierę krew–mózg (Bobińska i wsp. 2016).
Funkcje poznawcze a COVID-19
W dalszej części artykułu zostanie przedstawiona analiza możliwych objawów ze sfery poznawczej, które można zauważyć u pacjentów w trakcie aktywnej infekcji koronawirusem-2 lub po jej zakończeniu (ryc. 1).

Przebieg zaburzeń funkcji poznawczych w tej grupie chorych jest zróżnicowany – od deficytów wybiórczych, specyficznych i łagodnych po zmiany uogólnione i znacznie nasilone. Pogorszenie funkcjonowania poznawczego może dotyczyć różnych jego aspektów. Wśród częstych objawów wymienia się: osłabienie pamięci krótkotrwałej, osłabienie funkcji uwagi oraz funkcji wykonawczych (m.in. trudności z hamowaniem reakcji, planowaniem i rozwiązywaniem problemów, osłabienie elastyczności poznawczej) (Li i wsp. 2021).
Należy pamiętać, że ocena funkcjonowania poznawczego pacjentów z COVID-19 nie może się ograniczać do stosowania tzw. testów przesiewowych pozwalających na ocenę globalnego poziomu funkcjonowania poznawczego! (Sozzi i wsp. 2020).
Łagodne zaburzenia funkcji poznawczych
Pojęcie „łagodne zaburzenia funkcji poznawczych” (mild cognitive impairment – MCI) przez lata było utożsamiane ze stanem przejściowym pomiędzy niezaburzonym funkcjonowaniem poznawczym a objawami choroby Alzheimera. Obecnie używa się go w szerszym znaczeniu – w odniesieniu do pacjentów bez rozpoznanego otępienia, jednak z widocznymi deficytami poznawczymi, u których istnieje duże ryzyko przejścia choroby w otępienie (Szcześniak i Rymaszewska 2016).
Ogólne kryteria rozpoznawania MCI opracowane przez National Institute on Aging są następujące: 1) zaniepokojenie związane ze zmianą sprawności poznawczej; 2) pogorszenie dotyczące jednego lub kilku obszarów poznawczych; 3) zachowanie samodzielnej zdolności codziennego funkcjonowania; 4) brak otępienia (Albert i wsp. 2011) (tab. 2).

Łagodne zaburzenia poznawcze w postaci osłabienia efektywności pamięci krótkotrwałej oraz procesów uwagi obserwuje się zarówno u osób starszych (po 65. roku życia), jak i wśród młodych pacjentów z łagodnym przebiegiem infekcji koronawirusem-2 (Chung i wsp. 2020; Woo i wsp. 2020).
Podłużne badania nad osobami, które z różnych przyczyn chorobowych wymagały stosowania technik wspomagania oddechu, wykazały utrzymujące się osłabienie efektywności procesów uwagi, pamięci krótkotrwałej, płynności werbalnej, szybkości przetwarzania informacji oraz funkcji wykonawczych. Po roku od wypisania z oddziału intensywnej opieki medycznej opisane objawy nadal występowały u 78% pacjentów, a po upływie dwóch lat – u ponad 50% z nich (Mikkelsen i wsp. 2012). Wyniki cytowanych badań mogą mieć istotne znaczenie w przypadku pacjentów z cięższym przebiegiem infekcji koronawirusem-2 (tab. 3).

Zespół dysfunkcji wykonawczych
Drugą grupą objawów neuropoznawczych obserwowanych u chorych w trakcie lub po przebytej infekcji koronawirusem-2 są objawy zespołu dysfunkcji wykonawczych (dysexecutive syndrome) (Ortelli i wsp. 2021). Helms i wsp. (2020) zaobserwowali objawy tego zespołu u 14 pacjentów z 39-osobowej grupy zainfekowanej wirusem SARS-CoV-2. Porównywalne rezultaty uzyskali Zhou i wsp. (2020) w przeprowadzonym przez siebie badaniu (29 „ozdrowieńców” w wieku 30–64 lata oraz 29 osób bez przebytej infekcji koronawirusem-2), w którym wykorzystano test łączenia punktów (Trail Making Test – TMT), test ciągłego wykonania (Continuous Performance Test – służy do oceny procesów uwagi, a dokładnie zaburzeń ciągłości i selektywności uwagi i jej odporności na dystraktory) oraz test powtarzania cyfr. W badaniu oceniano również stężenie wybranych cytokin: IL-2, IL-4, IL-6, IL-10, TNF-α, interferon γ (IFN-γ) oraz białko C-reaktywne (C-reactive protein – CRP). Autorzy odnotowali nie tylko słabsze wykonanie wymienionych testów w grupie „ozdrowieńców” w porównaniu z osobami zdrowymi, lecz także korelację uzyskanych wyników ze stężeniem oznaczonych cytokin (Zhou i wsp. 2020) (tab. 4).

Co można zrobić?
Badania epidemiologiczne potwierdzają związek między chorobami neuropsychiatrycznymi a infekcjami wirusowymi. Procesy zapalne (o ostrym i przewlekłym charakterze) mogą mieć wpływ na funkcjonowanie rozwijającego się mózgu, powstawanie chorób neurodegeneracyjnych oraz prawdopodobnie ujawnianie się niektórych chorób psychicznych, głównie schizofrenii i chorób neurodegeneracyjnych (Talarowska i wsp. 2010). W diagnozie neuropsychologicznej pacjentów po przebytej infekcji wirusem SARS-CoV-2 należy również uwzględnić możliwe interakcje czynników biologicznych oraz psychologicznych związanych z sytuacją zachorowania (osamotnienie, brak kontaktów z bliskimi, lęk o zdrowie i życie) (Talarowska i wsp. 2020).
Warto pamiętać, że dominujące obecnie obawy związane z ryzykiem zakażenia, męczące wszystkich ograniczenia i konieczność izolacji miną. Co prawda nie wiadomo, jak długo może jeszcze potrwać obecna sytuacja, jednak konieczne jest zwrócenie uwagi na możliwe długoterminowe konsekwencje poznawcze przebytej infekcji wirusem SARS-CoV-2 (Negrini i wsp. 2021). Ponadto zmiany w ośrodkowym oraz obwodowym układzie nerwowym, obserwowane w przebiegu zakażenia wirusem SARS-CoV-2 mogą w niedalekiej przyszłości znacznie zwiększyć częstość występowania chorób neurodegeneracyjnych (Verkhratsky i wsp. 2020).
Konieczne w przypadku wystąpienia nasilonych objawów neurologicznych wydaje się również przeprowadzenie szczegółowej diagnostyki neuropsychologicznej w opisanym powyżej zakresie. Może się to przyczynić w znaczącym stopniu do złagodzenia cierpienia pacjentów oraz ich rodzin oraz przyspieszyć powrót do zdrowia.
Piśmiennictwo
1. https://www.statista.com/statistics/1087466/covid19-cases-recoveries-deaths-worldwide/ (dostęp: 31.01.2021 r.).
2. Albert MS, DeKosky ST, Dickson D i wsp. The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement 2011; 7: 270-279.
3. Andriuta D, Roger PA, Thibault W i wsp. COVID-19 encephalopathy: detection of antibodies against SARS-CoV-2 in CSF. J Neurol 2020; 267: 2810-2811.
4. Banerjee D, Viswanath B. Neuropsychiatric manifestations of COVID-19 and possible pathogenic mechanisms: Insights from other coronaviruses. Asian J Psychiatr 2020; 54: 102350.
5. Bobińska K, Szemraj J, Czarny P, Gałecki P. Role of MMP-2, MMP-7, MMP-9 and TIMP-2 in the development of recurrent depressive disorder. J Affect Disord 2016; 205: 119-129.
6. Bodnar B, Patel K, Ho W i wsp. Cellular mechanisms underlying neurological/neuropsychiatric manifestations of COVID-19. J Med Virol 2021; 93: 1983-1998.
7. Bougakov D, Podell K, Goldberg E. Multiple neuroinvasive pathways in COVID-19. Mol Neurobiol 2021; 58: 564-575.
8. Carossino M, Ip HS, Richt JA i wsp. Detection of SARS-CoV-2 by RNAscope® in situ hybridization and immunohistochemistry techniques. Arch Virol 2020; 165: 2373-2377.
9. Chan RC. Dysexecutive symptoms among a non-clinical sample: a study with the use of the Dysexecutive Questionnaire. Br J Psychol 2001; 92 (Pt 3): 551-565.
10. Chung HY, Wickel J, Brunkhorst FM, Geis C. Sepsis-associated encephalopathy: from delirium to dementia? J Clin Med 2020; 9: 703.
11. Dinakaran D, Manjunatha N, Kumar CN, Suresh BM. Neuropsychiatric aspects of COVID-19 pandemic: A selective review. Asian J Psychiatr 2020; 53: 102188.
12. Ellul MA, Benjamin L, Singh B i wsp. Neurological associations of COVID-19. Lancet Neurol 2020; 19: 767-783.
13. Farhan R, Llopis P. Psychiatric and neuropsychiatric syndromes and COVID-19. Lancet Psychiatry 2020; 7: 736.
14. Fishman PS, Gass JS, Swoveland PT i wsp. Infection of the basal ganglia by a murine coronavirus. Science 1985; 229: 877-879.
15. Forkel SJ, Friedrich P, Thiebaut de Schotten M, Howells H. White matter variability, cognition, and disorders: a systematic review. Brain Struct Funct 2021. doi: 10.1007/s00429-021-02382-w.
16. Helms J, Kremer S, Merdji H. Neurologic features in severe SARS-CoV-2 infection. N Engl J Med 2020; 382: 2268-2270.
17. Jasti M, Nalleballe K, Dandu V, Onteddu S. A review of pathophysiology and neuropsychiatric manifestations of COVID-19. J Neurol 2021; 268: 2007-2012.
18. Krause-Utz A, Oei NY, Niedtfeld I i wsp. Influence of emotional distraction on working memory performance in borderline personality disorder. Psychol Med 2012; 42: 2181-2192.
19. Lau KK, Yu WC, Chu CM i wsp. Possible central nervous system infection by SARS coronavirus. Emerging. Infect Dis 2004; 10: 342-344.
20. Li H, Xue Q, Xu X. Involvement of the nervous system in SARS-CoV-2 infection. Neurotox Res 2020a; 38: 1-7.
21. Li J, Long X, Zhang Q i wsp. Emerging evidence for neuropsycho-consequences of COVID-19. Curr Neuropharmacol 2021; 19: 92-96.
22. Li YC, Bai WZ, Hashikawa T. The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients. J Med Virol 2020b; 92: 552-555.
23. Mao L, Jin H, Wang M i wsp. Neurologic manifestations of hospitalized patients with coronavirus disease 2019 in Wuhan, China. JAMA Neurol 2020; 77: 683-690.
24. Mehta P, McAuley DF, Brown M i wsp., on behalf of the HLH Across Speciality Collaboration, UK. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet 2020; 395: 1033-1034.
25. Mikkelsen ME, Christie JD, Lanken PN i wsp. The adult respiratory distress syndrome Cognitive outcomes study. Am J Respir Crit Care Med 2012; 185: 1307-1315.
26. Miners S, Kehoe PG, Love S. Cognitive impact of COVID-19: looping beyond the short term. Alzheimers Res Ther 2020; 12: 170.
27. Mukaetova-Ladinska EB, Kronenberg G. Psychological and neuropsychiatric implications of COVID-19. Eur Arch Psychiatry Clin Neurosci 2021; 271: 235-248.
28. Negrini F, Ferrario I, Mazziotti D i wsp. Neuropsychological features of severe hospitalized coronavirus disease 2019 patients at clinical stability and clues for Postacute Rehabilitation. Arch Phys Med Rehabil 2021; 102: 155-158.
29. Oliveira R, Sotero FD, Teodoro T. NeuroCOVID: critical review of neuropsychiatric manifestations of SARS-CoV-2 infection. Ir J Med Sci 2021; 190: 851-852.
30. Ortelli P, Ferrazzoli D, Sebastianelli L i wsp. Neuropsychological and neurophysiological correlates of fatigue in post-acute patients with neurological manifestations of COVID-19: Insights into a challenging symptom. J Neurol Sci 2021; 420: 117271.
31. Pantelis C, Mahesh Jayaram M, Hannan AJ i wsp. Neurological, neuropsychiatric and neurodevelopmental complications of COVID-19. Aust N Z J Psychiatry 2021; 55: 750-762.
32. Quinn ME, Joormann J. Control when it counts: change in executive control under stress predicts depression symptoms. Emotion 2015; 15: 522-530.
33. Ritchie K, Chan D, Watermeyer T. The cognitive consequences of the COVID-19 epidemic: collateral damage? Brain Commun 2020; 2: fcaa069.
34. Rogers JP, Chesney E, Oliver D i wsp. Psychiatric and neuropsychiatric presentations associated with severe coronavirus infections: a systematic review and meta-analysis with comparison to the COVID-19 pandemic. Lancet Psychiatry 2020; 7: 611-627.
35. Sinanović O, Muftić M, Sinanović S. COVID-19 pandemia: neuropsychiatric comorbidity and consequences. Psychiatr Danub 2020; 32: 236-244.
36. Sozzi M, Algeri L, Corsano M i wsp. Neuropsychology in the times of COVID-19. The role of the psychologist in taking charge of patients with alterations of cognitive functions. Front Neurol 2020; 11: 573207.
37. Szcześniak D, Rymaszewska J. The usefulness of the SLUMS test for diagnosis of mild cognitive impairment and dementia. Psychiatr Pol 2016; 50: 457-472.
38. Talarowska M, Florkowski A, Macander M, Gałecki P. The influenza infection and cognitive functions. Neuropsychiatria i Neuropsychologia 2010; 5: 149-154.
39. Talarowska M, Gałecki P, Maes M i wsp. Nitric oxide plasma concentration associated with cognitive impairment in patients with recurrent depressive disorder. Neurosci Lett 2012; 510: 127-131.
40. Talarowska M, Bobińska K, Zajączkowska M i wsp. Impact of oxidative/nitrosative stress and inflammation on cognitive functions in patients with recurrent depressive disorder. Med Sci Monit 2014a; 20: 110-115.
41. Talarowska M, Chodkiewicz J, Nawrocka N i wsp. Mental health and the SARS-COV-2 epidemic – Polish research study. Int J Environ Res Public Health 2020; 17: 7015.
42. Talarowska M, Szemraj J, Berk M i wsp. Oxidant/antioxidant imbalance is an inherent feature of depression. BMC Psychiatry 2015a; 15: 71.
43. Talarowska M, Szemraj J, Gałecki P. Myeloperoxidase gene expression and cognitive functions in depression. Adv Med Sci 2015b; 60: 1-5.
44. Talarowska M, Galecki P. Cognition and emotions in recurrent depressive disorders – the role of inflammation and the kynurenine pathway. Curr Pharm Des 2016; 22: 955-962.
45. Troyer EA, Kohn JN, Hong S. Are we facing a crashing wave of neuropsychiatric sequelae of COVID-19? Neuropsychiatric symptoms and potential immunologic mechanisms. Brain Behav Immun 2020; 87: 34-39.
46. Verkhratsky A, Li Q, Melino S i wsp. Can COVID-19 pandemic boost the epidemic of neurodegenerative diseases? Biol Direct 2020; 15: 28.
47. Wang F, Wu X, Gao J i wsp. The relationship of olfactory function and clinical traits in major depressive disorder. Behav Brain Res 2020; 386: 112594.
48. Woo MS, Malsy J, Pöttgen J i wsp. Frequent neurocognitive deficits after recovery from mild COVID-19. Brain Commun 2020; 2: fcaa205.
49. Yahiaoui-Doktor M, Luck T, Riedel-Heller SG i wsp. Olfactory function is associated with cognitive performance: results from the population based LIFE-Adult-Study. Alzheimers Res Ther 2019; 11: 43.
50. Zhou H, Lu S, Chen J i wsp. The landscape of cognitive function in recovered COVID-19 patients. J Psychiatr Res 2020; 129: 98-102.
51. Zhou J, Liu Ch, Sun Y i wsp. Cognitive disorders associated with hospitalization of COVID-19: Results from an observational cohort study. Brain Behav Immun 2021; 91: 383-392.
Pełna treść artykułu:Monika Talarowska. Funkcjonowanie poznawcze po przebytej infekcji wirusem SARS-CoV-2. Neuropsychiatria i Neuropsychologia 2021; 16: 109-115.





